柚皮苷调控心肌核因子 NF-κB炎症信号通路对糖尿病心肌病大鼠防治作用①
游 琼 吴 铿 涂焰明 李 腾 莫海亮 叶少强 黄瑞娜 梁建光
(广东医学院附属医院心血管内科,湛江524001)
近年来大量研究发现糖尿病及糖尿病心肌病心肌组织中伴有大量的炎性细胞浸润,炎症因子的异常表达,提示炎症反应参与了糖尿病心肌病的发病[1-5]。NF-кB的激活与糖尿病心肌病的发生及发展密切相关,其作为糖尿病心肌病发病机制的一个许多相关途径中的中心因子,对高血糖状态下的心肌结构、功能的改变起重要作用,NF-κB激活后可调控多种炎性因子、细胞因子(如 TNF-α、IL-6、IL-1β)的表达,从而参与心肌的炎性损伤[1]。柚皮苷,草药骨碎补、枳实和橘红的主要有效成分,其糖苷配体是 4',5,7-羟基黄酮,糖基为鼠李糖基 β-1,2-葡萄糖。已作为抗炎、抗病毒、镇痛、减少血栓广泛应用于临床,另外还有报道其具有降血糖、降血脂、降血压等药理活性[6]。本课题组前期的实验研究表明柚皮苷对糖尿病大鼠的心肌损伤具有明显的改善作用,其机制与柚皮苷改善胰岛素抵抗、阻断FFA活化等作用有关[7]。鉴于NF-кB通路激活诱导的炎性反应在糖尿病心肌病发病中的重要作用,柚皮苷在调节心肌糖脂代谢基础上是否进一步抑制了NF-кB的激活以减轻心肌炎性反应、阻抑糖尿病心肌病的发生、发展呢?值得进一步探讨研究。
1 材料与方法
1.1 主要材料
1.1.1 动物 Wistar大鼠,雄性,体重(160±20)克,SPF级,合格评号SCXK粤2006-0015,由南方医科大学实验动物中心提供。饲养于广东医学院动物实验室,饲养条件为恒温(24±2)℃,相对湿度50% ~70%,饲养环境符合实验动物环境设施要求。
1.1.2 药物 Naringin粉沫(广东省梅雁蓝藻公司,纯度98%);链脲佐菌素(STZ,美国Sigma公司);血糖、胰岛素试纸(强生‘中国'医疗器材有限公司);糖化血清蛋白测试盒(南京建成生物工程研究所);低密度、高密度脂蛋白胆固醇试剂盒、总胆固醇试剂盒、甘油三酯(北京北化康东临床试剂有限公司);游离脂肪酸测定试剂盒(北京普利莱基因技术有限公司);生物素标记山羊抗兔IgG/小IgG二抗试剂盒(北京中杉金桥生物技术有限公司);NF-κB多克隆抗体试剂盒(北京博奥森生物技术有限公司)。
1.2 方法
1.2.1 建模 实验分为正常对照组(NC组)、模型对照组(MC组)。NC组一直采用基础饲料喂养;MC组采用高糖高脂饲料喂养6周诱导大鼠IR状态,然后一次性给予腹腔注射1%链脲佐菌素30 mg/kg(pH=4.5,4℃配制,随配随用)部分破坏胰岛β细胞功能,72小时后连续2次空腹血糖 ≥11.1 mmol/L,胰岛素敏感指数降低,且有多饮、多尿、多食现象确定为糖尿病模型,持续高糖高脂饲料喂养6周。于实验结束时禁食12小时,麻醉,腹主动脉采血后迅速取出心脏,用生理盐水制成10%的组织匀浆,检测相关指标,糖尿病模型组大鼠心肌细胞形态学异常改变可认为DC建模成功[8]。共46只大鼠完成实验,NC组10只,MC组36只(建模成功率100%,无死亡)。
1.2.2 分组给药 MC大鼠分为4组:Naringin高、中、低剂量组(NH、NM、NL组)和模型对照组(MC组),每组9只。在确定2型糖尿病模型成功后开始给药,参考 Naringin对 Wistar大鼠系列实验研究[9-11],将 NH、NM、NL 组分别设置为 10、20、40 mg/kg;正常组(NC组)和MC组则予以等体积的蒸馏水。
1.2.3 放射免疫分析外周血炎症因子 断尾取血,将3 ml血以3 500 r/min离心10分钟,取上清-70℃保存,按试剂盒说明书操作分别进行放射免疫分析法检测 TNF-α、IL-6、IL-1β。
1.2.4 免疫组织化学法测定 取心肌组织切片,常规脱蜡至水,3%过氧化氢(H2O2)处理清楚内源性过氧化物酶。将切片浸入0.01 mol/L,pH=6.0的枸橼酸缓冲液中,高压加热修复3分钟后。按试剂盒说明书操作进行免疫组织化学法检测心肌NF-κB表达。采用Motic 6.0数码医学图像分析系统测定灰度值及阳性光密度。
1.2.5 心肌组织的形态学观察 动物处死后,进行组织取材、固定、脱水、透明、浸蜡、石蜡包埋、切片,常规HE染色,光镜下观察心肌细胞形态,透射电镜观察心肌细胞超微结构,每张切片观察10个视野。
1.3 统计学方法 所有数据以x±s表示,采用SPSS13.0软件进行统计分析,所有数据进行正态分布检验。统计学方法采用两组间的比较采用t检验,多组间的比较采用One-Way ANOVA分析法,其中两两比较用SNK法,并进行方差齐性检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠脂糖代谢指标比较 与正常对照组相比,模型对照组空腹血糖(FBG)、糖化血红蛋白(HbAlc)、空腹胰岛素(FINS)、胰岛素敏感指数(HOMA-IR)以及游离脂肪酸(FFA)、胆固醇(CHOL)、低密度脂蛋白(LDL-C)、甘油三酯(TG)均显著升高(P<0.05);而在NH、NM组的糖脂代谢指标不同程度降低,差异有统计学意义(P<0.05)。结果提示,Naringin呈剂量依赖性改善DC糖脂代谢的作用。HOMA-IR=(FBG×FINS)/22.5,见表1。
2.2 各组大鼠心肌形态学改变 糖尿病心肌病(DC组)大鼠心肌细胞和线粒体排列紊乱,肌纤维排列紊乱,心肌细胞肥大、线粒体肿胀明显,嵴变宽,细胞核固缩、裂解;高剂量柚皮苷治疗组(HN组)大鼠心肌纤维呈短柱状,心肌细胞排列整齐,致密,细胞核呈椭圆形,线粒体肿胀不明显,嵴间隙无增宽,排列有序,接近正常,中剂量柚皮苷组(MN组)次之,低剂量柚皮苷干预组(LN组)无明显差异,且呈显著浓度依赖性,见图1、2。
2.3 各组大鼠NF-κB及其下游炎症因子改变 糖尿病心肌病(DC组)大鼠心肌NF-κB蛋白及外周血
TNF-α、IL-6、IL-1β分泌增加,不同剂量柚皮苷治疗后使其表达不同程度下降,仅高剂量柚皮苷组(HN组)降低水平有统计学差异(P<0.05),见图3、表2。

表1 各组大鼠脂糖代谢指标(x±s)Tab.1 The comparison of lipid sugar metabolism index in six groups(x±s)

表2 各组大鼠心肌NF-κB的阳性平均光密度以及外周血炎症因子(x±s)Tab.2 The comparison of myocardium NF-κB positive vascular density and peripheral inflammation factors in six groups(x±s)
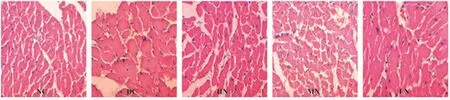
图1 各组大鼠心肌HE染色比较(×400)Fig.1 The comparison of HE staining of myocardiumin different groups(×400)

图2 各组大鼠心肌超微结构比较(×8 900)Fig.2 The comparison of myocardial cell perspective electron microscope in different groups(×8 900)

图3 各组大鼠心肌NF-κB蛋白免疫组化比较(×400)Fig.3 The comparison of NF-κB expression of myocardium in different group(×400)
3 讨论
基于糖尿病心肌病的“消渴、胸痹”症状归属于“消渴病心积”范畴。在临床辩证中,消渴病长期阴虚燥热、脾虚失运、痰湿内生、气阴两虚、阴损及阳、阴阳两虚等累及心脏,提示糖尿病心肌病中医病机多属“气阴两虚、痰瘀互结、心脉痹阻”。根据中医“消补兼施、同治心络中痰瘀”的理论,国医大师邓铁涛方剂中擅用理气健脾中药化橘红治本病[12]。经化橘红提取分离测定及体外筛选等实验摸索,我们拟定以其有效成分柚皮苷治疗本病。本实验高糖高脂喂养和一次性腹腔注射低剂量STZ建立的糖尿病心肌病大鼠模型糖脂代谢障碍和心肌形态学损伤明显,而高、中剂量柚皮苷治疗6周后明显改善。该结果与以往的报道类似[7,13]。
NF-κB是对炎症、免疫调节较为敏感的转录因子,在氧化还原反应过程中起着重要作用。高血糖诱导NF-κB通路激活对心血管的作用机制具有特异性:如对微血管,高血糖可引起AGE的形成及蛋白激酶C(PKC)的激活,从而激活NF-κB导致微循环病变[14],而在心肌细胞器,2型糖尿病 NF-κB 的激活,而导致氧化应激的增加,并引起心肌线粒体功能障碍及心功能不全[15]。糖尿病状态时,NF-κB活化可产生大量的炎症介质(如 TNF-α、IL-6、IL-1β等),引起炎症反应的发生,同时激活NF-κB信号通路的级联反应,从而扩大心肌局部炎症损伤。而我们前期研究提示糖尿病心肌病心肌损伤与糖尿病机体内免疫炎症反应密切相关,而不是单纯血糖、血脂升高及心功能不全的直接后果,其作用机制可能是多方面的因素共同启动宿主剧烈的免疫炎症应答,通过TLR4激动后介导NF-κB信号转导途径引起细胞功能紊乱[3]。因此,柚皮苷单一改善糖脂代谢障碍并不能完全解析其对糖尿病心肌病心肌损伤的防治作用,本实验进步研究提示心肌组织NF-κB蛋白的表达和外周血TNF-α、IL-6、IL-1β含量增加,观察到了心肌组织NF-κB途径的转录激活,而高、中剂量柚皮苷治疗6周明显抑制了糖尿病心肌病的NF-κB以及其下游细胞因子的上调,说明柚皮苷可能呈剂量依赖性阻断糖尿病心肌病的NF-κB途径的激活,最终防治心肌形态学损伤。
综上所述,高糖诱导NF-κB信号通路的级联反应参与糖尿病心肌病的发生发展过程,柚皮苷呈剂量依赖性对糖尿病心肌病具有明显的防治作用,其可能机制是有效地改善心肌糖脂代谢,下调了转录因子NF-κB的表达,继而抑制了NF-κB通路的激活。
1 Lorenzo O,Picatoste B,Ares-Carrasco S et al.Potential role of nuclear factor κB in diabetic cardiomyopathy.[J]Mediators Inflamm,2011;2011:652097.
2 Boudina S,Abel E D.Diabetic cardiomyopathy,causes and effects[J].Rev Endocr Metab Disord,2010;11(1):31-39.
3 吴 铿,游 琼,莫海亮 et al.糖尿病心肌病外周血单核细胞Toll样受体4、肿瘤坏死因子-α的表达及其与心肌灌注的相关性[J].中华心血管病杂志,2011;39(6):503-507.
4 Aneja A,Tang W H,Bansilal S et al.Diabetic cardiomyopathy:insights into pathogenesis,diagnostic challenges,and therapeutic options.[J]Am J Med,2008;121(9):748-757.
5 Boudina S,Abel E D.Diabetic cardiomyopathy revisited[J].Circulation,2007;115(25):3213-3223.
6 游 琼,吴 铿.柚皮苷的心血管药理作用[J].广东医学,2010;31(22):3006-3008.
7 吴 铿,游 琼,黄瑞娜 et al.柚皮苷能够通过调控心肌PPARγ表达对糖尿病心肌病大鼠模型心肌损伤起着防治作用[J].中国药理学通报,2012;28(4):526-530.
8 董世芬,洪 缨,樊江波et al.实验性2型糖尿病心肌病大鼠模型的建立与评价[J].中国实验动物学报,2009;17(4):246-251.
9 Rajadurai M,Stanely Mainzen,Prince P.Preventive effect of naringin on cardiac markers,electrocardiographic patterns and lysosomal hydrolases in normal and isoproterenol-induced myocardial infarction in Wistar rats[J].Toxicology,2007;230(2-3):178-188.
10 Rajadurai M,Prince P S.Preventive effect of naringin on cardiac mitochondrial enzymes during isoproterenol-induced myocardial infarction in rats:a transmission electron microscopic study[J].J Biochem Mol Toxicol,2007;21(6):354-361.
11 Rajadurai M,Prince P S.Naringin ameliorates mitochondrial lipid peroxides,antioxidants and lipids in isoproterenol-induced myocardial infarction in Wistar rats [J].Phytother Res,2009;23(3):358-362.
12 邱仕君.邓铁涛医案与研究[M].北京:人民卫生出版社,2009:86-87.
13 梁建光,吴 铿.柚皮苷对糖尿病心肌病大鼠心肌超微结构和缺氧诱导因子1α的影响[J].国际心血管病杂志,2012;39(2):113-117.
14 Picchi A,Capobianco S,Qiu T et al.Coronary microvascular dysfunction in diabetes mellitus:A Review[J].World J Cardiol,2010;2(11):377-390.
15 Mariappan N,Elks C M,Sriramula S et al.NF-kappaB-induced Oxidative stress contributes to mitochondrial and cardiac dysfunction in type Ⅱ diabetes[J].Cardiovasc Res,2010;85:473-483.