丙戊酸钠在γδT细胞对肺癌A549细胞免疫中的作用
杜发旺 李琼雅 王 娟 杜先智 (重庆医科大学附属第二医院呼吸内科,重庆400010)
根据T细胞表面抗原受体αβTCR和γδTCR的不同,将外周血T细胞分为αβT细胞和γδT细胞。γδT细胞大量分布于黏膜淋巴组织,不表达CD4+及CD8+分子,是 CD4+、CD8+双阴性细胞,因此其抗原的处理和提呈不受MHC限制,作用介于固有免疫和适应性免疫之间[1],具有独特的结构和功能,在肿瘤免疫中发挥着重要作用。γδT细胞主要通过表面受体NKG2D识别表达于肺癌等肿瘤细胞上的MHC-Ⅰ相关分子A(MICA),通过NKG2D-MICA途径,产生肿瘤免疫[2]。组蛋白脱乙酰酶抑制剂可通过增加细胞内组蛋白的乙酰化程度,调节多种基因的表达水平,并上调相关蛋白的表达,并且观察到组蛋白脱乙酰酶抑制剂丙戊酸钠可上调肝癌等肿瘤中MICA蛋白的表达[3,4]。为调控MICA的表达,增强γδT细胞对肺癌细胞的杀伤作用,本文使用组蛋白脱乙酰酶抑制剂丙戊酸钠(Histone deacetylase inhibitor valproate sodium,HDACI-VPA)为调控剂,研究其对肺癌A549细胞MICA表达的影响,探讨其在人外周血 γδT细胞对肺癌 A549细胞免疫中的作用。
1 材料与方法
1.1 材料 肺癌A549细胞株购自美国ATCC公司,RPMI1640干粉及胎牛血清购自美国Gibco公司,唑来磷酸(ZA)及丙戊酸钠(VPA)购自于美国Sigma公司,Trizon RNA提取试剂、Taq DNA聚合酶、dNTP、markerDL1000等 PCR试剂购自 TaKaRa公司,PCR引物由大连宝生物公司合成,Western blot配胶试剂盒购自碧云天生物技术研究所,IP蛋白裂解液购自南京凯基生物科技发展有限公司,IL-2购自Peprotech公司,淋巴细胞分离液购自中国生科院,LDH毒性检测试剂盒购自于美国abcam公司(Cat:ab65393),Anti-human gamma delta TCR-FITC(Cat:11-9955)、Mouse IgG1 K Isotype Control FITC(Cat:11-4714)购自美国eBioscience公司,抗-MICA抗体购自美国EPITOMICS公司(Cat:T3305),流式细胞仪(FCM)购自美国Beckman Coulter公司。
1.2 方法
1.2.1 外周血单个核细胞(PBMC)的制备取健康成人外周血40 ml,肝素抗凝。加入等体积的 DHanks液混匀。取2只50 ml离心管,每只加入20 ml淋巴细胞分离液,将与D-Hanks液混匀的外周血沿离心管管壁缓慢加入,在加入过程中保持分界面清晰,2 000 r/min离心20分钟,小心吸取 DHanks液与血清之间的白色层于10 ml离心管中,离心洗涤3次,每次10分钟,即得外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)。
1.2.2 γδT细胞的分离纯化及刺激扩增 将离心所得的PBMC细胞加入50 ml培养瓶中,再加入含10%胎牛血清的RPMI1640培养基3 ml,在5%CO2、37℃恒温培养箱中培养3天,然后离心,转入EP管中,加入 Anti-human gamma-delta TCR-FITC抗体标记γδT细胞、以 Mouse IgG1 K Isotype Control FITC为同型空白对照,37℃培养箱孵育30分钟后离心,加入适量PBS,经流式细胞仪分离纯化γδT细胞,并检测γδT细胞的纯度。将分离纯化的γδT细胞加入50 ml培养瓶中,加入3 ml含10%血清、100 U/ml双抗的RPMI1640培养基中,再加入唑来磷酸(终浓度为300 pg/ml)、IL-2(终浓度为200 U/ml),置于5%CO2、37℃恒温培养箱中培养,每3天换一次液,培养9~12天,调整细胞浓度为 106ml-1备用。
1.2.3 肺癌A549细胞的培养 将复苏的肺癌A549细胞株培养于50 ml的玻璃培养瓶中,加入3 ml的含10%胎牛血清、100 U/ml双抗的RPMI1640培养基,置于5%CO2、37℃恒温培养箱中,每隔1天换一次液,细胞长到85%左右传代培养,培养细胞状态到对数期,备用。
1.2.4 不同浓度的VPA处理A549细胞将对数生长期的A549细胞用RPMI1640调整细胞浓度到105ml-1,六孔板每孔取含有细胞的溶液1ml以及1ml的RPMI1640,并在六孔板中分别加入 VPA 0.5、1.0、2.0、4.0 mmol,使 VPA 终浓度分别为 0.25、0.5、1.0、2.0 mmol/L。在 5%CO2、37℃恒温培养箱中培养24小时。
1.2.5 PCR技术检测肺癌A549细胞MICA的转录将1.2.4步骤处理的肺癌A549细胞用Trizol法提取总 RNA,紫外分光光度仪测得 OD260 nm/OD280nm值为1.92。再参照TaKaRa逆转录试剂盒步骤制取cDNA,并按照下列条件扩增:5×Prime-STAR®Buffer(Mg2+plus)10 μl、dNTP Mixture(各2.5 mmol/L)4 μl、Primer 1(10 μmol/L)1 μl、Primer 2(10 μmol/L)1 μl、模板 DNA 2 μl、DEPC 水调整总量至50 μl。然后设置94℃预变性3分钟、94℃变性30秒、58℃退火(内参59℃退火)30秒、72℃延伸30秒(内参延伸50秒)、35个循环(内参28个循环)后再72℃延伸5分钟,即得PCR扩增产物,再用3%的琼脂糖、以Golden view为显色剂、TAE为电泳液,100 V恒压水平电泳,再用凝胶成像仪扫描成像。PCR引物序列见表1。
1.2.6 Western检测MICA蛋白的变化 将1.2.4处理的肺癌A549细胞提取总蛋白后,用BSA法检测蛋白浓度,加入上样 buffer,调整蛋白浓度至4 μg/μl,并在沸水中加热5分钟。配制10%的分离胶及浓缩胶,每孔加入60 μg蛋白样品,电泳、切胶、并用PVDF膜转膜,用PBST配制的5%脱脂奶粉封闭1小时,再用5%脱脂奶粉按照1∶1 000稀释一抗(β-actin 内参1∶3 000),4℃过夜封闭,用 PBST 于摇床上洗涤3次,每次10分钟,用5%脱脂奶粉按照1∶5 000稀释加辣根过氧化物酶标记的山羊抗兔二抗,37℃孵育1小时,用PBST于摇床上洗涤3次,每次10分钟;再用ECL作为发光试剂显影成像并拍照。

表1 PCR引物Tab.1 The prime of PCR
1.2.7 不同处理时γδT细胞杀伤肺癌A549细胞的细胞毒性检测 在96孔板中,加入肺癌细胞1 000个,在5%CO2、37℃恒温培养箱中培养2小时,在肺癌细胞贴壁后,按照下列方式处理:①不加任何试剂的空白对照;②按照效靶比20∶1的比例加入γδT细胞20 000个;③按照效靶比20∶1的比例加入γδT细胞20 000个,并加入终浓度为1 mmol/L的VPA;④按照效靶比20∶1的比例加入γδT细胞20 000个以及1 μg/ml的 MICA-抗体;⑤按照效靶比20∶1的比例加入γδT细胞20 000个,并加入终浓度为1 mmol/L的 VPA 以及1 μg/ml的 MICA-抗体;⑥加入终浓度为1 mmol/L VPA。每组设置5个复孔并用IgG代替MICA-抗体作为空白对照(重复5次),并调整每个孔的培养基为 100 μl,在 5%CO2、37℃恒温培养箱中培养24小时,并参照LDH法说明书检测细胞凋亡抑制率,凋亡抑制率=(靶细胞实验处理组OD值-靶细胞空白对照组OD值)/(靶细胞最大释放组OD值-靶细胞空白对照组OD值)。
1.3 统计学处理 采用SPSS18.0软件进行t检验及方差分析,结果以x±s表示,样本均数的两两比较采用t检验,结果均以P<0.05为差异,表示有统计学意义。
2 结果
2.1 γδT细胞纯度的测定 从外周血PBMC中用流式分离出的γδT细胞,经ZA及IL-2刺激扩增培养后,其纯度可达89.52%(图1C),该纯度可以满足γδT细胞的功能研究。图1A为同型阴性对照,为γδT细胞在外周血中占的比例为5.73%(图1B)。
2.3 加入VPA后各组内肺癌A549细胞MICA基因转录 加入VPA后,各组内的MICA的基因转录均较未加入VPA的空白对照组增强,且随着加入VPA浓度的增加,MICA的基因转录增强,在加入VPA为 1 mmol/L时,MICA基因的转录较明显(图2)。
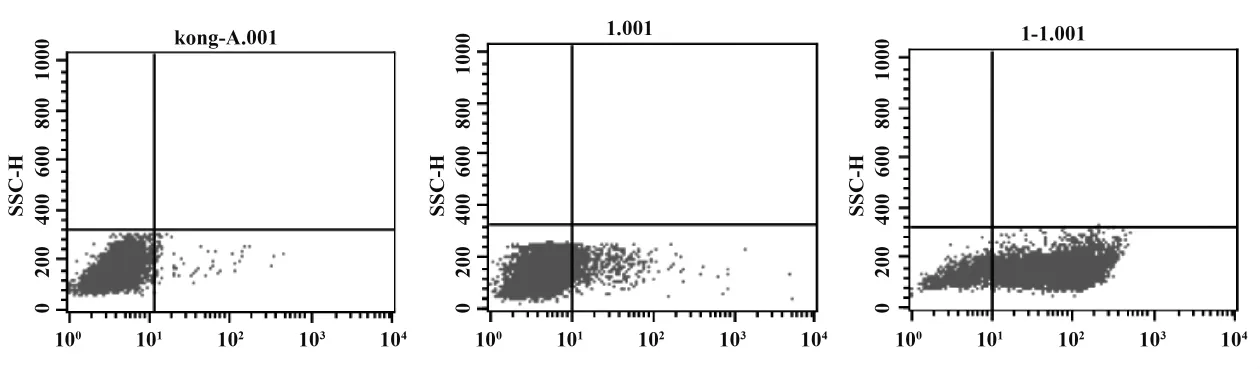
图1 流式细胞仪检测γδT细胞的纯度Fig.1 The purity of γδT cells with Flow cytometry

图2 PCR检测在VPA不同浓度下肺癌A549细胞MICA的表达Fig.2 The PCR of MICA in lung cancer A549 cell with different concentration of VPA

图3 Western blot检测在VPA不同浓度下肺癌A549细胞MICA蛋白的表达Fig.3 Expression of MICA protein was detected by western blot with different concentration of VPA
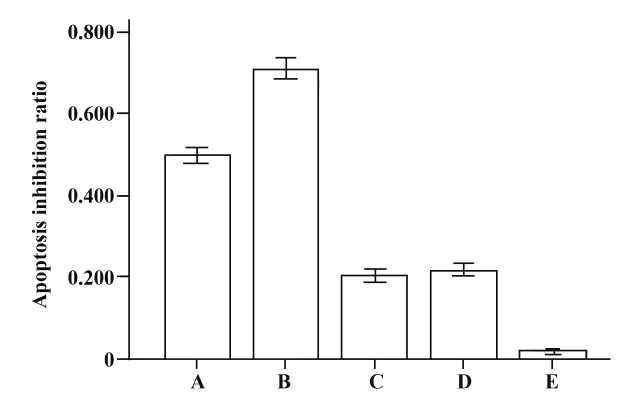
图4 不同处理时γδT细胞杀伤肺癌A549细胞的细胞毒性结果Fig.4 The results of the cytotoxicity effects of γδT cells on lung cancer A549 lines cells in different treatment group
2.4 加入VPA后各组内肺癌A549细胞MICA蛋白加入VPA后,肺癌细胞上蛋白MICA的表达量较未加入的对照组的明显增强,且在加入浓度为1 mmol/L的VPA时,MICA蛋白的表达增加明显(图3)。
2.5 不同处理组的细胞毒性检测 不同处理组γδT细胞对肺癌A549细胞凋亡抑制率的LDH检测结果如图4所示:γδT细胞组凋亡抑制率为0.49±0.04,表明γδT细胞对肺癌A549细胞有较强的杀伤作用;加入VPA组与未加入VPA组的凋亡抑制率分别为0.70 ±0.03、0.49 ±0.04,差异有统计学意义(P<0.05);加入MICA-抗体封闭组与未加入MICA抗体组相比,细胞毒性较明显减弱,两组凋亡抑制率差异有统计学意义(P<0.05);加入VPA、MICA抗体组与只加入MICA抗体组相比,细胞毒性无明显改变(P >0.05)。
3 讨论
肿瘤的发生发展与体内的细胞免疫有着密切联系,对于肿瘤的治疗,除放疗、化疗、手术外,肿瘤的细胞免疫发挥着越来越重要的作用,常规的肿瘤细胞免疫主要依赖于MHC限制的αβT细胞,以及通过激活适应性免疫系统启动细胞免疫,而肿瘤可通过某种机制下调人类白细胞抗原、降低机体的反应,逃避免疫监视[5]。然而近期一些研究发现 γδT细胞能对多种肿瘤细胞起到杀伤作用[6,7],且杀伤过程是不受MHC限制的,γδT细胞介于适应性免疫与固有免疫之间,可识别和杀伤那些逃避了αβT细胞攻击的肿瘤细胞,为肿瘤的免疫治疗开辟了一条新的途径。
在体内,γδT细胞表达各种趋化性因子受体如CXCR3、CXCR4、CCR5、CCR1[8,9],炎症性趋化因子干扰素诱导蛋白10(IFN inducible protein 10,IP-10)、基质细胞衍生因子1(stromal cell-derived factor,SDF-1 等对 γδT 细胞产生趋化作用[10],γδT 细胞到达肿瘤部位后,产生有效的抗肿瘤免疫应答。γδT细胞主要通过表面受体NKG2D识别表达于肺癌等肿瘤细胞上的MICA蛋白,通过NKG2D-MICA途径对肿瘤细胞产生细胞毒性作用,MICA蛋白表达于多种肿瘤细胞的胞膜和胞浆中,且主要表达于包膜上,可与NKG2D特异结合,在γδT细胞的肿瘤免疫及细胞毒性作用中起着重要的作用。然而有研究发现肿瘤细胞通过脱落细胞膜上的MICA配体形成分泌型sMICA,导致细胞表面MICA的数量下降,降低了NKG2D与MICA的接触,从而减弱γδT细胞对肿瘤细胞的细胞毒性,逃避MICA介导的细胞免疫[6]。研究发现肿瘤中组蛋白脱乙酰酶异常表达,使得组蛋白大部分处于低乙酰化状态,进而细胞的相关蛋白表达下降,对肿瘤细胞的生物学效应产生影响[3];然而组蛋白脱乙酰酶抑制剂可通过增加细胞内组蛋白的乙酰化程度,调节多种基因的表达水平,进而上调相关蛋白的表达[4,11],使得相关的生物学效应增强。基于γδT细胞对肿瘤细胞的生物学作用和组蛋白脱乙酰酶抑制剂的调节作用,本研究探讨了γδT细胞对肺癌A549细胞的毒性作用及组蛋白脱乙酰酶抑制剂-丙戊酸钠在γδT细胞对肺癌A549细胞的毒性作用的正向调节能力。
实验结果表明加入组蛋白脱乙酰酶抑制剂VPA后,PCR及Western blot显示A549细胞MICA在基因转录水平及蛋白的表达水平上有着明显的提高,从量-效分析,在 VPA的浓度为1 mmol/L时,MICA基因的转录及蛋白的表达增加明显。
细胞毒性LDH结果显示γδT细胞对肺癌A549细胞有较强的细胞毒作用,而加入组蛋白去乙酰酶抑制剂VPA后,γδT细胞对肺癌A549细胞的细胞毒性作用明显地增加。在γδT细胞与肺癌A549细胞作用的过程中,加入MICA抗体,特异性阻断γδT细胞介导的MICA途径,LDH结果显示γδT细胞对肺癌A549细胞的细胞毒性作用明显减弱,表明MICA的表达可使得肺癌A549细胞对γδT细胞介导的细胞杀伤作用更敏感;而分别加入VPA、MICA抗体和MICA抗体后,LDH结果显示γδT细胞对肺癌A549细胞的细胞毒性无明显差别,这也提示VPA是通过改变MICA蛋白的变化起作用的。上述结果表明VPA能增强γδT细胞介导的对肺癌A549细胞的毒性作用,且VPA是通过改变肺癌A549细胞MICA蛋白的表达来改变γδT细胞对肺癌A549细胞的毒性作用的。
在γδT细胞介导的肿瘤免疫研究中,Kang等[5]通过扩增γδT细胞,对小鼠肺鳞癌的过继免疫治疗,观察到小鼠的成活期延长;另一学者Nakajima等[12]通过对12例晚期肺癌患者回输入经体外扩增培养的自体γδT细胞,发现对肺癌患者的治疗起到了作用;而Bennouna等[13]在肾癌的临床研究中观察到,经体外刺激扩增的γδT细胞在大量输入肾癌患者体内后,尽管延长了患者的生存时间,对肾癌的治疗起到了一定的作用,但是部分患者却出现胃肠功能紊乱以及流感样症状,如寒战、发热、疲劳等,γδT细胞的数量也只能少量多次的输入。
如何提高γδT细胞对肿瘤细胞的杀伤作用,从NKG2D-MICA途径的调控着手是可能的途径之一,通过提高肿瘤细胞MICA蛋白的表达,进而增强γδT细胞对肺癌A549细胞等肿瘤细胞的的毒性作用,本研究也证实了其可行性,这也为肺癌等肿瘤的免疫治疗找到新的途径及突破点。但这仅是肺癌A549细胞的体外实验研究,目前有关γδT细胞的临床应用仍面临一些困难,首先γδT细胞在体内外周血单核细胞中占的比例较少,体外培养、扩增出大量较纯的γδT细胞是一个关键;其次由于个体的抗原差异,从其他健康自愿者获得的γδT细胞,经体外刺激扩增后输入患者体内,其安全性也有待进一步证实;再者在体内是否能通过NKG2D-MICA途径调控γδT细胞对肺癌细胞的杀伤能力,仍需实验证明,且γδT细胞经MICA途径作用于肺癌后,如何抑制肺癌A549细胞生长及导致肺癌A549细胞死亡的具体机制还有待更进一步研究;组蛋白去乙酰酶抑制剂VPA联合γδT细胞应用于肺癌的临床治疗,其疗效和安全性还有待深入探讨。
1 Holtmeier W,Kabelitz D.Gammadelta T cells link innate and adaptive immune responses[J].Inmmunol Allergy,2005;86:151-183.
2 Caccamo N,Dieli F,Meraviglia S et al.Gamma delta T cell modulation in anticancer treatment[J].Curr Cancer Drug Targets,2010;10(1):27-36.
3 Sorin Armeanu,Michael Bitzer.Natural killer cell-mediated lysis of hepatoma cells via specific Induction of NKG2D ligands by the histone deacetylase inhibitor sodium valproate[J].Cancer Res,2005;65:6321-6329.
4 Johnstone R W.Histone-deacetylase inhibitors:novel drugs for the treatment of cancer[J].Nat Rev Drug Discov,2002;1(4):287-299.
5 Marincola F M,Jaffee E M,Hicklin D J et al.Escape of human solid tumors from T-cell recognition:molecular mechanisms and functional significance[J].Immunol,2000;74:181-273.
6 Wu J D,Higgins L M,Steinle A et al.Prevalent expression of the immunostimulatory MHC class I chain-related molecule is counteracted by shedding in prostate cancer[J].J Clin Invest,2004;114(4):560-568.
7 Kang N,Zhou J,Zhang T et al.Adoptive immunotherapy of lung cancer with immobilized anti-TCR gamma delta antibody-expanded human gamma delta T-cells in peripheral blood[J].Cancer Biol T-her,2009;8(16):1540-1549.
8 Schnurr M,Scholz C,Rothenfusser S et al.Apoptotic pancreatic tumor cells are superior to cell lysates in promoting cross-priming of cytotoxic T cells and activate NK and gammadelta T cells[J].Cancer Res,2002;62(8):2347-2352.
9 Glatzel A,Wesch D,Schiemann F et al.Patterns of chemokine receptor expression on peripheral blood gamma delta T lymphocytes:strong expression of CCR5 is a selective feature of V delta 2/V gamma 9 gamma delta T cells[J].J Immunol,2002;168(10):4920-4929.
10 Poggi A,Carosio R,Fenoglio D et al.Migration of V delta 1 and V delta 2 T cells in response to CXCR3 and CXCR4 ligands in healthy donors and HIV-1-infected patients:competition by HIV-1 Tat[J].Blood,2004;103(6):2205-2213.
11 Glaser K B,Staver M J,Waring J F et al.Gene expression profiling of multiple histone deacetylase(HDAC)inhibitors:defining a common gene set produced by HDAC inhibition in T24 and MDA carcinoma cell lines[J].Mol Cancer Ther,2003;2(2):151-163.
12 Nakajima J,Murakawa T,Fukami T et al.A phase I study of adoptive immunotherapy for recurrent non-small-cell lung cancer patients with autologous γδT cells [J].Eur J Cardiothorac Surg,2010;37:1191-1197.
13 Bennouna J,Bompas E,Neidhardt E M et al.Phase-I study of Innacell gammadelta,an autologous cell-therapy product highly enriched in gamma9delta2 T lymphocytes,in combination with IL-2,in patients with metastatic renal cell carcinoma[J].Cancer Immunol Immunother,2008;57(11):1599-1609.