用酶解法制备壳寡糖及其对机体免疫功能的调节作用①
张 沛 韩宝芹 陈列欢 彭燕飞 刘万顺 郑汉东 杨 艳
(中国海洋大学海洋生命学院,青岛266003)
壳寡糖(COS)是壳聚糖的降解产物,由2~10个氨基葡萄糖通过β-1,4-糖苷键连接而成。壳寡糖作为自然界中唯一大量存在的碱性氨基寡糖,由于具有分子量低、水溶性好、易吸收等特性,在提高免疫力、抗肿瘤、抗菌、促进伤口愈合等方面具有较好的生物学功能[1,2]。近年来,随着研究的深入,壳寡糖在免疫方面的研究越来越多,壳寡糖对免疫系统存在着多元、多效性的调节功能[3]。研究表明壳寡糖能够促进巨噬细胞的增殖和相关细胞因子的分泌,进而反馈激活巨噬细胞和其它免疫细胞,形成网络状的免疫调节体系,极大地增强机体的免疫功能,抑制荷瘤小鼠肿瘤的生长和转移[4,5]。壳寡糖对巨噬细胞的激活作用在壳寡糖的免疫调节、抑制肿瘤功能中发挥重要作用[6]。壳寡糖能够促进巨噬细胞释放一氧化氮,分泌多种细胞因子[7,8],如壳寡糖能够促进巨噬细胞中IL-18的基因转录和蛋白表达,刺激巨噬细胞分泌 TNF-α 和 IL-1β、IL-18和IL-6[5,9-11]。
壳寡糖对巨噬细胞的激活作用是通过巨噬细胞表面的受体介导的。但是对于壳寡糖与巨噬细胞相互作用的分子基础仍存在不同的结论。Han等[12]通过激光共聚焦显微镜发现甘露糖受体能够介导壳寡糖的内吞,认为壳寡糖诱导巨噬细胞释放TNF-α和Ca2+内流的功能主要是通过甘露糖受体介导的。Feng等[10]发现甘露糖能够抑制壳寡糖的内吞,而LPS和β-葡聚糖则不能抑制壳寡糖的内吞。Wu等[13]发现用TLR4、CD14和CR3的抗体处理巨噬细胞RAW264.7,能够阻断壳寡糖联合干扰素诱导的一氧化氮的产生,表明壳寡糖能够通过结合巨噬细胞表面的TLR4、CD14和CR3受体诱导NF-кB的激活和一氧化氮的产生。有关哪个受体在介导壳寡糖的内吞中发挥关键受体的作用,壳寡糖进入巨噬细胞进而激活巨噬细胞的分子量范围是多少,目前还没有明确的观点,需要进一步深入研究。
本研究利用本实验室分离的高活性壳聚糖酶,通过酶水解法制备主要成分为3-7单糖聚合度的壳寡糖,将壳寡糖进行荧光标记,用荧光显微镜技术观察巨噬细胞对壳寡糖的内吞作用,进而从体外和体内两方面评价COS的免疫调节功能。
1 材料与方法
1.1 试剂与仪器 脂多糖(LPS)(Sigma),淀粉(国药集团化学试剂有限公司),D-Hank's液体(GEN-ray),FITC干粉(青岛华晟新泽生物科技有限公司),MTT干粉(青岛华晟新泽生物科技有限公司),中性红(上海试剂三厂),二甲基亚砜(DMSO)(南京化学试剂有限公司),小牛血清(HyClone),DMEM液体培养基(Solarbio Beijing Solarbio Science&Technology Co.Ltd),肿瘤坏死因子α酶联免疫检测试剂盒(北京爱迪博生物科技有限公司),IgG、IgM酶联免疫检测试剂盒(上海恒远生物有限公司),TLR4单克隆抗体(Cell Signaling),高活性壳聚糖酶(本实验室分离纯化)。
SPF清洁级昆明种小白鼠购自青岛市药检所。小鼠雌雄各半,实验之前在本动物房喂养适应一周,给予充足的食物和水。
标准规格的酶标仪(RT-2100C,Rayto),5%CO2、37℃培养箱(HF240,HEAL FORCE),超净工作台(HEAL FORCE),倒置荧光显微镜(Nikon TS100),细胞培养瓶(Costar公司),96孔培养板(Costar公司),6孔培养板(Costar公司)等。
1.2 壳寡糖的酶解制备 配置100 ml壳聚糖溶液(浓度1%,调节pH为5.5),于45℃恒温水浴锅中保温10分钟,然后加入1 ml壳聚糖酶 A溶液(10%),立即振摇开始反应,每隔10分钟各取反应液0.5 ml加入2%NaOH溶液0.2 ml,混匀观察残存壳聚糖沉淀产生的状况。当没有沉淀产生时加入2%NaOH溶液10 ml终止反应。
1.3 壳寡糖成份的鉴定 采用高效液相色谱(HPLC)法分析壳聚糖酶水解产物的组成。高效液相色谱条件如下:使用Waters高效液相色谱仪,检测器为301型蒸发光散色检测器。样品溶液浓度设置为1%,流动相为乙腈/水溶液(75∶25),柱温保持在 30℃。进样量为 20 μl,流速 1.0 ml/min。
1.4 壳寡糖的荧光标记 壳寡糖的荧光标记参照贺继东的方法进行[14],并加以改进,具体方法如下:配制25 ml FITC-无水甲醇溶液(1 mg/ml),10 ml壳寡糖-水溶液(15%,m/V),调节壳寡糖溶液的pH值为9,加入FITC-甲醇溶液,混匀后室温、避光反应3小时(壳寡糖与荧光素的质量比为60∶1)。反应结束后,使用乙醇沉淀法获得产品FITC-COS,避光保存。
1.5 FITC-COS与巨噬细胞的相互作用研究 腹腔注射1%淀粉刺激小鼠3天后,脱颈处死,无菌条件下提取小鼠腹腔巨噬细胞,调整细胞密度为5×104个/ml,将细胞悬液接种至48孔板中,置5%CO2、37℃细胞培养箱中培养4小时,待细胞贴壁后吸出上清液,用D-Hank's液洗去未贴壁细胞,在每个孔中加入2 ml培养基。培养48小时后,弃掉每个孔中的培养基,加入1 ml FITC-COS溶液(1 mg/ml),孵育不同的时间(1、5、15分钟)后,弃去FICT-COS溶液,每孔用PBS冲洗2遍,然后在倒置荧光显微镜下观察,拍照记录。
为了研究COS与TLR4受体的相互作用,按照上述实验方法制备腹腔巨噬细胞,细胞在加入FITC-COS之前,在孔中加入TLR4单克隆抗体(稀释比例为1∶10),37℃培养箱中继续孵育1小时,然后弃去抗体,加入1 ml FITC-COS溶液(1 mg/ml),孵育15分钟后,弃去FICT-COS溶液,用PBS冲洗2遍后在倒置荧光显微镜下观察,拍照记录。
1.6 壳寡糖对小鼠腹腔巨噬细胞(PMφ)功能的影响
1.6.1 MTT法测COS对小鼠PMφ增殖的影响小鼠腹腔注射1%淀粉刺激3天后,脱颈处死,无菌条件下提取小鼠腹腔巨噬细胞,调整细胞密度为5×104个/ml,接种于 96 孔板中,每孔 200 μl,置 5%CO2,37℃细胞培养箱中培养4小时,待细胞贴壁后吸出上清液,用D-Hank's液洗去未贴壁细胞。实验设6组:对照组、LPS组(10 ng/ml)、不同浓度的COS 组(10、20、50、100 μg/ml),每组设8 个平行孔。加药后细胞继续培养,在不同的时间段(24小时、48小时、72小时)进行MTT测定。
1.6.2 小鼠PMφ吞噬中性红能力的测定 小鼠PMφ的制备同1.6.1。实验分6组:对照组,LPS组(10 ng/ml),不同浓度的 COS 组(10、20、50、100 μg/ml),每组设8个平行孔。加药后细胞继续培养24小时后,吸出培养液,每孔加入中性红200 μl(0.7 mg/ml),继续培养1小时,弃去培养液,用预温生理盐水液洗涤3遍,用滤纸轻轻吸干液体。每孔加裂解液(0.1 mol/L的冰乙酸与无水乙醇按1∶1体积比混匀)200 μl,4℃过夜。以 D-Hank's液做空白,在492 nm测定光吸收值。
1.6.3 小鼠PMφ分泌TNF-α因子能力的测定 小鼠PMφ的制备同1.6.1。实验分6组:对照组、LPS组(10 ng/ml)、不同浓度的 COS 组(10、20、50、100 μg/ml),每组设8个平行孔。加药后细胞继续培养24小时后,收集每孔上清培养液,-20℃冻存,待用ELISA试剂盒测定上清中TNF-α含量。实验操作按照试剂盒上步骤进行。
1.7 壳寡糖对小鼠体内免疫功能的影响 将实验小鼠分为对照组、壳寡糖低剂量组(100 mg/kg体重)、中剂量组(250 mg/kg体重)和高剂量组(500 mg/kg体重),每组小鼠雌雄各半。实验组小鼠每天灌胃相应剂量的壳寡糖,对照组小鼠灌胃相应体积的生理盐水,分别在相应的时间点(10、20天),每组取8只小鼠,摘取小鼠眼球取血,离心(3 000 r/min,15分钟)分离血清,-20℃冻存,待测血清中IgG、IgM的含量。小鼠脱颈处死,进行解剖,分离胸腺和脾脏组织,用滤纸吸干残血后,并进行称重(mg),计算小鼠胸腺和脾脏指数。胸腺和脾脏指数定义为每10克小鼠体重含有的胸腺或脾脏重量(mg/10 g)。
1.8 统计学分析 实验计量数据表示为x ± s,数据处理及分析用SPSS软件进行,用t检验进行数据间差异显著性分析,P<0.05为差异显著性水平。
2 结果
2.1 壳寡糖聚合度分析壳聚糖酶水解产物HPLC分析结果见图1,从该图中可以看出,该酶解产物主要含有聚合度3~7单糖为主的寡糖成分,只含有少量的壳8糖等成分。

图1 壳聚糖酶水解产物HPLC分析结果Fig.1 HPLC result of enzyme hydrolysis product of chitosan

图2 巨噬细胞对壳寡糖的内吞作用Fig.2 Phagocytosis of chito-oligosaccharides by macrophage
2.2 壳寡糖与巨噬细胞的相互作用 壳寡糖与巨噬细胞相互作用的研究结果见图2,从图中可以看出荧光标记的壳寡糖可以被巨噬细胞所吞噬而进入细胞内,且随着时间的延长,巨噬细胞吞噬壳寡糖的数量不断增加,FITC-COS与巨噬细胞作用15分钟后,大量的壳寡糖进入到巨噬细胞中。加入TLR4单克隆抗体对巨噬细胞预处理1小时后,再加入FITC-COS相互作用15分钟,巨噬细胞对壳寡糖的吞噬被抑制,视野下找不到吞噬寡糖的巨噬细胞。

图3 壳寡糖对小鼠PMφ体外增殖的影响Fig.3 Effects of COS on the proliferation ability of mice PMφ

图4 不同浓度壳寡糖对小鼠巨噬细胞吞噬中性红能力的影响(24小时)Fig.4 Effect of COS on the neutral red phagocytosis ability of mice PMφ at different concentrations(24 h)
2.3 COS对小鼠PMφ增殖的影响 COS对小鼠原代培养的腹腔巨噬细胞增殖功能的影响见图3。从图中看出不同浓度的壳寡糖刺激小鼠腹腔巨噬细胞不同时间后,对其增殖均没有显著影响,即壳寡糖不能促进小鼠原代培养PMφ的体外增殖能力。
2.4 COS对小鼠PMφ吞噬中性红能力的影响 壳寡糖对小鼠腹腔巨噬细胞吞噬中性红能力的影响见图4。由图中可以看出,LPS能够显著增强巨噬细胞的吞噬能力,与对照组相比差异显著。壳寡糖在不同浓度下(10~100 μg/ml)均能提高细胞吞噬中性红的能力,其中浓度为20 μg/ml时作用效果最佳。
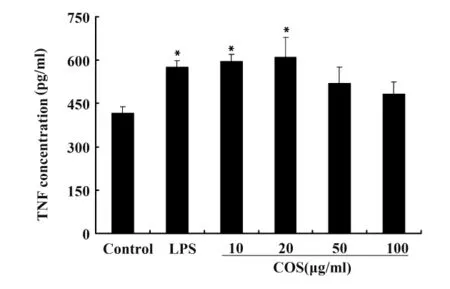
图5 不同浓度壳寡糖对小鼠PMφ分泌TNF-α能力的影响(24小时)Fig.5 Effect of COS on TNF-α secretion ability of mice PMφ at different concentrations(24 h)
2.5 COS对小鼠PMφ分泌TNF-α能力的影响壳寡糖对小鼠腹腔巨噬细胞分泌细胞因子TNF-α能力的影响见图5。由图中可以看出,LPS能诱导巨噬细胞合成并分泌TNF-α,与对照组相比差异显著。壳寡糖在实验浓度范围内能够刺激小鼠PMφ分泌TNF-α因子,在20 μg/ml时作用效果最佳。当壳寡糖浓度升高到50 μg/ml或者更高时,壳寡糖对小鼠PMφ分泌TNF-α因子的作用反而下降。
2.6 壳寡糖对小鼠血清IgG、IgM含量的影响 小鼠灌胃COS 10天和20天后,对小鼠血清中IgG、IgM含量影响的结果见图6。测定结果表明壳寡糖在提高小鼠免疫球蛋白合成方面有较明显的效果,通过增加体内免疫球蛋白的含量,有助于增强机体免疫力。
对比两个时间段的实验结果,可以看出随着时间的延长,高剂量组小鼠体内的免疫球蛋白G(IgG)的含量有明显的提高,与对照组相比差异显著,显示出500 μg/kg体重的壳寡糖能够有效增强小鼠的免疫功能。小鼠灌胃壳寡糖对血清中免疫球蛋白M(IgM)含量没有显著影响。
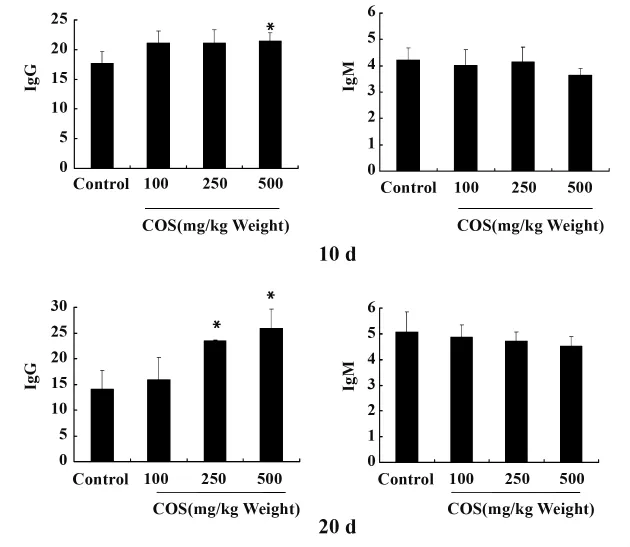
图6 不同剂量壳寡糖对小鼠血清中IgG和IgM含量的影响(10、20天)Fig.6 Effect of different doses of COS on mice serum IgG and IgM content(10,20 d)
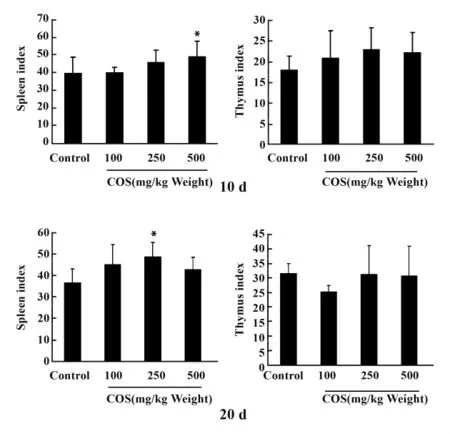
图7 不同剂量壳寡糖对小鼠脾脏指数和胸腺指数的影响(10、20 天)Fig.7 Effect of different doses of COS onmice thymus and spleen index(10,20 d)
2.7 壳寡糖对小鼠脾脏、胸腺指数的影响 小鼠灌胃COS 10天和20天后,对小鼠脾脏、胸腺指数影响的结果见图7。测定结果表明小鼠灌胃壳寡糖能够显著增加小鼠脾脏指数,与对照组相比差异显著。但是,小鼠灌胃壳寡糖对胸腺指数的影响并不显著。
3 讨论
近年来,随着研究的深入,壳寡糖因其特有的分子量小、水溶性好、易吸收等性质,表现出更好的生理学功能。壳寡糖在调节机体免疫功能方面的研究越来越多。但是对于壳聚糖的有效降解,对于壳寡糖与巨噬细胞相互作用的分子基础,以及壳寡糖激活巨噬细胞后诱导的细胞内信号转导途径,壳寡糖诱导巨噬细胞合成细胞因子的机制等问题还有待于进一步深入研究。
本研究利用本课题组分离得到的高活性壳聚糖酶,通过酶水解的方法制备壳寡糖。该壳聚糖酶活性高,且水解产物以3~7单糖聚合度的寡糖为主要成分,壳聚糖酶水解速度快,降解产物至3~7单糖聚合度时,酶对底物不再降解。而传统的酸、碱降解法制备壳寡糖,降解过程难以控制,产物主要是单糖,难以制备高活性的寡糖成分。该壳聚糖酶降解法是一种快速,可控,环境无污染的理想制备方法。
壳寡糖对巨噬细胞的激活作用是通过巨噬细胞表面的受体介导的。但是对于壳寡糖与巨噬细胞相互作用的分子基础仍存在不同的结论。前期研究报道,甘露糖受体、TLR4、CD14和CR3等受体分子可以介导壳寡糖与巨噬细胞的结合[10,12,13]。但是有关哪个受体在介导壳寡糖的内吞中发挥关键受体的作用,目前还没有明确的观点。近年来,有很多研究发现多糖的免疫调节作用与Toll样受体有关。如:桔梗根多糖通过Toll样受体4(TLR4)激活巨噬细胞[15];刺五加多糖通过TLR4激活B细胞和巨噬细胞[16];红花多糖通过TLR4激活转录因子NF-кB诱导巨噬细胞合成细胞因子[17]。脂多糖(LPS)可以与巨噬细胞表面TLR4受体相互作用,诱导细胞内 MAPK-NF-кB 信号转导通路[18]。Wu[13]也曾报道过壳寡糖对巨噬细胞的激活作用与TLR4受体有关。本研究将壳寡糖用FITC进行荧光标记,在荧光显微镜下观察到腹腔巨噬细胞能够吞噬FITCCOS,但是细胞经TLR4单克隆抗体预处理后,细胞对壳寡糖的吞噬被完全抑制。结果表明TLR4在介导巨噬细胞吞噬壳寡糖进而被激活的过程中发挥关键受体的功能。
在上述研究的基础上,本文进一步研究了酶解制备的壳寡糖的体外、体内的免疫调节功能。结果显示:壳寡糖不能促进小鼠PMφ的体外增殖,但是COS能够显著提高小鼠PMφ吞噬中性红能力和分泌TNF-α 因子的能力,20 μg/ml为 COS刺激小鼠PMφ的最佳浓度。体内研究结果表明小鼠灌胃COS,能显著提高小鼠血清中IgG的含量和小鼠的脾脏指数,但是对血清IgM的含量和胸腺指数没有显著影响,这可能是与壳寡糖能够刺激小鼠的抗体生成能力有关。脾脏是机体体液免疫的主要器官,壳寡糖通过增强小鼠的脾脏指数,诱导体液免疫能力,而胸腺是机体细胞免疫的主要器官。壳寡糖对胸腺指数影响不显著。
总之,本研究表明壳寡糖(3-7聚合度)能够被巨噬细胞吞噬,进而激活巨噬细胞,具有较好的体外、体内免疫调节功能,壳寡糖对巨噬细胞的激活作用是通过细胞表面的TLR4受体介导的。本研究为进一步研究壳寡糖的生理学功能、作用机制和壳寡糖的开发应用奠定理论基础。
1 胡志鹏.壳寡糖的研究进展[J].中国生化药物杂志,2003;24(4):210-212.
2 陈 虹,侯伟革.壳寡糖及其应用[J].饲料博览,2007;21:23-24.
3 熊宇龙,匡欣薇,陈卫国 et al.壳寡糖的免疫调节效应及其机制研究进展[J].现代生物医学进展,2009;9(9):1787-1790.
4 韩艳萍,赵鲁杭,吴海明.壳寡糖激活巨噬细胞的机制[J].浙江大学学报(医学版),2006;35(3):729-737.
5 吴海明,华晓阳,何登全.壳寡糖抗肿瘤作用及免疫调节机理的研究[J].中华医学研究杂志,2005;5(8):729-783.
6 Lee C G,C A Da Silva,Jae-Young Lee et al.Chitin regulation of immune responses:an old molecule with new roles[J].Curr Opin Immunol,2008;20(6):684-689.
7 Zhijun Yu,Luhang Zhao,Haiping Ke.Potential role of nuclear factorkappaB in the induction of nitric oxide and tumor necrosis factor-alpha by oligochitosan in macrophages[J].Int Immunopharmacol,2004;4(2):193-200.
8 Won-Gil Seo,Hyun-Ock Pae,Na-Young Kim et al.Synergistic cooperation between water-soluble chitosan oligomers and interferon-gamma for induction of nitric oxide synthesis and tumoricidal activity in murine peritoneal macrophages[J].Cancer Lett,2000;159(2):189-195.
9 麻 攀,谭成玉,白雪芳et al.几丁质、壳聚糖及其降解产物对巨噬细胞的作用[J].细胞与分子免疫学杂志,2008;24(10):1027-1030.
10 Feng J,Luhang Zhao,Qiqi Yu.Receptor-mediated stimulatory effect of oligochitosan in macrophages[J].Biochem Biophys Res Commun,2004;317(2):414-420.
11 H J Yoon,M E Moon,H S Park et al.Chitosan oligosaccharide(COS)inhibits LPS-induced inflammatory effects in RAW 264.7 macrophage cells[J].Biochem Biophys Res Commun,2007;358(3):954-959.
12 Yanping Han,Luhang Zhao,Zhijun Yu et al.Role of mannose receptor in oligochitosan-mediated stimulation of macrophage function[J].Int Immunopharmacol,2005;5(10):1533-1542.
13 Guan James Wu,Guo Jane Tsai.Chitooligosaccharides in combination with interferon-gamma increase nitric oxide production via nuclear factor-kappaB activation in murine RAW264.7 macrophages[J].Food Chem Toxicol,2007;45(2):250-258.
14 贺继东,夏文水.异硫氰酸荧光素标记壳聚糖的研究[J].安徽农业科学,2007;35(34):10939-10940.
15 Yoon Y D,Sang Bae Han,Jong Soon Kang et al.Toll-like receptor 4-dependent activation of macrophages by polysaccharide isolated from the radix of Platycodon grandiflorum[J].Int Immunopharmacol,2003;3(13-14):1873-1882.
16 Han S B,Yoon Y D,Ahn H J et al.Toll-like receptor-mediated activation of B cells and macrophages by polysaccharide isolated from cell culture of Acanthopanax senticosus[J].Int Immunopharmacol,2003;3(9):1301-1312.
17 Ando I,Tsukumo Y,Wakabayashi T et al.Safflower polysaccharides activate the transcription factor NF kappa B via Toll-like receptor 4 and induce cytokine production by macrophages[J].Int Imminopharmacol,2002;2(8):1155-1162.
18 Zhe Xu,Chang-Xing Huang,Yu Li et al.Toll-like receptor 4 siRNA attenuates LPS-induced secretion of inflammatory cytokines and chemokines by macrophages[J].J Infect,2007;55(1):1-9.