糖原合成酶激酶3β和核因子κB在抗体介导的慢性排斥反应移植肾组织中的表达和意义
晏 强 姜 华 眭维国 罗 皓 王保瑶 梁桂荣 邹贵勉 陈怀周 邹和群
在不同肾脏疾病中,包括慢性移植肾失功(CRAD),慢性炎症反应是导致肾单位进行性丢失的共同病理过程[1]。在炎症性肾脏疾病中(包括CRAD),核因子κB(NF-κB)的活化是一个重要的细胞信号事件,它控制着一系列炎症介质的转录。目前,已经有大量研究表明糖原合成酶激酶 3β(GSK-3β)是 NF-κB 活化必不可少的要素[2,3]。尚无研究显示GSK-3β和NF-κB在抗体介导的排斥反应(ABMR)患者移植肾组织中的表达情况,因此,本研究主要通过免疫组化方法对ABMR导致CRAD的移植肾组织中GSK-3β、NF-κB的表达进行检测,并分析它们与肾间质纤维化/小管萎缩(IF/TA)分级的关系,探讨其在ABMR引起的CRAD发病机制中的作用,为移植肾慢性纤维化的发生和治疗提供一定理论依据。
资料和方法
临床资料 收集桂林解放军第181医院2002年01月至2013年04月住院的肾移植受者116例,其中尸体供肾98例,活体供肾8例,供受者肾移植术前均行乙型及丙型肝炎标志物检查为阴性,且术后复查亦均为阴性。术后出现肌酐爬行升高,反复蛋白尿定性检查呈阳性(﹢﹢~﹢﹢﹢﹢),定量检查均≥0.20 g/24h,予血管紧张素转换酶抑制剂类降压、活血护肾等处理,复查均未好转。行移植肾穿刺活检术,按照Banff 2009移植肾病理分级诊断标准[4],病理诊断为 ABMR,包括 65 例男性,平均48±11岁;51例女性,平均42±8岁,肾穿时间为肾移植术后0.3~13.6年,血清肌酐563±137 μmol/L。其中58例接受环孢素+吗替麦考酚酯+泼尼松三联免疫抑制治疗方案,58例接受他克莫司+吗替麦考酚酯+泼尼松三联方案治疗。所有供、受者血型相同,抗供者特异性抗体(DSA)检测阴性,群体反应性抗体(PRA)<10%,淋巴细胞毒交叉配型试验(CDC)<10%,HLA-A、HLA-B、HLA-Dr位点至少有二个位点相配。对照组为10例正常肾组织(年龄19~53岁)零点穿刺标本病理检查无异常。
病理分级诊断标准 依据Banff 2009移植肾病理分级诊断标准[4],将移植肾IF/TA的严重程度分为:Ⅰ级轻度间质纤维化和肾小管萎缩(<25%的皮质受累);Ⅱ级中度间质纤维化和肾小管萎缩(26%~50%的皮质受累);Ⅲ级重度间质纤维化和肾小管萎缩(>50%的皮质受累)。
ABMR 诊断标准[4]:C4d 阳性,循环中存在DSA,慢性组织损伤的形态学证据,如肾小球基膜双轨征和(或)肾小管周围毛细血管基膜多层和(或)IF/TA和(或)动脉纤维性内膜增厚。
肾小管间质炎症细胞浸润程度分度:轻度(少量散在炎症细胞浸润);中度(炎症细胞呈局灶性浸润);重度(大片、弥漫性炎症细胞浸润)。
免疫组化染色
GSK-3β免疫组化染色 采用EnVision法,石蜡切片3μm,常规烤片,脱蜡至水,3%过氧化氢清除内源性过氧化物酶,GSK-3β经微波修复15 min。滴加一抗(兔抗人GSK-3β多克隆抗体,1∶100稀释,武汉博士德公司产品,编号BA-0906),4℃过夜,PBS液冲洗,滴加二抗(福州迈新公司提供),37℃温箱孵育30 min,PBS液冲洗,DAB显色,苏木素复染,脱水,封片。
NF-κB p65免疫组化染色 采用EnVision法,石蜡切片3μm,常规烤片,脱蜡至水,3%过氧化氢清除内源性过氧化物酶,10 mmol/L柠檬酸钠(pH 6.0)缓冲液修复抗原,煮沸20 min。滴加一抗(鼠抗人 NF-κB p65 单克隆抗体,1∶100稀释,Santa Cruz公司产品,编号ZS-8008)。余步骤同前。
RANTES免疫组化染色 采用EnVision法,石蜡切片3μm,常规烤片,脱蜡至水,3%过氧化氢清除内源性过氧化氢酶,RANTES经微波修复15 min,滴加一抗(RANTES兔抗人单克隆抗体,1∶200稀释,武汉博士德公司产品,编号BA-1383)。余步骤同前。
单核趋化蛋白1(MCP-1)免疫组化染色 采用EnVision法,石蜡切片3μm,常规烤片,脱蜡至水,3%过氧化氢清除内源性过氧化物酶,MCP-1经微波修复15 min。滴加一抗(兔抗人MCP-1单克隆抗体,1∶100稀释,武汉博士德公司产品,编号 BA-1254)。余步骤同前。
C4d免疫组化染色 采用EnVision法,石蜡切片3μm,常规烤片,脱蜡至水,3%过氧化氢清除内源性过氧化氢酶,C4d经微波修复15 min。一抗为兔抗人C4d多克隆抗体(工作液,Santa Cruz公司,编号ZA-0415),余步骤同前。
对照组 对照组以PBS缓冲液替代一抗作为阴性对照。同时均行 Masson,PASM,IgA,IgG,IgM,C1q,C4c等免疫组化检测。
结果评价 组织中C4d阳性标准:肾小管周围50%毛细血管呈线性沉积。组织标本中RANTES、MCP-1及Ⅳ型胶原阳性标准:肾小管上皮细胞及间质细胞胞质内出现浅黄、棕黄、黄褐色颗粒。
免疫组化染色半定量分析 采用德国Leica(DMR+Q550型)真彩色病理图像分析系统对染色结果进行半定量分析,随机选取10个不连续(避开肾小球和大血管)的肾小管间质视野(×400),每例肾小管总数>60个。使用ImagePro-Plus 6.0软件计算平均光密度,取其均值表示该种成分在肾小管和间质的相对含量。
统计学分析 数据均数±标准差表示,应用SPSS13.0统计软件分析,计量资料采用 one way ANOVA,两两比较用LSD法(t检验);两变量相关性分析采用Spearman等级相关分析;不同治疗方案中的差异比较用独立样本t检验。P<0.05为统计学意义,P<0.01为统计学差异显著。
结 果
组织学观察 肾小球节段硬化,系膜区增宽,系膜细胞及基质中~重度增生,节段囊壁增厚、分层,基膜增厚,基膜呈连环样改变和假双轨征;肾间质中度纤维化伴炎症细胞浸润,灶性单核细胞聚集;肾小管萎缩。
不符合急性排斥反应、免疫抑制剂慢性肾毒性损伤、慢性肾小球肾炎等其他类型肾脏病病理改变。
C4d的表达 正常肾组织中C4d主要表达于的肾小球、肾小管基膜及系膜区,而在管周毛细血管(PTC)的内皮细胞中未发现C4d沉积;在ABMR移植肾组织标本中,C4d主要呈阳性表达于PTC的内皮细胞(≥50%)。
GSK-3β的表达 在正常肾组织中,GSK-3β无表达或表达较低或。在ABMR患者移植肾组织中,GSK-3β的表达显著增加,主要表达于肾小管细胞胞质中。随着GSK-3β平均光密度的增加,IF/TA分级、NF-κB p65、RANTES和 MCP-1平均光密度亦增大,且呈正相关(r分别为 0.884、0.812、0.804 和0.788,P <0.001),表明其表达水平亦随之增加。GSK-3β的表达同炎症细胞浸润及血清肌酐水平亦呈正相关(r分别为 0.905 和 0.847,P <0.001)(表1、2,图1、2)。
NF-κB p65的表达 正常肾组织中可在肾小球系膜细胞、肾小管上皮细胞偶见NF-κB p65表达。在ABMR患者移植肾组织中,NF-κB p65主要表达在包囊上皮细胞、系膜细胞和肾小管上皮细胞,表达水平较对照组明显增加,其表达水平同炎症性细胞因子RANTES、MCP-1及IF/TA分级呈正相关(r分别为 0.791、0.813 和0.914,P 均 <0.001)(表1,图3);NF-κB p65的表达同炎症细胞浸润及血清肌酐水平亦呈正相关(r分别为 0.868 和 0.831,P <0.001)(表2,图4)。
RANTES的表达 正常肾组织中的RANTES表达量低或无。在ABMR患者移植肾组织中RANTES大量表达于肾小管上皮细胞、肾小球系膜区及肾间质内的单核巨噬细胞,血管内皮细胞亦可见RANTES阳性细胞。肾小管损伤愈严重、间质炎症细胞浸润愈多的部位,表达愈强。并且RANTES的表达随着IF/TA的程度加重而增多,具有正相关性(r=0.888,P <0.001)(表1);RANTES 的表达同炎症细胞浸润亦具有正相关性(r=0.931,P<0.001)(表2)。
MCP-1在肾组织中的表达和血清肌酐水平 正常肾组织中MCP-1表达较少。而在ABMR患者移植肾组织中,MCP-1表达显著增加,主要位于肾小管上皮细胞胞质、肾小球系膜区及毛细血管袢内皮侧,MCP-1与IF/TA病理分级亦呈正相关(r=0.868,P<0.001)(表1)。ABMR患者血清肌酐升高的水平同纤维化程度分级的增加一致(r=0.898,P<0.001);MCP-1的表达同炎症细胞浸润亦具有正相关性(r=0.897,P <0.001)(表2)。
GSK-3β、NF-κB p65、RANTES 和 MCP-1 在不同免疫抑制方案组间的表达情况在环孢素和他克莫司两种为主的免疫抑制剂方案组之间GSK-3β、NF-κB p65、RANTES和MCP-1的表达无均无明显统计学差异(表3)。

表1 在IF/TA不同病理分级中GSK-3β、NF-κB p65、RANTES和MCP-1阳性表达面积百分比及相应SCr水平
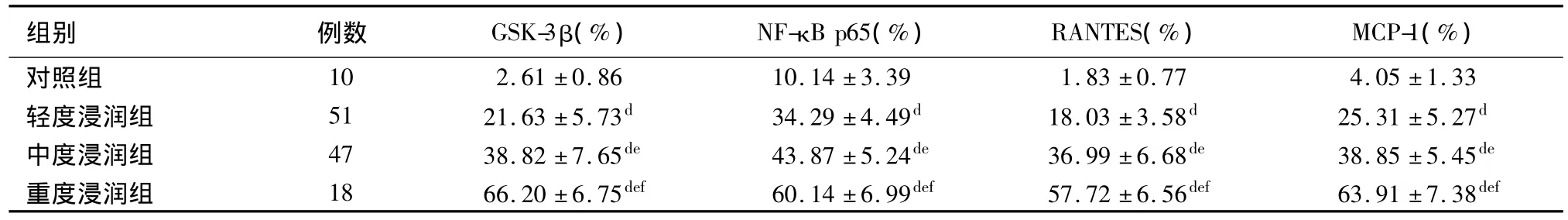
表2 ABMR患者肾组织中GSK-3β、NF-κB p65、RANTES和MCP-1表达面积百分比和炎症细胞浸润的关系
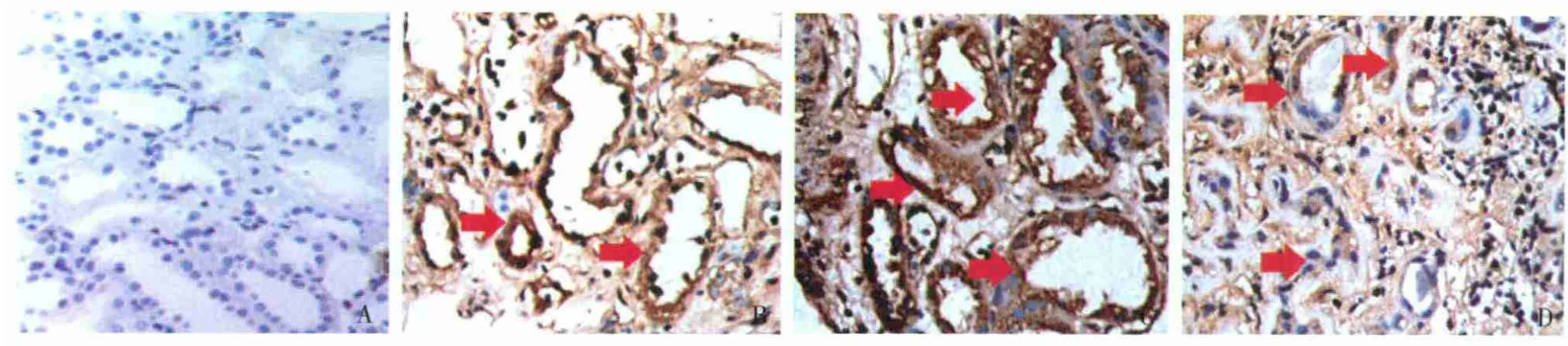
图1 ABMR移植肾组织中GSK-3β表达(↑)和IF/TA的关系

图2 GSK-3β的表达和炎症细胞(↑)浸润的关系

表3 GSK-3β、NF-κB p65、RANTES和MCP-1在不同免疫抑制方案组间的表达水平

图3 ABMR移植肾组织中NF-κB p65表达(↑)和IF/TA的关系
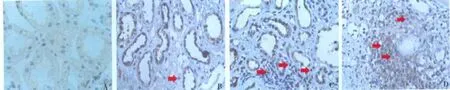
图4 NF-κB p65的表达和炎症细胞(↑)浸润的关系
讨 论
由于新型免疫抑制剂的应用、围手术期处理的改善,肾移植术后的近期效果已经得到显著改善,然而移植术后的长期生存率并不高。CRAD是移植肾功能衰竭的主要原因,包括:免疫和非免疫两方面因素[5],本研究主要围绕其免疫因素ABMR展开。
已知炎症细胞浸润在肾脏的慢性炎症和纤维化过程中发挥重要作用,炎症反应是肾脏纤维化发生、发展过程中的重要始动环节之一[6],包括CRAD在内,慢性炎症反应是导致肾单位进行性丢失的共同的病理过程[1]。有研究表明,巨噬细胞、T淋巴细胞等炎症细胞除了能分泌炎症因子介导持续性的肾小管上皮细胞、系膜细胞损伤外,还能产生大量致纤维化因子(如 TGF-β、PDGF等),促进细胞外基质(ECM)产生,导致肾脏纤维化;另外,巨噬细胞还能分泌金属蛋白酶抑制物和纤维酶原激活物抑制剂,抑制ECM的降解,促进肾脏纤维化的发生[7]。我们的前期研究已经证实,在CRAD患者移植肾组织中,GSK-3β的高表达同间质炎症细胞浸润和IF/TA的发生密切正相关[8]。同时,本研究结果还发现,在ABMR引起的CRAD发病机制中,肾间质炎症和间质纤维化的发生与GSK-3β和NF-κB p65的高表达密切相关。然而,GSK-3β和NF-κB p65如何介导ABMR引起的CRAD移植肾组织中炎症细胞的浸润和IF/TA的发生,尚未得到阐明。
GSK-3β是真核细胞生物体内普遍存在的丝氨酸/苏氨酸蛋白激酶,它不仅调节细胞糖代谢,更重要的是能够调节细胞分化、生长、突变及凋亡等生命活动,且在多种信号传导过程中也起着重要的作用,当GSK-3β(Ser9)磷酸化为pGSK-3β(Ser9)时失活。Gong等[9]在对 CRAD 的研究中证实,GSK-3β 在CRAD的炎症反应发生和调节促炎症介质NF-κB的活化过程中起着重要的作用。GSK-3β不但能够调节NF-κB的活化,且是 NF-κB活化必不可少的要素[2,10,11]。已知 NF-κB 是众多炎症性细胞因子转录的共同调节蛋白,对人体最重要及通常所说的NF-κB是 p50/RelA(p50/p65),其中 NF-κB p65 是其主要的功能亚基[12]。相关研究已证实,NF-κB的活化对于 RANTES[13]和 MCP-1[14]的表达非常重要,它能够调节RANTES和MCP-1的表达,从而影响单核/巨噬细胞、淋巴细胞等炎症细胞的聚集和活化,在ECM的产生和肾脏纤维化的病程中起着重要的作用。
在本实验中,GSK-3β在正常对照组肾组织中的表达较低或无,而在ABMR引起的CRAD移植肾组织中的表达明显增高,主要表达于肾小管细胞质中,同非ABMR引起的CRAD相关研究一致[9],且随着IF/TA分级的增加表达增多;同时GSK-3β的升高与 NF-κB p65、RANTES、MCP-1 及血清肌酐的上升水平一致,具有正相关性(r分别为 0.812、0.804、0.788 和 0.847,P <0.001);NF-κB p65 主要表达于肾小球系膜细胞、包囊上皮细胞和肾小管上皮细胞,其表达水平同IF/TA分级的增加和血清肌酐升高呈正比(r分别为0.914 和0.831,P <0.001)(表1,图2、4、6、8)。提示 GSK-3β 和 NF-κB p65 的异常高表达可能和ABMR引起的移植肾纤维化的发生和肾功能的恶化有关,故有必要进一步探讨GSK-3β和NF-κB在ABMR所导致的移植肾纤维化中的致病机制及相关临床意义。
Schwabe等[15]研究发现,NF-κB p65 的氨基酸序列包含了多个潜在的GSK-3β磷酸化的共同序列,RelA/p65是GSK-3β的同源底物,GSK-3β能够通过磷酸化NF-κB p65而使其激活,从而促进下游炎症介质RANTES和MCP-1基因的转录。而高选择性的GSK-3β抑制剂可降低NF-κB p65的磷酸化和NF-κB依赖的炎症介质MCP-1的表达,减少包括肾脏在内的多器官的损伤[16]。同时,Steinbrecher等[17]报道,在 GSK-3β敲除或抑制后的小鼠中,NF-κB DNA结合活性降低,且抑制了包括MCP-1、白细胞介素6在内的众多促炎症基因的转录。在内毒素血症所致急性肾衰竭模型中,GSK-3β抑制剂能够抑制内素素诱导的NF-κB的活化,抑制炎症的发生,从而保护肾脏[18]。可见,GSK-3β主要是通过调节下游信号分子NF-κB p65的表达和磷酸化,进而影响 NF-κB依赖的相关趋化因子 RANTES和MCP-1的表达,调节肾脏炎症反应的发生。
本研究亦发现,在ABMR所致的CRAD移植肾中,随着 GSK-3β、NF-κB p65、MCP-1 和 RANTES 表达的增加,间质炎症细胞的浸润亦随之增多,它们之间具有正相关性(r分别为 0.905、0.868、0.897 和0.931,P <0.001)(表2,图3、5、7、9)。高表达的GSK-3β主要通过诱导促炎症介质NF-κB p65的表达和活化,导致趋化因子MCP-1和RANTES的表达增加,诱导单核/巨噬细胞、T淋巴细胞的浸润和活化,促进 ECM的产生并抑制其降解,最终参与ABMR所致的CRAD的进程中。另外,已知NF-κB的活化是α平滑肌肌动蛋白(α-SMA)表达的始动因素,且α-SMA的出现是成纤维细胞分化为肌成纤维细胞的标志[19],肌成纤维细胞的生成可在肾间质产生胶原等ECM成分。可见,NF-κB除了通过诱导炎症细胞的浸润,产生大量致纤维化因子外,还能够促进肌成纤维细胞的生成,合成大量的ECM,最终导致移植肾纤维化。
此外,通过比较两种不同的免疫抑制治疗方案发现,不同的治疗方案对 GSK-3β、NF-κB p65、MCP-1和RANTES的表达无显著影响(表3)。在ABMR引起CRAD的发病机制中,GSK-3β和NF-κB等促炎因子主要参与了相关炎症细胞的浸润和活化,与不同的免疫抑制方案无相关性,同时也提示,通过调整免疫抑制治疗方案不能有效地阻断GSK-3β/NF-κB信号通路,即不能阻断炎症反应和肾间质纤维化的发生。
在以肾间质炎症反应[20]和间质纤维化为主[21,22]的其他肾病模型中,通过抑制 GSK-3β 的表达证实GSK-3β发挥了重要作用。本研究也发现,在ABMR导致的CRAD中,GSK-3β与移植肾间质炎症细胞浸润、活化和IF/TA的发生密切相关,提示,GSK-3β可成为减轻移植肾间质炎症反应和抗纤维化治疗的潜在靶点,通过抑制移植肾间质炎症反应和IF/TA的发生,延长移植肾功能。
综上所述,在ABMR引起的CRAD患者移植肾组织中,GSK-3β介导的炎症反应参与了CRAD的病变过程,同CRAD的发展关系密切,移植肾组织主要表现炎症反应和IF/TA。GSK-3β在移植肾组织中表达较正常肾组织明显增高,其主要通过诱导下游促炎症介质 NF-κB的活化及相关炎症介质(RANTES和 MCP-1)的表达,介导了炎症反应和IF/TA的发生和发展;作为GSK-3β的下游信号分子,NF-κB的激活介导了GSK-3β的促炎效应和促进了肌成纤维细胞的生成。因此,GSK-3β对于间质炎症的发生和ECM的合成有着重要的作用,对于治疗炎症损伤性慢性移植肾肾病、减少ECM的产生和预防移植肾丢失,GSK-3β可望成为一种新的治疗靶点,在一定程度上为延长移植肾存活时间提供了一条新的途径。
1 Ferenbach D,Kluth DC,Hughes J.Inflammatory cells in renal injury and repair.Semin Nephrol,2007,27(3):250-259.
2 Hoeflich KP,Lou J,Rubie EA,et al.Requirement for glycogen synthase kinase-3beta in cell survival and NF-kappaB activation.Nature,2000,406(6791):86-90.
3 Doble BW,Woodgett JR.GSK-3:tricks of the trade for a multi-tasking kinase.JCell Sci,2003,116(Pt 7):1175-1186.
4 Sis B,Mengel M,Haas M,et al.Banff'09 meeting report:antibody mediated graft deterioration and implementation of Banff working groups.Am JTransplant,2010,10(3):464-471.
5 Ahsan N,Cheung JY.Pathogenesis and molecular mechanisms of chronic allograft nephropathy.Contrib Nephrol,2003,139:187-204.
6 Filiopoulos V,Vlassopoulos D.Inflammatory syndrome in chronic kidney disease:pathogenesis and influence on outcomes.Inflamm Allergy Drug Targets,2009,8(5):369-382.
7 Yang N,Wu LL,Nikolic-Paterson DJ,et al.Local macrophage and myofibroblast proliferation in progressive renal injury in the rat remnant kidney.Nephrol Dial Transplant,1998,13(8):1967-1974.
8 Yan,Q,Wang B,Sui W,et al.Expression of GSK-3beta in renal allograft tissue and its significance in pathogenesis of chronic allograft dysfunction.Diagn Pathol,2012,7:5.
9 Gong R,Ge Y,Chen S,et al.Glycogen synthase kinase 3beta:a novel marker and modulator of inflammatory injury in chronic renal allograft disease.Am JTransplant,2008,8(9):1852-1863.
10 Jope RS,Johnson GV.The glamour and gloom of glycogen synthase kinase-3.Trends Biochem Sci,2004,29(2):95-102.
11 Kim SD,Yang SI,Kim HC,et al.Inhibition of GSK-3beta mediates expression of MMP-9 through ERK1/2 activation and translocation of NF-kappaB in rat primary astrocyte.Brain Res,2007,1186:12-20.
12 史艳晖,卢圣栋.转录因子NF-κB的研究现状及其应用前景.中国生物工程杂志,2007,27(4):110-114.
13 Gong R,Rifai A,Tolbert EM,et al.Hepatocyte growth factor ameliorates renal interstitial inflammation in rat remnant kidney by modulating tubular expression of macrophage chemoattractant protein-1 and RANTES.J Am Soc Nephrol,2004,15(11):2868-2881.
14 Tashiro K,Tamada S,Kuwabara N,et al.Attenuation of renal fibrosis by proteasome inhibition in rat obstructive nephropathy:possible role of nuclear factor kappaB.Int JMol Med,2003,12(4):587-592.
15 Schwabe RF,Brenner DA.Role of glycogen synthasekinase-3 in TNF-alpha-induced NF-kappaB activation and apoptosis in hepatocytes.Am JPhysiol Gastrointest Liver Physiol,2002,283(1):G204-211.
16 Dugo L,Collin M,Allen DA,et al.GSK-3beta inhibitors attenuate the organ injury/dysfunction caused by endotoxemia in the rat.Crit Care Med,2005,33(9):1903-1912.
17 Steinbrecher KA,Wilson W 3rd,Cogswell PC,et al.Glycogen synthase kinase 3beta functions to specify gene-specific,NF-kappaB-dependent transcription.Mol Cell Biol,2005,25(19):8444-8455.
18 Wang Y,Huang WC,Wang CY,et al.Inhibiting glycogen synthase kinase-3 reduces endotoxaemic acute renal failure by down-regulating inflammation and renal cell apoptosis.Br JPharmacol,2009,157(6):1004-1013.
19 Börgeson E,Godson C.Molecular circuits of resolution in renal disease.Scientific World Journal,2010,10:1370-1385.
20 Obligado SH,Ibraghimov-Beskrovnaya O,Zuk A,et al.CDK/GSK-3 inhibitors as therapeutic agents for parenchymal renal diseases.Kidney Int,2008,73(6):684-690.
21 Gong R,Rifai A,Ge Y,et al.Hepatocyte growth factor suppresses proinflammatory NFkappaB activation through GSK3beta inactivation in renal tubular epithelial cells.J Biol Chem,2008,283(12):7401-7410.
22 Yoshino J,Monkawa T,Tsuji M,et al.Snail1 is involved in the renal epithelial-mesenchymal transition.Biochem Biophys Res Commun,2007,362(1):63-68.

