IgA肾病牛津分类及验证研究
IgA肾病(IgAN)是常见的慢性肾小球肾炎之一,在西方国家其发病率占原发性肾小球肾炎20%~30%[1],亚洲人群中发病率明显偏高,在我国IgAN的发病率约占原发性肾小球肾炎的45.3%[2]。既往认为该病发展慢、预后好,但多年来研究表明,IgAN是患者进入终末期肾病(ESRD)常见病因之一。Le等[3]对1 155例中国成人IgAN患者进行长期预后及危险因素分析发现,IgAN患者10年、20年肾脏累积生存率分别为83%、64%,肾活检时大量蛋白尿、肾功能受损程度、高血压、高尿酸血症是疾病进展至ESRD的独立危险因素。免疫病理示肾小球系膜区IgA或以IgA为主的免疫复合物沉积为IgAN特征性表现。其病理表现多样,既有肾小球病变,也可伴肾小管间质、血管的损害,且肾小球之间病变程度不一。为了寻找能够判断疾病预后并指导临床治疗的病理指标,病理学家先后提出多种病理分类方法,主要分为半定量积分分类法[4]及单纯的分级分类法[5-7]两类,以往临床常用的病理分类法有Lee’s分类法[6]、Hass分类法[7]。由于各分类方法对诸多病理指标无明确定义、使用术语模糊,且未经过重复性检验、缺少循证医学证据,对病理指标与预后的相关性及其意义一直存在争议。上述分类法可为判断预后提供参考,但对治疗无指导意义,因此均未被广泛接受。目前临床工作中亟待一个能够指导治疗并对判断预后有价值的公认的病理分类。IgAN牛津分类是最新发表的病理分类,自提出后,世界各地的学者针对该病理分类是否能预测疾病预后的进行验证研究。本文就目前已发表的验证研究结果作一综述。
概 述
2004年由国际IgAN协作组和肾脏病理协会组成的工作组发起并组织了IgAN分类系统研究,并于2009年发表研究结果,因该研究协作组于2005年和2008年两次在牛津举行会议,故称为“IgAN牛津分类”[8,9]。该研究设计精密、严谨,共纳入全球四大洲、八个国家的265例患者,其中成人206例,儿童59例,明确定义观察的病理指标,验证其可重复性和可信度,着重分析如下病理指标:系膜细胞增生积分(M)、节段肾小球硬化或黏连(S)、毛细血管内细胞增生(E)、肾小管萎缩/间质纤维化(T)、细胞性或细胞纤维性新月体(C)、动脉积分(A)。通过分析上述病理指标与患者临床表现及预后间的相关性,最后提出M、E、S这三个病理指标可能预测疾病预后[肾脏存活率和(或)肾功能下降率],而E与免疫抑制治疗关系密切。在此基础上还推荐了规范的IgAN病理报告模板。
特点与局限性
IgAN牛津分类研究协作组的工作主要包括明确纳入病例的临床数据及病理资料的充分性(包括年龄、性别、种族等),统一用于分析预后的临床数据,同时定义病理病变及规定如何积分,测试各病理学家对同一病变积分的可重复性,分析各病理指标的易操作性,取样误差的可接受性,分析与疾病预后相关的病理指标的特点,最后总结出IgAN牛津分类[9]。该研究纳入人群来自不同国家、不同种族(66%高加索人,27%亚洲人)、不同年龄阶层(22%儿童),结果表明入选病理指标与患者的年龄和种族不相关,适用于大多数IgAN患者[9,10]。
尽管IgAN牛津分类自推出就被认为是一个可靠的分类系统,但该研究在设计时仍存在不少缺陷[9,10]:(1)为回顾性研究,纳入病例虽然多样,但仍有一些不具代表性病例未被纳入。病例纳入标准为经肾活检明确的IgAN,基线肾小球滤过率(eGFR)≥30 ml/(min·1.73m2),成人基线尿蛋白定量>0.5 g/24h,儿童基线蛋白尿≥0.5 g/(24h·1.73m2),排除基线eGFR<30 ml/(min·1.73m2)或随访不足12月者。对于病情轻微(尿蛋白尿定量<0.5 g/24h)及病情非常活动(如伴大量袢坏死及新月体形成)的患者均排除在外,使得新月体、袢坏死(N)等病理指标的潜在预测价值未体现出来。(2)纳入病例来自不同国家和中心,原始数据收集不统一,各实验室检验方法不同,因此误差不可避免。(3)强调病理指标的可重复性、可操作性,研究中可重复性差的病理指标均未列入最后分类,如正常肾小球比例、肾小球基膜分层、袢坏死、非纤维化皮质区间质炎症浸润的比例等。以往研究发现不少IgAN患者可出现血栓性微血管病变(TMA),但该病理指标未被纳入牛津分类的研究中[13]。(4)该分类系统基于IgAN肾活检组织的光镜特征,而免疫荧光、电镜的相关特征未被纳入研究中。(5)该病理分类虽然提出E对免疫抑制治疗有反应[9,12],但在预测治疗效果方面仍有很多问题未解答。
验证研究
综上所述,牛津分类存在不少缺陷,该分类在推广临床使用前,应在全球不同地区、不同种族的患者中进行更大规模的检验研究,况且C、N等病变是IgAN重要的病理改变,但是牛津分类研究未能明确这些病变与预后的关系。目前已发表的牛津分类验证研究共15个。Roberts[14]整理总结了13项牛津分类验证研究后发现,大多数研究结果显示T有独立预测价值,但在M、E、S与预后的关系上,研究结果各不同,并且指出各验证研究结果存在较大差异的原因可能是患者入选标准、预后评估标准的差异及受到免疫抑制治疗的影响,各个研究均为回顾性研究,仅极少数未接受免疫抑制及细胞毒药物治疗的研究能反映IgAN自然病程。
成人患者的验证研究牛津分类在成人患者的验证研究共有12个(表1),共7个研究来自亚洲地区,其中证实T能预测预后的研究有6个,4个提示M与预后差相关,有2个研究认为C也有预测价值。在分析病理指标与免疫抑制治疗的关系后,一项研究结果显示伴C、S者可受益于免疫抑制治疗,支持E的研究有1个。纳入病例数最大的是由南京军区南京总医院全军肾脏病研究所发起的中国IgAN牛津分类多中心验证研究[15],纳入了18个医疗单位的1 026名成年患者,与牛津分类研究纳入人群相比,两组患者的eGFR、体质量指数(BMI)、平均动脉压(MAP)均无显著差异。该研究将S病变分为S1(肾小球节段硬化或黏连)和单纯S(肾小球节段硬化,但不包括袢黏连),多因素分析结果提示M、T可用于预测疾病预后,在单因素分析中单纯S也与疾病预后相关。C、N也被纳入分析,但未发现有独立预测预后的价值,然而研究结果显示,伴E、C、N等增生性病变的患者更倾向于接受免疫抑制治疗。Katafuchi等[16]对702例日本患者的研究中也提及了C与预后的关系,在416例符合牛津分类研究的入选标准的患者中未发现C与肾脏预后的关系,另外的286例患者中包括了病情急性进展的患者,经多因素分析所有患者后发现,仅C和T与预后差显著相关,还指出伴C、S病变者经激素治疗后进展至ESRD的风险下降。亚洲的其他研究也证实T与疾病预后差密切相关,但M、E、S与预后关系存在不少差异。如中国另一项纳入410例患者的单中心研究经单因素分析认为M1、S1、C1、T1、T2与进展至ESRD相关,但多因素分析提示仅S与T与肾脏预后相关,伴E病变者可受益于免疫抑制治疗[17]。Kataoka等[18]研究显示M1提示预后差。韩国的另一项研究经多因素分析认为E能够预测IgAN预后,单因素分析结果提示M与预后也相关,并发现伴E、T病变的患者更倾向于接受免疫抑制治疗[19]。
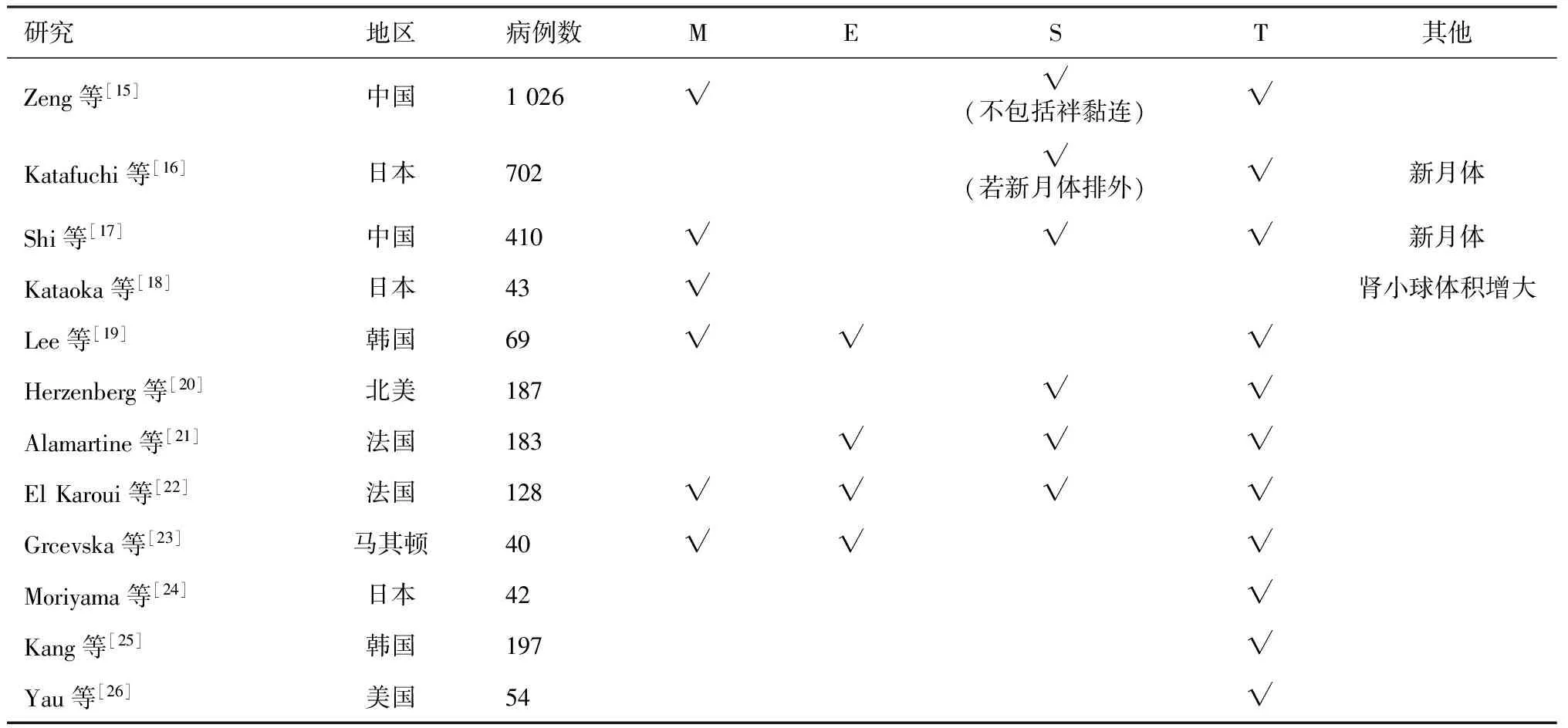
表1 成人IgA肾病患者牛津分类验证研究总结——病理指标与预后的关系
不同种族IgAN发病率显著不同,虽然牛津分类研究指出入选的病理指标与种族无关,但纳入病例数少,仍需要在不同种族中进一步验证其预测价值。在来自北美、欧洲的5个验证研究中,大多数认为T、E、S与IgAN预后差相关[20-23]。Herzenberg等[20]分析了北美4个中心187例患者(24%患者肾活检时<18岁)结果表明,S、T提示肾功能下降,大多数存在E、C者使用免疫抑制剂治疗,且存在E病变者经免疫抑制治疗后肾功能下降速度明显较未接受免疫抑制治疗者慢。Alamartine等[21]在183例法国患者中也验证了牛津分类的适用性,仅经单因素分析发现T、S、E与肾脏预后相关,结果还显示了存在M、S、T者更倾向于使用免疫抑制剂。EI等[22]的另一项研究则详细分析S与预后的关系,结果显示78.9%患者组织病理存在S,并提示肾功能下降,同时发现M、E、T也与预后差有关。
临床表现为肾病综合征(NS)的IgAN少见。亚洲国家IgAN的NS发生率10%~16.7%,西方国家发生率仅5%。大部分患者肾小球病变严重,多伴肾小球节段硬化、新月体形成、足细胞损伤、广泛的肾小管间质损害[27,28]。少数患者组织病理可表现类似于微小病变肾病(MCD)的病理特征,这些病例是MCD型IgAN还是MCD伴IgA沉积目前仍有争议。本文所阐述的临床表现为NS的IgAN是指系膜增生性IgAN。Moriyama等[24]利用牛津分类重新评估42例日本NS型IgAN患者的组织病理并结合临床进行分析,结果显示T程度轻的患者激素治疗效果好,对于无激素治疗的患者,eGFR低、T程度重是预后差的独立风险因素。Grcevska等[23]也对12例NS型的患者研究发现,肾脏生存率仅与T相关。
在儿童患者的验证研究牛津分类研究表明最终入选的病理指标与年龄不相关,也适用于儿童患者[10]。然而牛津分类研究中儿童仅占22%,以往不少研究结果显示儿童与成人IgAN患者的组织病理特征有显著差异[29,30]。与成人相比,儿童患者的系膜增生性病变和毛细血管内增生性病变多见,肾小管、间质及血管病变较少[30,31],因此牛津分类是否真的适用于儿童患者还有待扩大患者样本量进一步证实。
Le等[32]对中国7个肾脏病临床中心的218例儿童患者的组织病理进行牛津分类的验证研究,该组患者与牛津分类研究的儿童患者相似。在单因素分析模型中S、T与肾脏预后相关,多因素分析提示仅T提示预后差,分析各病理指标与免疫抑制治疗的关系后发现,大多数存在C者使用免疫抑制治疗。Shima等[33]分析了161例日本儿童患者,以进入CKD 3期作为随访终点,单因素分析结果提示M、E、T、新月体比例>30%是预测肾脏预后的指标,多因素分析结果提示仅M、T、新月体比例>30%有意义。Edstrom等[34]在瑞士患儿中的研究发现M>0.5、E和T>25%均提示预后差,C和肾小球球性硬化也提示了预后不良,并且存在E、C者多数采用免疫抑制治疗。上述研究结果显示,T是预测儿童患者疾病预后的有力指标,而M、E、S、C与预后关系在不同模型中结果不同,存在E、C者可能更倾向于使用免疫抑制治疗(表2)。

表2 儿童IgA肾病患者牛津分类验证研究总结——病理指标与预后的关系
免疫病理指标与牛津分类的关系IgAN牛津分类提出的病理指标均为光镜下特征,而免疫病理、超微结构的指标则未提及。D’Amico[35]分析了以往23个临床病理研究结果发现,有1/3病例可见IgA血管袢沉积,伴IgG沉积也是常见表现。IgA血管袢沉积和伴IgG沉积与临床预后差有一定关系,但荧光指标能否独立于其他病理指标并预测疾病预后仍不清楚。Bellur等[36]将牛津分类研究纳入的211例患者的荧光表现与M、E、S、T的关系进行分析发现,IgA血管袢沉积和伴 IgG沉积与M高及E重相关,但IgA血管袢沉积与C无关,提示了这些免疫病理特点与IgAN增生性病变有关,多因素分析结果提示IgA沉积部位及伴IgG沉积与肾功能不全或进展至ESRD无明确相关性,然而这些患者更倾向于接受免疫抑制治疗。虽然无充分证据显示荧光病理需被纳入到牛津分类中,但肾活检病理报告应显示是否伴IgG阳性及IgA沉积部位。
小结:IgAN牛津分类较以往的病理分类有实质性不同,包括明确定义病理术语、组织学积分方法及病理诊断报告模式等,提出了新的积分系统,目的在于发现可重复性好、可信度高且能预测疾病预后的病理指标指导临床诊治,推动了目前IgAN病理分类研究的进展。回顾已发表的验证研究发现,T是能预测IgAN预后的强有力的病理指标,但对于M、E、S的预测价值仍有争议,部分研究纳入了病情急性进展的患者后发现C与预后相关,且伴E、C、N增生性病变的患者临床上倾向于使用免疫抑制剂治疗,甚至有两个研究指出伴E、C病变的患者在接受免疫抑制治疗后预后优于未接受免疫抑制治疗者。然而所有的已经发表的牛津分类验证研究均为回顾性分析,只能间接反映组织学指标可以被用于指导临床治疗,今后的研究重点是在前瞻性随机对照临床试验中确定这些病理指标与治疗的关系及其预测疾病预后的价值。
1 Stratta P,Segoloni GP,Canavese C,et al.Incidence of biopsy-proven primary glomerulonephritis in an Italian province.Am J Kidney Dis,1996,27(5):631-639.
2 Li LS,Liu ZH.Epidemiologic data of renal diseases from a single unit in China:analysis based on 13,519 renal biopsies.Kidney Int,2004,66(3):920-923.
3 Le W,Liang S,Hu Y,et al.Long-term renal survival and related risk factors in patients with IgA nephropathy:results from a cohort of 1155 cases in a Chinese adult population.Nephrol Dial Transplant,2012,27(4):1479-1485.
4 Katafuchi R,Kiyoshi Y,Oh Y,et al.Glomerular score as a prognosticator in IgA nephropathy:its usefulness and limitation.Clin Nephrol,1998,49(1):1-8.
5 Goto M,Wakai K,Kawamura T,et al.A scoring system to predict renal outcome in IgA nephropathy:a nationwide 10-year prospective cohort study.Nephrol Dial Transplant,2009,24(10):3068-3074.
6 Lee SM,Rao VM,Franklin WA,et al.IgA nephropathy:morphologic predictors of progressive renal disease.Hum Pathol,1982,13(4):314-322.
7 Haas M.Histologic subclassification of IgA nephropathy:a clinicopathologic study of 244 cases.Am J Kidney Dis,1997,29(6):829-842.
8 Working Group of the International IgA Nephropathy Network and the Renal Pathology Society,Roberts IS,Cook HT,Troyanov S,et al.The Oxford classification of IgA nephropathy:pathology definitions,correlations,and reproducibility.Kidney Int,2009,76(5):546-556.
9 Working Group of the International IgA Nephropathy Network and the Renal Pathology Society,Cattran DC,Coppo R,Cook HT,et al.The Oxford classification of IgA nephropathy:rationale,clinicopathological correlations,and classification.Kidney Int,2009,76(5):534-545.
10 Working Group of the International IgA Nephropathy Network and the Renal Pathology Society,Coppo R,Troyanov S,Camilla R,et al.The Oxford IgA nephropathy clinicopathological classification is valid for children as well as adults.Kidney Int,2010,77(10):921-927.
11 Mubarak M.Nomenclature of the Oxford classification of IgA nephropathy:do we need to be careful? Kidney Int,2010,77(1):74,author reply 74-75.
12 Eitner F,Floege J.Glomerular disease:the Oxford classification--predicting progression of IgAN.Nat Rev Nephrol,2009,5(10):557-559.
13 Hill GS,Nochy D,El Karoui K.Comments on the Oxford classification of IgA nephropathy.Kidney Int,2009,76(11):1207,author reply 1207.
14 Roberts IS.Oxford classification of immunoglobulin A nephropathy:an update.Curr Opin Nephrol Hypertens,2013.
15 Zeng CH,Le W,Ni Z,et al.A multicenter application and evaluation of the oxford classification of IgA nephropathy in adult chinese patients.Am J Kidney Dis,2012,60(5):812-820.
16 Katafuchi R,Ninomiya T,Nagata M,et al.Validation study of oxford classification of IgA nephropathy:the significance of extracapillary proliferation.Clin J Am Soc Nephrol,2011,6(12):2806-2813.
17 Shi SF,Wang SX,Jiang L,et al.Pathologic predictors of renal outcome and therapeutic efficacy in IgA nephropathy:validation of the oxford classification.Clin J Am Soc Nephrol,2011,6(9):2175-2184.
18 Kataoka H,Ohara M,Shibui K,et al.Overweight and obesity accelerate the progression of IgA nephropathy:prognostic utility of a combination of BMI and histopathological parameters.Clin Exp Nephrol,2012,16(5):706-712.
19 Lee H,Yi SH,Seo MS,et al.Validation of the Oxford classification of IgA nephropathy:a single-center study in Korean adults.Korean J Intern Med,2012,27(3):293-300.
20 Herzenberg AM,Fogo AB,Reich HN,et al.Validation of the Oxford classification of IgA nephropathy.Kidney Int,2011,80(3):310-317.
21 Alamartine E,Sauron C,Laurent B,et al.The use of the Oxford classification of IgA nephropathy to predict renal survival.Clin J Am Soc Nephrol,2011,6(10):2384-2388.
22 El Karoui K,Hill GS,Karras A,et al.Focal segmental glomerulosclerosis plays a major role in the progression of IgA nephropathy.II.Light microscopic and clinical studies.Kidney Int,2011,79(6):643-654.
23 Grcevska L,Ristovska V,Nikolov V,et al.The Oxford classification of IgA nephropathy:single centre experience.Prilozi,2010,31(2):7-16.
24 Moriyama T,Nakayama K,Iwasaki C,et al.Severity of nephrotic IgA nephropathy according to the Oxford classification.Int Urol Nephrol,2012,44(4):1177-1184.
25 Kang SH,Choi SR,Park HS,et al.The Oxford classification as a predictor of prognosis in patients with IgA nephropathy.Nephrol Dial Transplant,2012,27(1):252-258.
26 Yau T,Korbet SM,Schwartz MM,et al.The Oxford classification of IgA nephropathy:a retrospective analysis.Am J Nephrol,2011,34(5):435-444.
27 Fukushi K,Yamabe H,Ozawa K,et al.Clinico-pathological evaluation of IgA nephropathy associated with nephrotic syndrome.Nihon Jinzo Gakkai Shi,1988,30(3):247-251.
28 鲍浩,黎磊石,刘志红,等.不同类型IgA肾病的临床病理比较.肾脏病与透析肾移植杂志,2006,15(5):409-415.
29 Okada K,Funai M,Kawakami K,et al.IgA nephropathy in Japanese children and adults:a comparative study of clinicopathological features.Am J Nephrol,1990,10(3):191-197.
30 Haas M,Rahman MH,Cohn RA,et al.IgA nephropathy in children and adults:comparison of histologic features and clinical outcomes.Nephrol Dial Transplant,2008,23(8):2537-2545.
31 Yamamoto R,Nagasawa Y.Pathology:Oxford IgA nephropathy classification:valid for children? Nat Rev Nephrol,2010,6(11):638-639.
32 Le W,Zeng CH,Liu Z,et al.Validation of the Oxford classification of IgA nephropathy for pediatric patients from China.BMC Nephrol,2012,13:158.
33 Shima Y,Nakanishi K,Hama T,et al.Validity of the Oxford classification of IgA nephropathy in children.Pediatr Nephrol,2012,27(5):783-792.
34 Edström Halling S,Söderberg MP,Berg UB.Predictors of outcome in paediatric IgA nephropathy with regard to clinical and histopathological variables (Oxford classification).Nephrol Dial Transplant,2012,27(2):715-722.
35 D’Amico G.Natural history of idiopathic IgA nephropathy and factors predictive of disease outcome.Semin Nephrol,2004,24(3):179-196.
36 Bellur SS,Troyanov S,Cook HT,et al.Immunostaining findings in IgA nephropathy:correlation with histology and clinical outcome in the Oxford classification patient cohort.Nephrol Dial Transplant,2011,26(8):2533-2536.

