海南斑等蝎钾通道阻断剂Im58的克隆、表达 、纯化和鉴定
尹世金,兰 珍,李羽欣
(中南民族大学生物医学工程学院,武汉430074)
蝎是生存了4亿多年最古老的物种之一[1],蝎在进化中形态没有很大变化,这与其有一套用于捕食和防御的有效武器——蝎尾腺分泌的毒液有关.蝎毒素是一类由20~80个氨基酸组成的小肽(2~9Kd),能够选择性地与细胞膜上的 K+、Na+、Cl-和Ca2+等离子通道结合,调节细胞对离子的通透能力,进而影响动物机体、组织和细胞的生理功能[2-7].作用于K+通道的蝎毒肽是一类由20~40个氨基酸通过3或4个二硫键交联而成的具有多种生物活性的小分子多肽,它不仅可作为研究相关的靶离子通道受体调控胞内信息转导的分子探针,还可为构建系列肽类药物提供理想的分子模板[8].
序列比对分析表明,从海南斑等蝎毒腺分离的Im58多肽是哺乳动物Kv1.3通道的阻断剂.Kv1.3通道是电压门控钾通道Kv1.x亚家族中的一员,它在哺乳动物体内分布较广,主要表达在脑、肺、胸腺、脾等组织的 T细胞膜上[9].当人体自身免疫失调时,体内的T细胞发生大量的激活,增殖和分化,引起自身免疫疾病.研究表明,Kv1.3通道在调节T细胞的膜电位及钙离子信号转导途径中起着非常重要的作用,T细胞表面的Kv1.3通道数目的变化与自身免疫疾病密切相关[10].近年来国内外正在积极开展自身免疫疾病的治疗,研究表明钾通道Kv1.3可以作为治疗自身免疫疾病的药物靶标,研发靶向钾通道Kv1.3调节剂已成为新型免疫抑制药物的发展方向[11].
在各种有毒动物的天然毒素中,大部分高亲和性Kv1.3通道阻断剂都来自蝎毒素[12].故以蝎毒肽为基础筛选与设计多肽药物寻找高特异性和选择性的Kv1.3通道调节剂,具有重要的理论意义和应用价值.本研究采用基因重组技术成功构建了Kv1.3通道阻断剂的原核表达载体PGEX-4T-1-Im58,表达、纯化和鉴定了新型蝎毒肽Im58,为进一步研究Im58的生物学功能奠定了基础.
1 材料和方法
1.1 材料与试剂
表达质粒 PGEX-4T-1、实验菌株 DH5α、E.coli/Rosetta(DE3)等由武汉大学病毒及分子癌学实验室李文鑫教授课题组提供.限制性内切酶 BamHI、XhoI、异丙基-β-D-硫代半乳糖苷(IPTG)、PCR 所用试剂和酶(TakaRa公司,日本),T4DNA连接酶、PCR产物回收试剂盒、DNA Marker(Fermentas公司,加拿大),质粒小量快速提取试剂盒、琼脂糖胶回收试剂盒、小肠激酶(武汉摩尔肽公司),还原型谷胱甘肽(GSH,武汉众一生物技术公司),小分量蛋白Marker(武汉凌飞生物技术公司),10KD截流的超滤管(Milipore公司,德国),其他试剂均为国产分析纯.
1.2 扩增Im58基因序列
从海南斑等蝎的毒腺cDNA文库中,分离得到一条新的cDNA Im58,根据其成熟肽的序列和大肠杆菌偏好的密码子,设计的4条overlap引物见表1.

表1 Overlap PCR引物序列Tab.1 Primer sequences for overlap PCR
Im58的基因通过2轮PCR扩增获得:第1轮PCR用引物Im58-FP2和Im58-RP2进行overlap PCR扩增.然后将第1轮PCR产物稀释100倍为模板,以引物Im58-FP1和Im58-RP1进行第2轮PCR.两次PCR反应条件均为:95℃预变性5 min,95℃变性 30 s,55℃ 复性 30 s,72℃ 延伸 45 s,72℃ 延伸 5 min,循环25次.PCR产物用2%的琼脂糖凝胶电泳,利用凝胶成像系统进行观察分析,并用PCR产物回收试剂盒回收纯化.
1.3 PGEX-4T-1-Im58重组表达质粒的构建
将回收纯化的PCR产物和表达载体PGEX-4T-1用BamHI和XhoI双酶切,37℃酶切12 h后,酶切产物分别电泳,并对双酶切的Im58片段和载体片段分别用PCR产物回收试剂盒和琼脂糖胶回收试剂盒回收纯化.分别取酶切的Im58片段和载体片段以1∶3的比例混合后,在T4DNA连接酶作用下22℃,1 h连接.构建重组表达载体.
1.4 阳性重组克隆的筛选
将连接产物转化DH5α感受态细胞,37℃温箱培养过夜后,从含Amp的LB平板上挑取3个单克隆,接种于含Amp的LB液体培养基37℃培养5 h,再用PCR扩增对培养物检测.PCR的引物,反应条件和过程同1.2,扩增产物用2%的琼脂糖凝胶电泳检测.提取阳性克隆的质粒,用BamHI和XhoI酶切重组质粒,用1%的琼脂糖凝胶电泳检测质粒酶切产物,对筛选的阳性克隆测序.
1.5 融合蛋白诱导时间和诱导剂浓度的选择
将测序正确的Im58重组载体转化入表达菌种E.coli/Rosetta(DE3).将表达菌37℃摇过夜,次日取菌液1 mL,接种于含Amp(100 μg/mL)的100mL LB液体培养基,37℃培养到OD600=0.6时,取培养的菌液10 mL,加入终浓度为1.0 mmol/L的IPTG进行诱导.再将菌液在28℃培养5 h,分别于2,3,4,5 h吸取菌液2 mL,离心、PBS重悬菌体并超声破碎,取上清进行Tricine系统的SDS-PAGE电泳.同法取培养的菌液5管,每管5 mL,加入IPTG的终浓度分别为 0.1,0.2,0.5,1.0,2.0 mmol/L 于28℃继续培养4 h.各收集菌液2 mL,离心、PBS重悬并超声破碎,取上清进行Tricine系统的SDS-PAGE电泳.
1.6 融合蛋白的表达纯化
在含Amp的LB液体培养基中接种表达菌,接种量为1∶100,一次表达1 L,37℃培养到 OD600=0.6时,加入终浓度为0.2 mmol/L的 IPTG进行诱导,再将菌液在28℃培养4 h,离心收集菌体.加入40 mL PBS重悬,超声破细胞,离心收集上清,将收集的上清加入到GSH层析柱中.用PBS缓冲液冲洗GSH亲和层析柱以去除杂蛋白,再用40 mL的GSH洗脱液洗脱融合蛋白.将收集到的融合蛋白用10KD截流的超滤管离心浓缩脱盐至每升菌液约1 mL.超滤得到浓缩的融合蛋白用EK酶酶切,23~25℃水浴酶切过夜.
1.7 蝎毒肽Im58的RP-HPLC纯化
酶切混合液离心后,取上清进行RP-HPLC分离纯化.HPLC的上样体积是1 mL,流速为5 mL/min.RP-HPLC的固定相是C18反相柱,流动相为:溶液B是0.1%TFA,溶液D是0.1%TFA+90%的乙腈.RP-HPLC的洗脱梯度:60 min线性梯度,初始B的体积比为95%,D为5%,结束时 B的体积比为5%,D为95%;测量波长为230 nm.
1.8 纯化的重组蝎毒肽的鉴定
将表达纯化各个步骤的蛋白样品取样,进行Tricine系统的SDS-PAGE蛋白质电泳,初步鉴定多肽的分子量大小及纯度.并取蛋白样通过MALDITOF-MS精确测量多肽的分子量.
2 结果和分析
2.1 重组表达载体的构建
PGEX-4T-1-Im58重组表达质粒的构建如图1所示,PGEX-4T-1载体是带GST标签含Amp抗性的克隆载体,GST标签在目的片段Im58前面,这种带GST标签的融合蛋白组合有利于蛋白表达纯化.

图1 载体PGEX-4T-1-Im58的构建Fig.1 Construction of vector PGEX-4T-1-Im58
2.2 Im58基因的扩增
通过overlap PCR扩增两次获得Im58全长片段,如图2所示,经2%的琼脂糖凝胶电泳,可以见一条长度为150bp的明亮的条带,与理论值相符合.

图2 Im58基因扩增产物Fig.2 The amplification product of Im58 gene
2.3 重组质粒的鉴定
如图3所示,通过PCR鉴定和BamHI、XhoI双酶切重组克隆质粒鉴定法,获得了约150 bp的目标片段,证明重组质粒 PGEX-4T-1-Im58已经构建成功.

图3 重组质粒PGEX-Im58的分子鉴定Fig.3 Identification of the recombined plasmid PGEX-Im58
2.4 表达条件的优化
不同诱导条件,融合蛋白的表达结果见图4.由图4可见,在28℃诱导条件下,IPTG的终浓度为1 mmol/L,诱导时间为2,3 h时产量均较低,当诱导时间为4,5 h时产量较高.若 IPTG浓度为0.2 mmol/L时产量略高;故确定融合蛋白表达的最佳条件为:28℃,0.2 mmol/L IPTG,诱导 4 h.

图4 不同表达条件下融合蛋白在Tricine系统的SDS-PAGE电泳分析Fig.4 Analysis of fusion protein by SDS-PAGE of Tricine system under different expression conditions
2.5 融合蛋白的表达纯化
融合蛋白的表达纯化结果见图5.
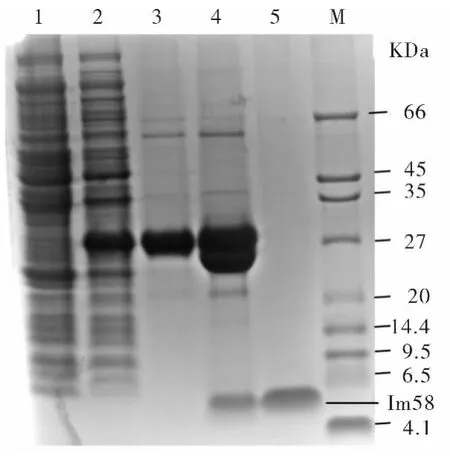
图5 Im58多肽在Tricine系统的SDS-PAGE的表达纯化Fig.5 The expression and purification of Im58 peptide by SDS-PAGE of Tricine system
由图5可见,包含重组质粒的大肠杆菌Rosseta培养到OD600=0.6时,加入0.2 mmol/L IPTG 诱导4 h后,细胞上清蛋白中多出一条约30KD的条带,这是由于在重组表达 Im58的系统中,在 Im58(4KD)前面融合了一个26KD的GST(谷胱甘肽转移酶)标签所形成的GST-Im58融合蛋白.经GST亲和层析柱纯化所得GST-Im58融合蛋白,经超滤脱盐浓缩,蛋白浓度较高.浓缩后的蛋白用EK酶酶切,产生一条26KD的带(谷胱甘肽转移酶)和一条4KD(目的蛋白Im58)的条带.
2.6 蝎毒肽的RP-HPLC分离纯化
蝎毒肽的RP-HPLC分离纯化结果见图6.如图6所示,经EK酶酶切后的蛋白混合物经RP-HPLC用C18柱分离纯化,60 min溶液梯度线性洗脱,230 nm紫外波长下检测,蝎毒肽Im58得到了很好的分离.
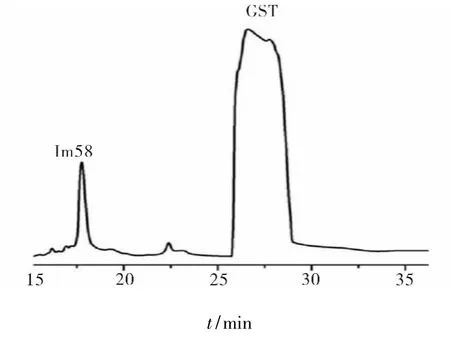
图6 Im58经HPLC的分离纯化Fig.6 Separation and purification of Im58 by HPLC
2.7 蝎毒肽的分子量鉴定
蝎毒肽的分子量鉴定结果见图7.由图7可见,将经RP-HPLC纯化的蝎毒肽进行MALDI-TOF-MS测定分子量,测得分子量为4369.38,与预期分子量4369.4 一致.
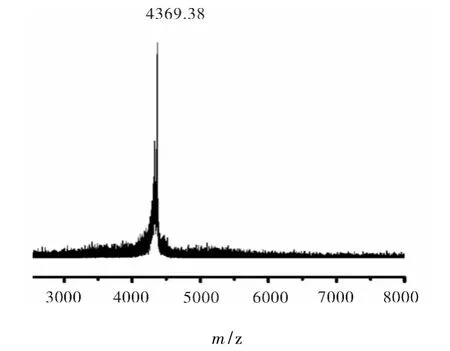
图7 Im58的分子量鉴定Fig.7 Identify the molecular weight of Im58
3 讨论
蝎毒素是一类富含二硫键的小肽,其中大部分多肽可作用不同类型的离子通道,在研究离子通道的性质和药物开发等方面具有重要的应用价值.蝎毒素由于富含二硫键,在重组表达毒素过程中常有诸多困难,如二硫键不能正确配对,表达产物易降解,缺乏转录加工修饰蛋白的机制等.本实验采用GST融合表达系统成功地在大肠杆菌 E.coli/Rosetta(DE3)中表达了GST-Im58.GST融合表达系统广泛用于各种融合蛋白的表达,该系统与其他系统相比表达效率高,操作简便,表达的蛋白质带有GST头部,可利用含有还原型谷胱甘肽的纯化柱进行纯化,得到单纯的融合蛋白,去除背景蛋白的干扰;它还具有剪切的功能,可将GST的头部切除,得到单一的目的蛋白,进行相关功能的研究[13].
为获得和天然毒素氨基酸序列相同的蝎毒素,本研究选用单向识别切割的小肠激酶(EK酶),它能识别DDDDK序列,并且在K之后切割蛋白,获得的蛋白在N端不含多余的氨基酸序列,并对一些表达条件和工艺进行了优化,使重组蝎多肽纯度高并具有良好生物活性.由于蝎多肽基因是真核生物的基因,其蛋白编码采用的密码子与大肠杆菌有一定的区别,采用大肠杆菌表达会在翻译水平上对蛋白质表达产生不良的影响,故本研究采用经过修饰的Rosetta菌株,专用于带有大肠杆菌稀有密码子的真核蛋白表达[14].
本研究为融合蛋白的原核表达提供一定的参考价值,同时本实验成功表达了Im58多肽,可直接用于深入研究其生物学功能.
致谢:感谢武汉大学病毒及分子癌学实验室李文鑫教授课题组提供的材料和陈宗运博士方法上的指导.
[1]Briggs D E G.Scorpions take to the water[J].Nature,1987,326:645-646.
[2]Debont T,Swerts A,Van der Walt J J,et al.Comparison and characterization of the venoms of three Parabuthus scorpion speciesoccurring in southern Africa[J].Toxicon,1998,36(2):341-352.
[3]Garcia M L,Hanner M,Knaus H G,et al.Pharmacology of potassium channels[J].Adv Pharmacol,1997,39:425-471.
[4]Gordon D,Savarin P,Gurevitz M,et al.Functional anatomy of scorpion toxins affecting sodium channels[J].J Toxicol Toxin Rev,1998,17(2):131-159.
[5]Tytgat J,Chandy G,Garcia M L,et al.A unified nomenclature for short-cha in peptides isolatedfrom scorpion venoms:alpha-KTx molecular subfamilies[J].Trends Pharmacol Sci,1999,20(11):444-447.
[6]Valdivia H H,Possani L D .Peptide toxins as probes of ryanodine receptor[J].Trends Cardiovasc Med,1998,8(3):111-118.
[7]Possani L D,Becerril B,Delepierre M,et al.Scorpion toxins specific for Na+-channels[J].Eur J Biochem,1999,264(2):287-300.
[8]Vita C,Roumestand C,Toma F,et al.Scorpion toxins as natural scaffolds for protein engineering[J].Proc Natl Acad Sci USA,1995,92(14):6404-6408.
[9]Grissmer S,Dethlefs B,Wasmuth J J,et al.Expression and chromosomal localization of a lymphocyte K+channel gene[J].Proc Natl Acad Sci USA,1990,87(23):9411-9415.
[10]Chandy K G,Cahalan M D,Grissmer S.Autoimmune diseases linked to abnormal K+channel expression in double-negative CD4-CD8-T cells[J].Eur J Immunol,1990,20(4):747-751.
[11]Chandy K G,Wulff H,Beeton C,et al.K+channels as targets for specific immunomodulation[J].Trends Pharmacol Sci,2004,25(5):280-289.
[12]Panyi G,Possani L D,Rodríguez de la Vega R C,et al.K+channel blockers:novel tools to inhibit T cell activation leading to specific immunosuppression[J].Curr Pharm Des,2006,12(18):2199-2220.
[13]Wu X,Oppermann U.High-level expression and rapid purification of rare-codon genes from hyperthermophilic archaea by the GST gene fusion systerm[J].J Chromatogr B Analyt Technol Biomed Life Sci,2003,786(1/2):177-185.
[14]华子春.蛋白质高效表达技术[M].北京:化学工业出版社,2010:2-17.

