水稻萌发期耐Cu2+ 胁迫的QTL 定位*
饶玉春,杨窑龙,李晓静,马伯军,曾大力
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.中国水稻研究所 水稻生物学国家重点实验室,浙江 杭州 310006)
20 世纪以来,随着工农业、采矿、冶炼和制造等产业的快速发展,农用化学品的大量使用及城市污水的排放,植物受铜毒害的报道和研究逐渐增多[1-3].铜是水稻生长必须的微量元素,其对水稻的影响间接且较为复杂[4].过量的铜会导致水稻的铜毒害,阻碍水稻生长[5-6],甚至影响水稻产量[7-8].另外,铜在水稻体内大量累积,通过食物链传递,进而会威胁人类的健康[9].
铜伤害植物首先是对根系,伤害最严重的也是根系[10-11].铜对水稻幼苗根的生长有显著的抑制作用,当铜质量浓度为50 mg/L 时,水稻根生长的抑制率达54%;铜质量浓度为600 mg/L 时,抑制率高达99%,根的长度与铜浓度呈显著的负相关[12].水稻受铜毒害后通常表现为叶子细弱,叶片失绿发黄或紫红乃至枯萎,返青延迟,心叶逐渐扭曲,植株瘦小,分蘖明显减少,抽穗和成熟期延迟,且随着污染程度加重,毒害症状相应加重[13].铜毒害主要是通过影响其他营养元素的吸收造成的.徐加宽等[14]研究发现,在土壤铜胁迫条件下,水稻吸磷能力明显下降,影响植株的光合作用;邵登辉等[15]发现铜胁迫能显著影响水稻对氮的吸收;Hiroki 等[16]在烟草细胞的研究中发现,铜能使质膜钙通道的钙通量增大,从而增加细胞溶质中的游离钙.另外,铜胁迫对水稻光合作用、体内激素含量、细胞结构及质膜透性等均有影响[17].
目前,从分子和基因水平研究植物抗重金属污染已引起国内外学者的高度重视[18],但在水稻上分离出来的耐铜胁迫基因或主效数量性状基因座(QTL)少有报道.本研究尝试应用一对典型的籼粳交(春江06/台中本地1 号)F1 经花药培养产生的双单倍体(DH)群体及其构建的分子连锁图谱,系统考察了该DH 群体及其双亲耐铜胁迫的情况,进行了QTL 分析,并计算了QTL 对水稻耐铜性的贡献率和加性效应,同时还进行了复合QTL 模型分析,以探讨水稻耐铜胁迫的遗传基础.
1 材料与方法
1.1 遗传群体的构建
本研究利用籼稻品种台中本地1 号(TN1)和粳稻品种春江06(CJ06)为亲本,对F1 代进行花药离体培养,再经自然加倍或秋水仙素处理,共获得纯合二倍体(DH系)120个株系,组成DH 群体.
1.2 铜胁迫浓度的确定
为确定合适铜胁迫处理的浓度,对DH 群体亲本CJ06 和TN1 进行了浓度梯度处理,设0,50,100,200,400,800,1 600 μmol/L 共7 个浓度的CuSO4溶液做梯度处理,每个处理3 次重复.考察双亲在各性状上的差异程度,选取合适的浓度对DH 群体进行处理,用灭菌水作对照.
1.3 DH 群体耐铜胁迫的考察
种子萌发参照Tomar 等[19]的方法.取各株系的水稻种子500 粒,经0.50%次氯酸钠表面消毒20 min,再用去离子水冲洗数次,28 ℃暗中浸种催芽48 h,挑选露白一致的种子播于垫有2 层滤纸的培养皿内培养,共6 皿,培养皿直径约9 cm,其中3 皿用CuSO4溶液培养,另3 皿灭菌水培养.第l 天加入8 mL CuSO4溶液或灭菌水,每隔24 h换一次,连续4 d 后结束.以芽长超过1/2 种子长为发芽标准,以根长超过1/2 种子长为发根标准,记录发芽数、发根数,计算发芽率、发根率;随机取20 粒种子测定根长、芽长;并对每皿的总根和芽称质量,以CuSO4溶液条件下对灭菌水条件下的百分率表示耐抑制程度.
1.4 连锁图谱的构建和QTL 定位
利用微卫星DNA(SSR)和序列标志位点(STS)标记,构建了该DH 群体的高密度分子标记连锁图谱,从中选取178 个均匀分布在12 条染色体上的标记构建连锁图谱,该连锁图谱总共覆盖1 674.80 cM,平均图距为9.44 cM,它们均适合QTL 区 间 作 图[20-21].采 用 作 图 分 析 软 件Mapmaker/Exp3.0b,用QTL 分析软件mapmaker/QTL1.1B 对控制水稻种子萌发时期的相关性状进行QTL 分析.以检出限(LOD)为2.50 作为阈值判断QTL 的存在与否,若标记区间检出限>2.50,则认为该区间检出限最高处所对应的位点为一个QTL.同时,计算出每个QTL 对各性状表型方差的贡献率和加性效应,QTL 的命名原则遵循McCouch 等[22-23]的方法.
2 结果与分析
2.1 铜胁迫浓度的确定
本实验采用0,50,100,200,400,800,1 600 μmol/L 共7 个浓度的CuSO4溶液做梯度处理,对DH 群体双亲CJ06 和TN1 进行胁迫处理,并通过统计方法方差分析.结果显示:双亲在100 μmol/L CuSO4溶液的处理下差异显著(见表1),此时TN1 的发芽率和发根率都在97%以上,几乎不受铜胁迫的影响;而CJ06 在该浓度下的发芽率为83%,发根率仅为61%,受胁迫的表现明显;同时,双亲的平均芽长、平均根长、芽质量和根质量差异度很明显.当CuSO4溶液浓度超过200 μmol/L 以后,双亲各性状受胁迫的影响都很大,铜浓度越高,受胁迫的表型越明显,但双亲之间的差异难以区分.
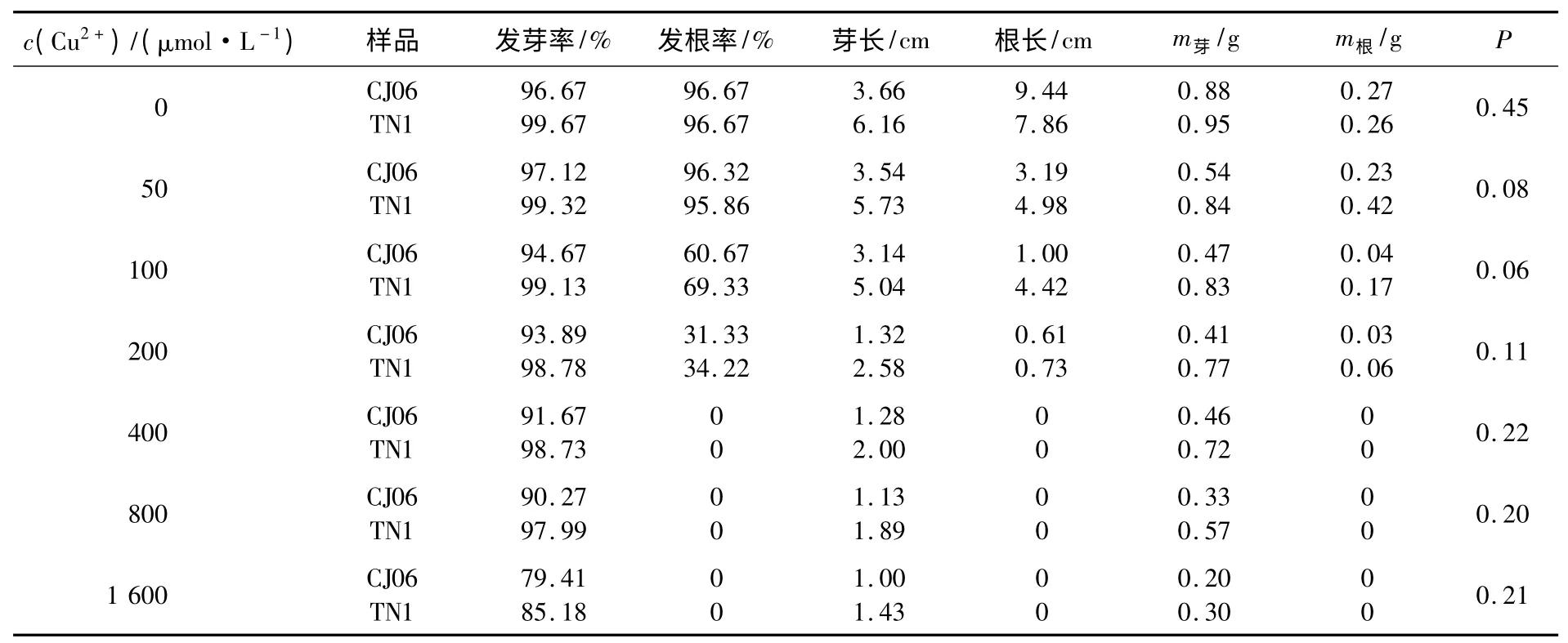
表1 不同浓度铜处理下双亲萌发期的性状表现
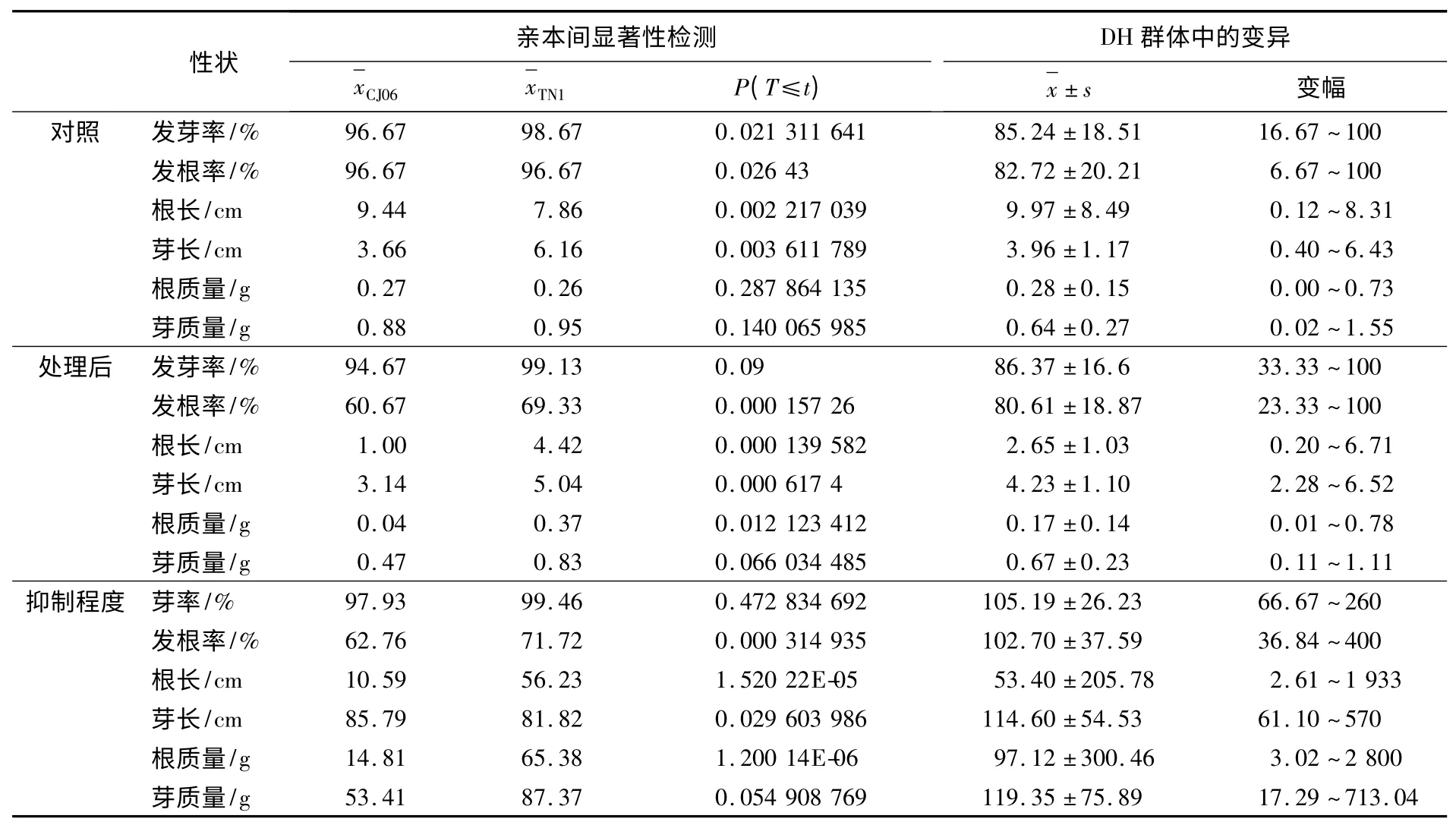
表2 铜胁迫下水稻萌发期相关性状在亲本间的显著性检测及在DH 群体中的表现
2.2 双亲和群体在各性状上的表现
用100 μmol/L CuSO4溶液处理DH 群体中的后代各株系,并考察了萌发期相关性状的数据,同时用灭菌水处理作对照.结果发现,亲本CJ06在发芽率、发根率、平均芽长、根质量和芽质量等性状上对铜胁迫比TN1 敏感(见表2),尤其发根率和平均芽长最为明显.且120 个DH 株系对铜胁迫的耐抑制表现为连续正态分布,且有一定数量的超亲类型存在,符合QTL 区间作图的要求.
2.3 性状间的相关性分析
表3 是各性状的相关性分析结果,表明:水稻发芽率与发根率、根质量与芽质量之间均呈现显著的正相关,尤其是水稻种子的发芽率与发根率之间,在处理前后其相关系数都达到了0.90,而根质量与芽质量的相关系数也达到了0.50 附近.由此可以说明,水稻发芽期间,根与芽之间有着密切的相关性.在这些性状中,根长与其他的性状并不存在相关性,说明根长与其他性状关系并不密切.同时,相关性分析也表明:未用CuSO4溶液处理的水稻种子,其平均芽长与平均根长并无显著相关性;而用100 μmol/L CuSO4溶液处理后,其平均芽长与平均根长呈现显著正相关.这可能是由于用100 μmol/L CuSO4溶液处理对水稻种子的平均芽长与平均根长影响较大.
2.4 QTL 定位
利用该DH 群体对水稻萌发期相关性状进行了QTL 分析,有11 个性状检测到了相关的QTL(见图1 和表4),共有30 个QTLs,它们分布于除8,11 和12 染色体外的其他9 条染色体上.其中,用灭菌水处理种子后检测到萌发期相关性状的QTL 共22 个,用100 μmol/L CuSO4溶液处理后检测到萌发期相关性状的QTL 共6 个,而抑制程度共检测到1 个QTL.
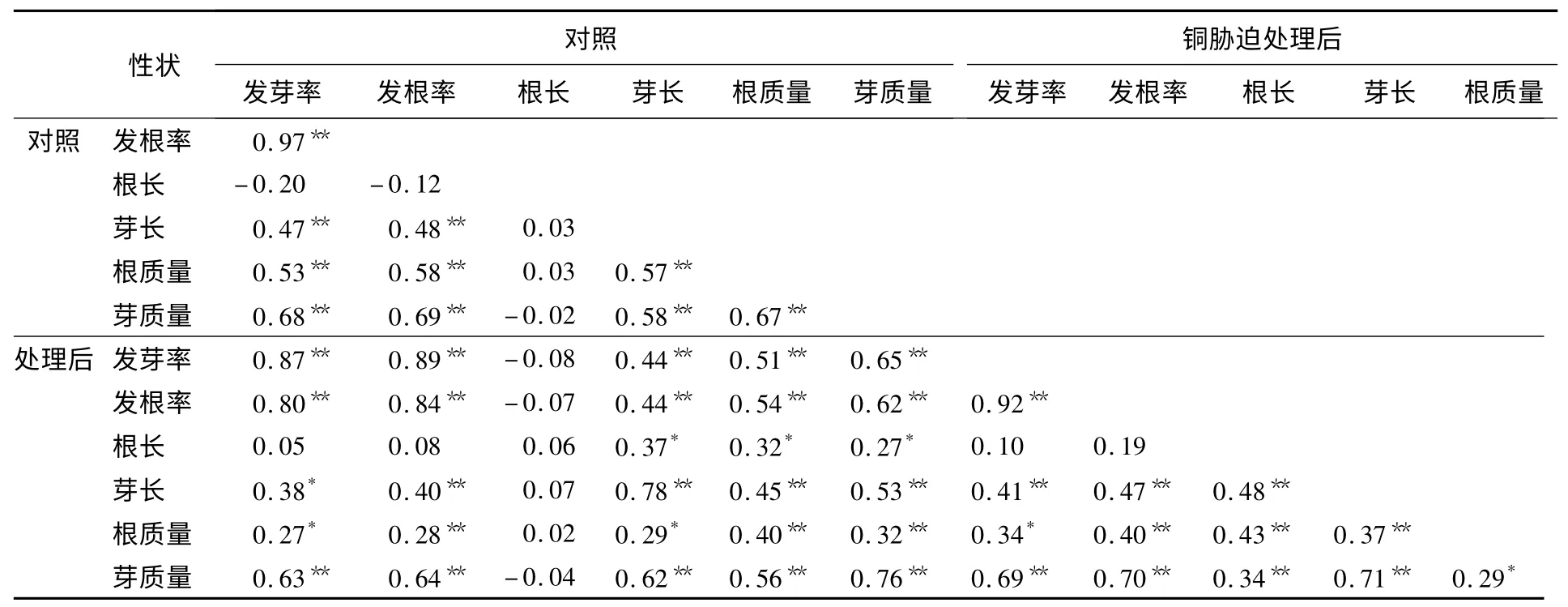
表3 DH 群体中水稻萌发期各性状的相关性分析

图1 CJ06/TN1 DH 群体水稻萌发期相关性状的QTL 定位图谱

表4 DH 群体中水稻萌发期相关性状的QTL 定位
在用灭菌水处理种子后检测到的22 个QTLs中,与发芽率、发根率、根长、芽长、根质量和芽质量相关的QTL 分别有3,3,1,4,3 和8 个,它们分别位于除4,11 和12 染色体之外的所有染色体上,其检出限介于2.52~4.30,可以解释性状变异的8.00%~15.70%.在这些QTL 中,与发芽率相关的QTL 有3 个,位于1,2 和3 染色体上,与发根率检测到的QTL 区间重合,说明水稻种子发芽与发根是紧密相关的,受同一类QTL 控制.在7 染色体上检测到1 个与根长相关的QTL.而与芽长相关的QTL 有4 个,分别位于1,3,7 和10 染色体上,其中有3 个增效等位基因来自于TN1,1 个来自于CJ06,这可以间接解释TN1 的芽长比CJ06长的原因.另外,检测到3 个与根质量有关的QTL,其中在5 染色体上有一个检出限达到了4.30,可解释性状变异的15.70%.检测到与芽质量有关的QTL 有8 个,其检出限介于2.74~4.24之间,可解释性状变异的8.00%~15.20%,其QTL 大部分都和发芽率、发根率、根长、芽长、根质量的QTL 区间重合,这也充分说明水稻萌发期各类性状的调控都存在着相互联系.
用100 μmol/L CuSO4溶液处理种子后检测到6 个萌发期相关性状的QTL,分布在1,2 和7染色体上,其中发芽率与发根率具有重合的QTL区间,进一步说明了发芽率与发根率存在着密切的关系.但没有检测到根长与根质量的相关QTL.而芽长与芽质量相关性状,不管是经过100 μmol/L CuSO4溶液处理后,还是没有经过CuSO4溶液处理,在2 染色体上的RM526-RM525 区间与7 染色体上的RM505-RM234 区间都检测到了相关QTL,说明2 个QTL 区间对芽长与芽质量的调控是密切相关的,且对铜胁迫有一定的耐性.
对水稻萌发期100 μmol/L CuSO4溶液处理后各性状的抑制程度进行QTL 分析,发根率、根长、芽长、根质量和芽质量均没有检测到相关的QTL,只有发芽率的抑制程度在3 染色体上RM282-RM6266 区间检测到1 个QTL,该增效基因来自于TN1,可解释表型变异的12.10%.
3 讨论
目前,对于水稻萌发期耐铜胁迫的研究相对较少,也没有明确的耐铜胁迫基因的相关报道.应用铜胁迫实验进行群体的耐铜性遗传研究,选择适当的培养方式和合适的铜胁迫浓度是实验成败的关键[24].本实验利用不同浓度的硫酸铜溶液对DH 群体的双亲进行处理,发现在100 μmol/L CuSO4溶液处理下,双亲萌发期的各种性状差异较为显著;之后,用该浓度铜胁迫处理整个群体,同时用灭菌水处理作为对照,进行QTL 作图;最后,将100 μmol/L CuSO4溶液处理下各种性状的值和用灭菌水处理下对应性状的值的比值作为一种抑制程度的指标进行QTL 分析.在检测到的QTLs 中,大部分是在灭菌水处理下检测到的,用100 μmol/L CuSO4溶液处理后共检测到萌发期相关性状的6 个QTLs,而抑制程度共检测到1 个QTL,这可能是由于经过铜处理后普遍抑制了控制各性状的QTLs 的作用,且其抑制程度相当,消除了个别QTL 的主效作用.其中在1 染色体上RM104-RM1067 区间和2 染色体RM526-RM525区间检测到了芽质量的QTL 与灭菌水处理下检测到的芽质量QTL 区间一致,说明在这两区间内存在着控制芽质量的主效QTL,不受CuSO4溶液处理的影响,证明这两位点对铜胁迫有很好的耐性.同样,发芽率和发根率2 个性状在CuSO4溶液处理前后都能在2 染色体的RM145-RM521 区间上检测到相应的QTL,证明这个区间内也存在着对铜胁迫有很好耐性的位点.
对比其他学者的研究结果,有些耐铜胁迫的区间与本实验检测到的区间有重叠.姚盟成等[25]利用栽培稻优良品种“特青”与普通野生稻“元江普野”构建的DH 群体139 个家系构建连锁图谱,用硫酸铜(150 mg/L)胁迫处理2 叶期的水稻苗,在水稻2 染色体RM318 标记处检测到了耐铜胁迫的QTL,与本实验检测到的耐铜胁迫的区间类似.同时,藏金萍[26]以伊朗粳稻品种Binam 为供体,以籼稻品种特青为轮回亲本,构建了BC2F8定位群体,并在水稻3 染色体上定位到了耐盐的QTL(QRkc3),该区间在本实验检测到的耐铜胁迫的区间附近,说明在水稻2 染色体RM526-RM525 区间周围存在一个主效的位点,对高浓度的金属胁迫有一定的耐性,由于所用的亲本品种和考察的性状不一致而导致了区间略有偏移.另外,在3 染色体上检测到关于发芽率抑制程度的QTL 区间RM282-RM6266 以前未曾见报到;CuSO4溶液处理下,在7 染色体上检测到关于芽长的QTL 区间RM505-RM234 与前人的研究区间也不重叠.
整体上看,CuSO4溶液处理后检测到一些耐铜的QTL,但QTL 与环境互作是影响数量性状表达的重要因素[27],要从遗传上改良水稻品种的耐铜性并非易事,通过常规有性杂交技术难于将这些分散的有利基因集中起来.下一步我们将通过分子标记辅助选育技术,构建关于这几个耐铜胁迫位点的单片段置换系,以期为选育抗性品种提供耐铜胁迫的基因.
[1]Holmgren G G S,Meyer M W,Cahney R L,et al.Cadmium,lead,zinc,copper and nickel in agricultural soils of the United States of America[J].Journal of Environmental Quality,1993,22(2):335-348.
[2]张秀梅,唐以剑,章申.白洋淀地区土壤-植物系统污染物含量与变化规律研究[J].地理科学进展,1997,16(2):62-69.
[3]Xu Jiakuan,Yang Lianxin,Wang Ziqiang,et al.Toxicity of copper on rice growth and accumulation of copper in rice grain in copper contaminated soil[J].Chemosphere,2006,62(4):602-607.
[4]李海华,刘建武,李树人,等.土壤-植物系统中重金属污染及作物富集研究进展[J].河南农业大学学报,2000,34(1):30-34.
[5]Ouzounidou G.Copper-induced changes on growth,methal content and photosynthetic function of Alyssum montanum L.plants[J].Environment Experiment Botany,1994,34(2):165-172.
[6]Nagalakshmi N,Prasad M N V.Copper-induced oxidative stress in Scenedesmus bijugatus:protective role of free radical scavenger[J].Bull Environ Contam Toxical,1998,61(5):623-628.
[7]江行玉,赵可夫.植物重金属伤害及其抗性机理[J].应用与环境生物学报,2001,7(1):92-99.
[8]袁玲花,徐加宽,颜士敏,等.土壤铜胁迫对不同籼型水稻品种产量和品质的影响[J].农业环境科学学报,2008,27(2):435-441.
[9]丁园,宗良纲.不同土壤重金属复合污染有效态离子冲量表征[J].环境污染与防治,2003,25(3):173-175.
[10]宋玉芳,许华夏,任丽萍,等.重金属对西红柿种子发芽与根伸长的抑制效应[J].中国环境科学,2001,21(5):390-394.
[11]罗亚平,刘杰,蔡湘文,等.铜对水稻种子萌发和生长的影响[J].广西农业科学,2005,36(4):316-318.
[12]胡筑兵,陈亚华,王桂萍,等.铜胁迫对玉米幼苗生长、叶绿素荧光参数和抗氧化酶活性的影响[J].植物学通报,2006,23(2):129-137.
[13]崔德杰,张玉龙.土壤重金属污染现状与修复技术研究进展[J].土壤通报,2004,35(3):366-370.
[14]徐加宽,杨连新,王志强,等.土壤铜胁迫对水稻磷素吸收利用及产量的影响[J].江苏农业科学,2008,35(2):213-217.
[15]邵登辉,储玲.铜胁迫下氮肥对水稻幼苗生长的影响[J].南京晓庄学院学报,2008(3):59-63.
[16]Hiroki I,Tomoko K,Hiroshi K,et al.Copper elicits an increase in cytosolic free calcium in cultured tobacco cells[J].Plant Physiology and Biochemistry,2005,43(12):1089-1094.
[17]王狄,李锋民,熊治廷,等.铜的植物毒性与植物蓄积的关系[J].土壤与环境,2000,9(2):146-148.
[18]徐加宽,杨连新,王余龙,等.水稻对重金属元素的吸收与分配机理的研究进展[J].植物学通报,2005,22(5):614-622.
[19]Tomar R P S,Singh B P,Chaudhary B S.Effect of modes application of growth regulators on wheat[J].Indian J Agr Res,1977,5:41-44.
[20]Zeng Dali,Hu Jiang,Dong Guojun,et al.Quantitative trait loci mapping of flaf-leaf ligule length in rice and alignment with ZmLG1 gene[J].JIPB,2009,51(4):360-366.
[21]Rao Yuchun,Dong Guojun,Zeng Dali,et al.Genetic analysis of leaffolder resistance in rice[J].Genet Genomics,2010,37(5):325-331.
[22]Khush G S.Prospects of and approaches to increasing the genetic yield potential of rice[M]//Evenson R E,Herdt R W,Hossain M.Rice research in Asia:progress and priorities.Wallingford:CAB International,1996:57-71.
[23]McCouch S R,Cho Y G,Yano M,et al.Report on QTL nomenclature[J].Rice Genet Newsl,1997,14(11):11-131.
[24]沈圣泉,庄杰云,舒庆尧,等.水稻苗期耐高Cu2+胁迫的QTL 定位和上位性分析[J].植物营养与肥料学报,2006,12(3):352-357.
[25]姚盟成,张文会,张晓杰,等.水稻苗期耐Cu2+胁迫QTL 遗传分析[J].广西农业科学,2009,40(9):1119-1123.
[26]藏金萍.水稻抗旱、耐盐QTL 表达的遗传背景效应及抗旱、耐盐的遗传重叠研究[D].北京:中国农业科学院,2008:17-18.
[27]樊叶杨,庄杰云,李强,等.水稻株高QTL 分析及其与产量QTL 的关系[J].作物学报,2001,27(6):915-922.

