微波辅助提取苦瓜总皂苷工艺条件优化
唐彦君,田雪娇,王桂华
(1.黑龙江八一农垦大学食品学院,大庆163319;2.黑龙江八一农垦大学生命技术学院)
苦瓜又称凉瓜、锦荔枝,原产亚洲热带地区,现广泛栽培于世界热带至亚热带地区,在我国南北方均有种植。苦瓜果实性味苦寒,具有清热解凉、滋养强壮之功效,素有“药用蔬菜”之称。许多研究表明,皂苷具有防止心血管疾病和降胆固醇、提高机体免疫力、抗肿瘤、抗菌消炎[1]及降低血糖[2-3]等多方面的功能,其综合利用经济价值已逐渐引起人们的重视。现在从苦瓜中提取总皂苷常见的方法有水浴振荡法、回流法、超临界CO2萃取法[4]、超高压法[5]、超声波[6]等。这些方法存在得率低、提取时间长、能耗大等不足。微波辅助萃取法是使用合适的有机溶剂,在微波辐射处理条件下从天然植物、矿物、动物组织内提取各种化学成分的方法[7-8]。该方法具有选择性高、重现性好、萃取率高、省时、设备简单、适用范围广、污染小等优点。基于以上问题,实验采用微波辅助萃取法提取苦瓜中的皂苷,以期实现对苦瓜皂苷进行快速、高效、可靠提取,为苦瓜的进一步开发利用提供一定参考。
1 材料与方法
1.1 材料与试剂
苦瓜:市场购买,要求新鲜且无病虫害;人参皂苷Rg1 对照品:中国药品生物制品检定所;乙醇、香草醛、冰醋酸、5%香草醛-冰乙酸溶液,高氯酸等,均为分析纯试剂。
1.2 仪器与设备
722 分光光度计(上海精密科学仪器有限公司);MM-2270MG 型微波炉(青岛海尔微波炉制品有限公司);DK-S12 型电热恒温水浴锅(上海森信实验仪器有限公司);TD4A 型离心机(长沙英泰仪器有限公司);电子天平(北京医用天平厂制造)。
1.3 实验方法
1.3.1 总皂苷含量测定方法
1.3.1.1 标准曲线绘制
精密量取干燥至恒重的人参皂苷Rg1 标准品5 mg,加乙醇溶解定容至50 mL 摇匀,作为标准品溶液。分别精确吸取标准品溶液50、100、150、200、250 μL 于具塞试管中,水浴挥发去溶剂,加入新配制的5%香草醛-冰乙酸溶液0.20 mL,高氯酸0.80 mL,在60 ℃水浴中加热15 min,流水冷却,加冰醋酸5 mL 摇匀,放置20 min,在波长550 nm 处测定吸光度,乙醇溶液随行空白对照。以人参皂苷Rg1 质量为横坐标,吸光度为纵坐标,绘制标准曲线。
1.3.1.2 总皂苷含量测定
称取一定量的鲜苦瓜,低温干燥后粉碎,过40 目筛,得到苦瓜粉。称取2.0 g 干燥苦瓜粉4 份,置于4个250 mL 的锥形瓶中,然后向其中加入一定体积、不同体积分数的乙醇溶液,摇匀。经360 W 微波处理后,在不同的温度下,浸泡一定的时间,冷却后离心,将上清液转移至50 mL 容量瓶,定容,作为测定液。精量各测定液100 μL 于20 mL 具塞试管中,加入新配制的5%香草醛-冰乙酸溶液0.20 L,高氯酸0.80 mL,在60 ℃水浴中加热15 min,流水冷却,加冰醋酸5 mL摇匀,放置20 min,在550 nm 波长处测吸光度,将结果带入回归方程,并由下式计算样品中总皂苷含量。
总皂苷得率(%)=(0.1·X·V1/1 000·M·V2)×100%
0.1 :人参皂甙标品质量浓度(mg·mL-1)
X:标准曲线计算得到苦瓜皂苷质量(μg)
V1:为定容体积(mL)
V2:实际待测液取样量(μL)
M:苦瓜粉质量(g)
1.3.2 单因素与正交实验
1.3.2.1 乙醇体积分数对苦瓜总皂苷得率的影响
称取2.0 g 干燥苦瓜粉4 份,置于4 个250 mL的锥形瓶中,然后向其中加入体积分数分别为60%、70%、80%、90%的乙醇溶液20 mL,摇匀,经微波处理后,在温度为60 ℃时浸泡0.5 h,制得测定液,按
1.3.1.2 中测定液的操作步骤进行操作。确定皂苷提取的最佳乙醇浓度。
1.3.2.2 微波处理时间对苦瓜总皂苷得率的影响
称取2.0 g 干燥苦瓜粉4 份,置于4 个250 mL的锥形瓶中,然后向其中加入质量分数为70%的乙醇溶液20 mL 摇匀,经微波处理时间分别为5、10、15、20 min 后,在温度为60 ℃时浸泡0.5 h,制得测定液,按1.3.1.2 中测定液的操作步骤进行操作。 确定皂苷提取的最佳微波时间。
1.3.2.3 温度对苦瓜总皂苷得率的影响
称取2.0 g 干燥苦瓜粉4 份,置于4 个250 mL的锥形瓶中,然后向其中加入体积分数为70%的乙醇溶液20 mL,摇匀,经微波处理后,分别在60、70、80、90 ℃下浸泡0.5 h,制得测定液,按1.3.1.2 中测定液的操作步骤进行操作。确定皂苷提取的最佳温度。
1.3.2.4 料液比对苦瓜总皂苷得率的影响
称取2.0 g 干燥苦瓜粉4 份,置于4 个250 mL的锥形瓶中,然后向其中加入体积分数为70%的乙醇溶液,料液比(W∶V)分别为1∶10、1∶20、1∶30、1∶40 摇匀,经微波处理后,在温度为60 ℃时,浸泡0.5 h,制得测定液,按1.3.1.2 中测定液的操作步骤进行操作。确定皂苷提取的最佳料液比。
1.3.2.5 依据单因素实验得到的最佳提取条件,进行正交试验,确定提取最佳工艺参数组合。
2 结果与分析
2.1 标准曲线回归方程
按照1.3.1.1 中方法进行操作,以人参皂苷Rg1浓度为X,吸光度为Y,得回归方程:A=0.005 8X-0.045 4,R2=0.999 8。
2.2 乙醇体积分数对提取效果的影响

图1 乙醇浓度对提取效果的影响Fig.1 Effect of ethanol concentration on TS yield
从图1 可以看出,随着乙醇浓度的增加,皂苷得率呈先升高后下降趋势,在乙醇浓度为80%时,皂苷得率最高;因此,认为乙醇最佳提取浓度为80%。
2.3 微波时间对苦瓜总皂苷得率的影响
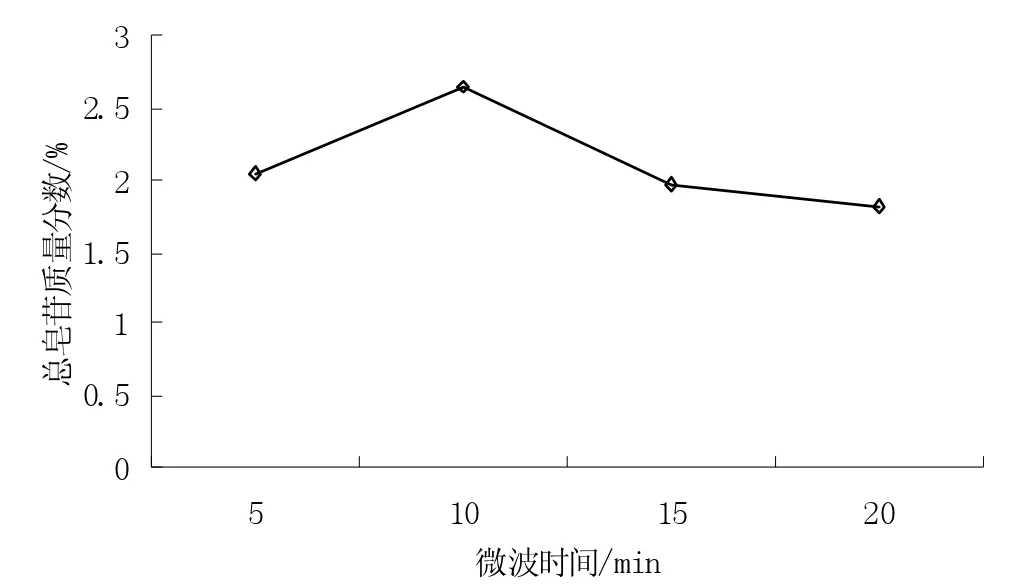
图2 微波时间对提取效果的影响Fig.2 Effect of microwave time on TS yield
从图2 可知,随着微波时间的增加,皂苷得率呈先增加后减少趋势,当微波时间为10 min 时,皂苷得率最高。因此,综合可操作性和实验条件的有限性,认为微波辅助提取的最佳时间为10 min。
2.4 温度对苦瓜总皂苷得率的影响
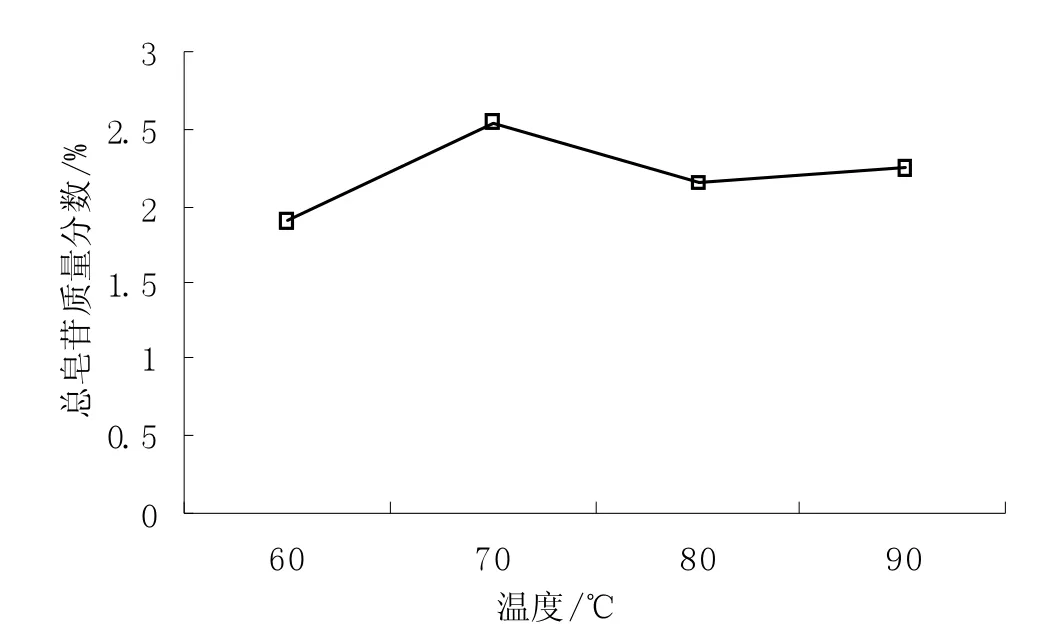
图3 温度对提取效果的影响Fig.3 Effect of temperature on TS yield
从图3 可以看出,当温度达到70 ℃时,皂苷得率最高,当温度再继续升高皂苷得率呈下降趋势。因为提取温度越低,耗能越少,有效成分不会被破坏;随着温度的升高,大分子物质溶出,造成提取液颜色变深,一些活性成分被破坏;因此,综合可操作性和实验成本,认为70 ℃为最佳提取温度。
2.5 料液比对苦瓜总皂苷得率的影响
从图4 可以看出,不同料液比对苦瓜皂苷得率的影响有差异,随着乙醇的增加,皂苷得率增加,当乙醇加入40 mL 后,苦瓜皂苷得率基本不再变化,因此,认为最佳料液比为1∶20。

图4 料液比对提取效果的影响Fig.4 Effect of material-to-liquid ration on TS yield
2.6 正交试验
2.6.1 因素及水平的考察在单因素试验基础上进行正交试验。所选因素水平见表1,因素组合见表2。2.6.2 正交试验结果
称取2.0 g 干燥苦瓜粉,置于250 mL 的锥形瓶中,按正交试验表进行因素水平进行处理,测吸光度值,计算得率。所得结果见表2。

表1 正交试验因素水平表Table 1 Factors and levels in orthogonal array design
以苦瓜总皂苷得率为考察指标,确定最佳提取方案为A2B2C3D2,即水浴温度70 ℃、微波时间10 min、乙醇体积分数80%、料液比1∶20。各因素对提取工艺影响的主次顺序为C>D>A>B。

表2 正交试验结果Table 2 Orthogonal array design arrangement and corresponding results
2.6.3 验证实验
因正交实验确定的工艺组合不在实验之中,按该工艺条件进行验证,重复提取3 次,测得苦瓜皂苷平均得率为3.6%,表明本实验优选的工艺稳定可靠。
3 结论
在单因素实验基础上,通过正交试验优化苦瓜总皂苷的提取方法以苦瓜总皂苷得率量作为主要评价指标,得出各因素对提取效果影响的主次顺序依次为乙醇体积分数>料液比>温度>微波时间。通过极差分析可知,乙醇分体积数对苦瓜总皂苷含量影响显著,苦瓜总皂苷微波提取的最佳工艺条件为乙醇体积分数80%,微波时间10 min,温度70 ℃,料液比1∶20,在此条件下所得的苦瓜总皂苷得率3.6%。实验为开发和利用苦瓜皂苷提供了一定参考。
[1] 李健,张令文.苦瓜皂甙的研究进展[J].食品研究与开发,2005,26(3):21-24.
[2] 李文仙,周一萍,林玲,等.苦瓜皂苷对小鼠血糖代谢的影响[J].中国食品添加剂,2010,10(3):121-123.
[3] 何庆峰,尤玲玲,吴海清,等. 苦瓜茎皂苷的提取及降糖活性研究[J].中国食品添加剂,2011,6(12):121-123.
[4] 陈勋,于海宁,唐德松,等.苦瓜皂苷快速分离纯化方法研究[J].食品科学,2004,25(2):114-117.
[5] 田力东,张名位,郭祀远,等.苦瓜皂甙的提取工艺优化研究[J]. 现代食品科技,2007,23(1):40-44.
[6] 刘园园,高玉荣,田季.超声波辅助提取玉米红曲色素的工艺研究[J]. 黑龙江八一农垦大学学报,2012,24(5):65-67.
[7] Huang J,Zhanxia Z. Microwave-assisted extraction of quercetin and acid degradation of its glycosides in Psidium guajava leaves[J]. Analytical Sciences,2004,20(2):395-397.
[8] J.Parera,F.J.Santos,M.T.Galceran. Microwave -assisted extraction versus Soxhlet extraction for the analysis of short-chain chlorinated alkanes in sediments [J]. Journal of Chromatography A,2004,1046:19-26.

