海藻酸钙固定化At. ferrooxidans 的研究
张爽,陈志宝,晏磊,马星辰,赵丹
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
At. ferrooxidans 是一种以Fe2+或低价态硫作为能源生长、革兰氏染色阴性、端生鞭毛具运动性的化能自养菌[1-2]。固定化At. ferrooxidans 在酸性矿坑废水和H2S 等废气的治理中具有广泛的应用[3]。由于游离At. ferrooxidans 在废气处理中存在损失量大、气体处理量小等缺点,目前主要开发固定化At. ferrooxidans用于H2S 的脱除和Fe2+的再生。因此,研究At. ferrooxidans 的固定化对于H2S 的处理工艺至关重要。海藻酸钠具有价格低廉,对细胞毒性相对较小,固定化容易成形,传质性能好,性质稳定,且对微生物细胞的富集程度高等优点,而成为目前应用最广的包埋剂之一[4]。
实验以At. ferrooxidans 为包埋对象,以海藻酸钠为包埋载体,CaCl2为交联剂,制备海藻酸钠固定化凝胶珠。考察了海藻酸钠浓度、氯化钙浓度、硝酸钙浓度及细胞数量对Fe2+氧化率的影响,并确定最佳固定化条件。
1 材料
1.1 实验材料
1.1.1 菌种
At. ferrooxidans ATCC23270。
1.1.2 培养基
0 K 液体培养基[5]:(NH4)2SO43.0 g,KCl 0.1 g,K2HPO40.5 g,MgSO4·7H2O 0.5 g,Ca(NO3)20.01 g,蒸馏水1 000 mL,调pH 至1.8,121 ℃灭菌15 min。
9 K 液体培养基[5-6]:0 K 液体培养基内加入经过滤除菌的FeSO4·7H2O(调整pH 至1.8),使Fe2+终浓度为8.9 g·L-1。
1.1.3 主要试剂和仪器
海藻酸钠(化学纯,温州市东升化工试剂厂);Ca(NO3)2(分析纯,沈阳市华东试剂厂);CaCl2(分析纯,沈阳市华东试剂厂)。
PHSJ-3F 型实验室pH 计(上海雷磁仪器厂);KD-S14 电热恒温水浴锅(上海森信实验仪器有限公司);HZQ-C 空气浴振荡器(哈尔滨东联电子技术开发有限公司)。
2 方法
2.1 细胞培养
将培养好的At. ferrooxidans,按10%接种量分别接种到5 份盛有9 K 培养基的三角瓶中,恒温30 ℃空气震荡培养48~72 h(150 rpm)。所得培养液1 500 rpm 离心5 min,弃去沉淀,上清液12 000 rpm离心15 min,收集细胞。去离子水溶解细胞,制得细胞悬液。
2.2 细胞固定化
将配制好的一定浓度的海藻酸钠40 mL 煮沸20 min,冷却至30 ℃。加入一定浓度的细胞悬液,充分搅拌,待菌株与海藻酸钠充分混合后,静置30 min。在10 cm 高处,用9 号针头将海藻酸钠和At. ferrooxidans 的混合液,逐滴匀速滴入到一定浓度的交联剂中,固定2 h,双层纱布过滤,弃液体。pH 2.0稀硫酸反复冲洗5 次,转至含新鲜配制的9 K 培养基中,恒温30 ℃空气震荡培养72 h(150 rpm),测定Fe2+氧化率。
2.3 细胞固定化影响因素分析
2.3.1 交联剂种类及浓度对细胞固定化的影响
交联剂选用Ca(NO3)2,设置2%、3%、4%、5%、6%五个浓度,按上述方法制备At. ferrooxidans 固定化细胞并测定其对Fe2+的氧化。交联剂选用CaCl2,设置2%、3%、4%、5%、6%5 个浓度,按上述方法制备At. ferrooxidans 固定化细胞并测定其对Fe2+的氧化。
2.3.2 海藻酸钠浓度对细胞固定化的影响
分别配制浓度为1%、1.5%、2.0%、2.5%、3.0%的海藻酸钠,按上述方法制备At. ferrooxidans 固定化细胞并测定其对Fe2+的氧化。
2.3.3 At. ferrooxidans 细胞浓度对细胞固定化的影响At. ferrooxidans 细胞浓度分别设置为3×108、6×108、9×108、1.2×109及1.5×109cell·mL-1,按上述方法制备At. ferrooxidans 固定化细胞并测定其对Fe2+的氧化。
2.4 Fe2+氧化率测定
Fe2+浓度的测定采用重铬酸钾滴定法[7]。
3 结果与讨论
3.1 交联剂种类及浓度
Ca(NO3)2和CaCl2是两种常用交联剂,为了探讨其对At.ferrooxidans 固定化效果,分别选取不同浓度的Ca(NO3)2和CaCl2作为交联剂,制成At. ferrooxidans固定化细胞,以其对Fe2+的氧化率作为检测指标,结果见图1。由图1 可知,随着交联剂浓度的增加,Fe2+的氧化率逐渐减小,实验中我们发现,以Ca(NO3)2为交联剂制成的凝胶珠坚硬,机械力强。CaCl2的浓度大于2%时,制成的凝胶珠过于紧实,使底物和产物的扩散相对困难。
相同浓度的CaCl2与Ca(NO3)2作交联剂时,制得的凝胶珠形状均较好,且机械力强,但以前者为交联剂制得的凝胶珠对Fe2+的氧化率远大于后者。因此,后续的实验中选用的交联剂为2%的CaCl2。
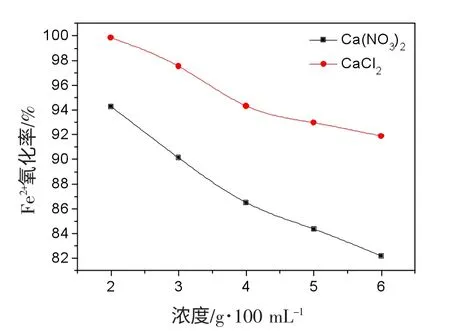
图1 不同浓度Ca(NO3)2 和CaCl2 对Fe2+氧化率的影响Fig.1 The effect of calcium nitrate and calcium chloride with different concentrates of oxidize rate for Fe2+
3.2 海藻酸钠浓度
选取CaCl2浓度为2%,细胞浓度为1×109,海藻酸钠浓度分别为1.0%、1.5%、2.0%、2.5%、3.0%进行细胞固定化实验。通过海藻酸钠浓度的改变,观察其对Fe2+的氧化情况,结果见图2。由图2 可知,2.5%的海藻酸钠对Fe2+的氧化率最高。实验发现,当海藻酸钠浓度低于2%时,制得的凝胶珠形状不规则,且较松软,机械强度低,所包含的细胞数目较少;随着海藻酸钠浓度的升高,制得的凝胶珠形状成规则的圆球状,但随着海藻酸钠浓度的增加,使得溶液粘度增加,导致针头堵塞,凝胶珠形成困难。海藻酸钠的浓度为2.5%时,形成的凝胶珠大小均匀,对Fe2+的氧化效果较好。
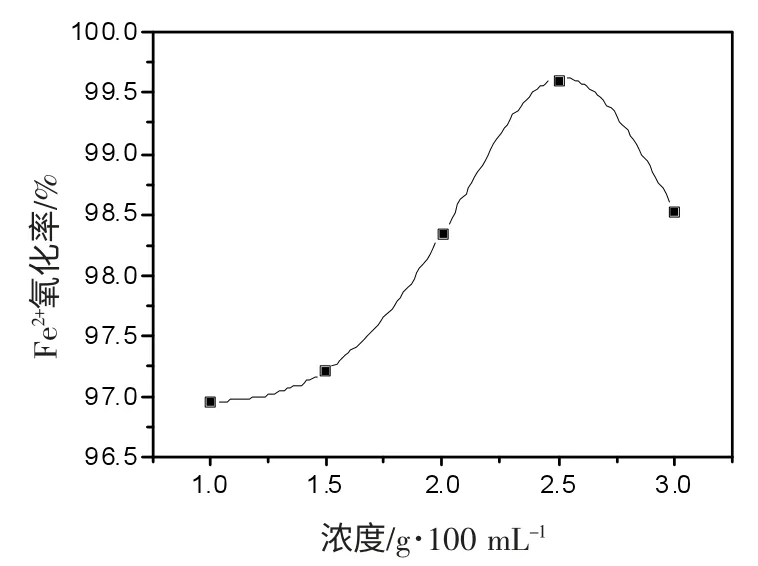
图2 海藻酸钠浓度对Fe2+氧化率的影响Fig.2 The effect of sodium alginate concentrate of oxidize rate for Fe2+
3.3 At. ferrooxidanscells 细胞浓度
取浓度为2%的CaCl2,海藻酸钠浓度为2.5%,细胞 终 浓 度 分 别 为3×108、6×108、9×108、1.2×109、1.5×109,进行细胞固定化实验。通过调整细胞终浓度,研究其对Fe2+的氧化率的影响,结果见图3。由图可知,细胞浓度为1.2×109时,Fe2+的氧化效果最好。随着细胞浓度的增加,Fe2+的氧化率呈先升高后降低的趋势,其主要原因是海藻酸钠对细胞的包埋具有饱和性,当细胞浓度超过1.2×109时,海藻酸钠包埋的细胞制得的凝胶珠传质及传氧性变差。
4 结论
海藻酸钠- 氯化钙能较好的固定At. ferrooxidanscells 菌株,最佳固定化条件为:CaCl2浓 度 为 2% , 海 藻 酸 钠 浓 度 为 2.5% ,At. ferrooxidanscells 细胞浓度为1.2×109cell·mL-1,对Fe2+的氧化率分别为99.83%、99.62%、99.42%。该方法制得的凝胶珠性质稳定,机械强度好,具有较好的工业应用前景。
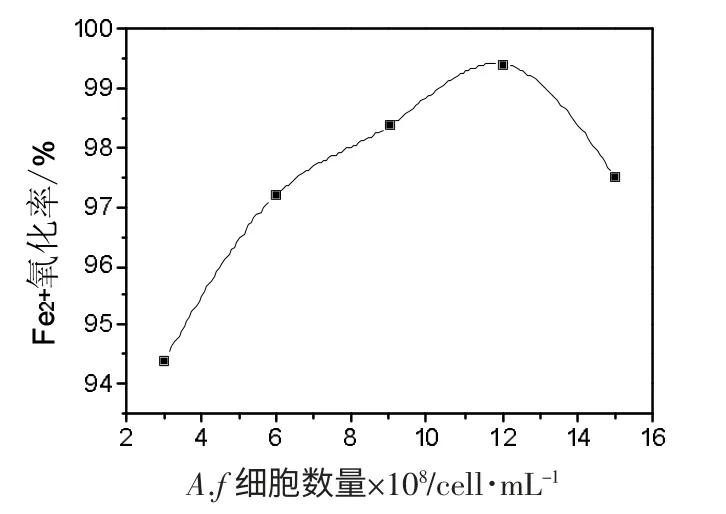
图3 A.f 细胞数量对Fe2+氧化率的影响Fig.3 The effect of cell concentrate for the oxidize rate of Fe2+
[1] Lei Yan, Huan -huan Yin, Shuang Zhang, et al.Organoarsenic resistance and bioremoval of Acidithiobacillus ferrooxidans [J]. Bioresour Technol,2010,101(16):6572-5657.
[2] 李师翁,王玉建,涂玮,等. PVA-Ca(NO3)2法固定化氧化亚铁硫杆菌对Fe2+的氧化及动力学研究[J].环境污染与防治,2007,29(1):14-17.
[3] 王玉建,李红玉. PVA-Ca(NO3)2法包埋固定氧化亚铁硫杆菌研究[J].微生物学报,2006,46(3):456-459.
[4] 包木太,田艳敏,陈庆国. 海藻酸钠包埋固定化微生物处理含油废水研究[J]. 环境科学与技术,2012,35(2):167-172.
[5] Lei Yan,Huan -huan Yin,Shuang Zhang,et al.Biosorption of inorganic and organic arsenic from aqueous solution by Acidithiobacillus ferrooxidans BY-3 [J]. J Hazard Mater,2010,178(1): 209-217.
[6] 晏磊,张爽,李雪,等. 氧化亚铁硫杆菌的磁性及铁源种类对磁小体合成的影响[J].黑龙江八一农垦大学学报,2012,24(1):23-27.
[7] 黄运显,孙维贞.常见元素化学分析方法[M]. 北京:化学工业出版社,2008.

