辐射对巨噬细胞系RAW264.7基质金属蛋白酶-9表达的影响
周 勇 王 科 何忠时 吴 峰 杨 勇
有研究认为,巨噬细胞和肺泡上皮细胞分泌的促炎和促纤维化细胞因子,在放射性肺损伤的发生发展中起着重要的作用[1],它们之间的相互作用和影响促使了放射性肺损伤的发生和发展。其中巨噬细胞的作用尤为重要[2],文献研究发现肺组织基膜的损害、修复和结构重塑是放射性肺损伤的基本病理改变,而基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)除了在细胞外基质降解、更新和维持基膜的完整性中起主要作用外,还可以促进细胞迁移,调节多种细胞因子的活性。在放射性肺损伤动物模型中,有研究认为小鼠肺组织中 MMP-2、MMP-9表达显著增强[3],因此,我们认为电离辐射可能会诱导巨噬细胞MMP-9的合成,从而与促炎性细胞因子或促纤维化细胞因子相互作用,参与了放射性肺损伤的发生,针对该靶点的治疗可能成为放射性肺损伤的有效治疗手段之一。
1 材料与方法
1.1 细胞培养
小鼠巨噬细胞系RAW264.7(Mouse macrophage cell line RAW264.7)购于武汉大学中国典型培养物保藏中心。含10% 热灭活胎牛血清、100 U/ml青霉素+100 U/ml链霉素的 DMEM高糖培养基,于37℃、5%CO2培养箱中培养,以1×106个/ml密度接种到新的35 mm培养皿(Coring)中进行培养。
1.2 实验试剂
逆转录试剂盒(SYBR Green realtime PCR master mix-plus)购自TOYOBO公司;兔抗MMP-9多克隆抗体购自Santa Cruz公司(H-129;兔抗TIMP-1多克隆抗体购自Bioworld Technology公司(G-94);HRP标记的羊抗兔IgG抗体购自美国Pierce公司。
1.3 细胞照射
传代细胞培养24 h后,换为不含胎牛血清的培养基继续培养24 h,使细胞周期同步化,置于武汉大学中南医院放化疗科60Co治疗机下进行细胞照射,并立即放回细胞培养箱中,按实验预定的不同时间收集细胞总RNA和总蛋白。照射参数:60Co射线,SSD=80 cm,剂量率为1.389 cGy/s。
1.4 RT-PCR检测MMP-9表达
TRIZOL Reagent法提取细胞总RNA。PCR引物由上海生物工程技术服务有限公司合成,引物序列见表1,按试剂盒说明书进行逆转录,制成cDNA,实时荧光定量反应条件:95℃ 120 s;95℃ 15 s;58℃ 15 s;72℃ 45 s;40个循环。
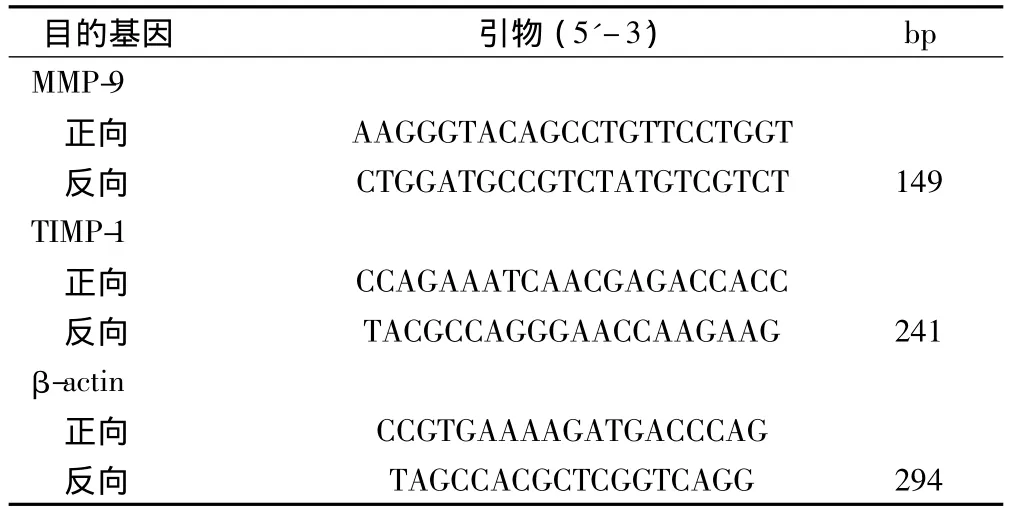
表1 引物序列表
1.5 Western-blotting法检测蛋白表达
提取细胞总蛋白,加入等量的2XSDS上样缓冲液,100℃变性3 min。根据样品蛋白浓度,取40 μg蛋白质样品进行SDS-PAGE电泳,并转移至硝酸纤维素膜,5%脱脂奶室温封闭1 h,加入MMP-9多克隆抗体(1∶200),4℃孵育过夜,漂洗后加入相应的辣根过氧化物酶标记的二抗(1∶3 000),室温2 h,温和振荡。TBS/T振荡清洗10 min×3次。至暗房,加ECL显色液作用3 min,感光、洗片。根据Marker判断显像蛋白大小。
1.6 统计学处理
2 结果
2.1 不同剂量γ射线照射后各组细胞MMP-9 mRNA表达情况
不同剂量 γ 射线(0、5、10、20 Gy)照射细胞 6、12、24、48 h后,行实时荧光定量PCR检测MMP-9 mRNA的表达情况见图1。①不同剂量照射后照射6 h组与对照组比较,MMP-9基因表达均明显增强(P<0.05),其中以10 Gy表达最强,为对照组的(3.46±0.45)倍;②照射12 h组较6 h组基因表达水平稍有下降,但仍高于同期对照组(P<0.05),组与组之间比较均有统计学差异(P<0.05),以10 Gy表达最强;③照射24 h后基因表达水平达到峰值,组与组之间比较均有统计学差异(P<0.05),其中照射剂量为10 Gy时基因表达水平是对照组的(4.75±0.14)倍;④照射48 h组基因表达水平较前有所下降,但仍高于同期对照组(P<0.05)。上述结果可以看出照射剂量为10 Gy时,MMP-9 mRNA表达最强,其中10 Gy照射24 h后细胞MMP-9基因表达水平达到最高值。

图1 不同剂量γ射线照射巨噬细胞系RAW264.7不同时间后MMP-9 mRNA表达情况
2.2 10Gyγ-射线照射后各组细胞 MMP-9蛋白表达情况
10 Gy γ-射线照射细胞 6、12、24、48 h 后,Western blotting检测MMP-9蛋白表达情况见图2,照射24 h组MMP-9蛋白表达最强,表明照射24 h后MMP-9蛋白表达水平与mRNA表达水平一致。10 Gy照射细胞6、24、48 h后MMP-9蛋白表达均有所增强,与对照组比较有差异(P<0.05),其中以24 h增强最显著。

图2 10 Gy γ-射线照射细胞不同时间后MMP-9蛋白表达情况
2.3 地塞米松对电离辐射诱导MMP-9蛋白表达的影响
从上述结果可以看出,10 Gy γ-射线照射细胞24 h后MMP-9蛋白表达最显著,此时作用最强,因此,在该条件下加入地塞米松(1μM)观察其对电离辐射诱导MMP-9蛋白表达的影响。由图3可见,单纯照射24 h组MMP-9蛋白表达最强,加入地塞米松后MMP-9蛋白表达较单纯照射组明显减弱(P<0.05),说明地塞米松可以显著抑制电离辐射所诱导的MMP-9蛋白表达。

图3 地塞米松对电离辐射诱导的MMP-9蛋白表达的影响
3 讨论
放射治疗是胸部恶性肿瘤的重要治疗手段之一,但在治疗过程中,当周围正常的肺组织接受照射剂量超过一定的阈值,则可引起急性放射性肺炎和肺纤维化。在放射性肺损伤的发展变化过程中,基膜的破坏和更新与肺组织的炎症和纤维化有着密切的关系。MMP-9属于基质金属蛋白酶家族,它们的主要功能是降解细胞外基质,并参与正常组织的重塑和修复过程。其中MMP-9主要由巨噬细胞等炎细胞产生,因为它的数量最多,功能最复杂,所以它是这类家族成员的代表。细胞外基质的修复和更新必须受到严密而精确的调控,因为过多的或不恰当的MMP-9的表达或活性增强均可能导致肺组织结构的破坏,从而引起肺组织结构重塑导致相应的肺疾病,如肺泡炎和肺间质纤维化。本实验中 γ-射线作为1种有效的刺激使巨噬细胞MMP-9 mRNA和蛋白表达明显增强,这与文献报道的结果一致[4],从而导致MMP-9过表达,导致胞外基质过多降解,基膜通透性增加,促进炎性细胞和上皮细胞迁移,而聚集的炎细胞又可以产生MMP-9,如此循环而导致肺炎的发生和发展。在其他的肺炎和肺纤维化模型中,肺组织中的MMP-9也明显增加,特别是在肺纤维化早期阶段[5];临床研究发现细胞因子的表达(如TGF-β)与放射性肺损伤的发生密切相关[6]。而MMP-9除了具有降解胞外基质的功能外,还可以调节细胞因子的活性,这就使细胞因子与MMP-9之间相互作用,形成网络,炎症不断扩大,从而影响疾病的进展。在放射性肺损伤的小鼠动物模型的研究中,已发现电离辐射后小鼠肺组织中MMP-9表达增强,参与了肺损伤的发生[7]。这些都说明了MMP-9参与肺组织的炎症和重构不是偶然。
饶亚岚等[8]研究发现10 Gy γ-射线作用于小鼠巨噬细胞RAW264.7 24 h后可以观察到细胞变大,呈梭形,部分细胞伸出伪足,胞内颗粒增多,表明细胞呈被激活状态,而且还观察到照射即刻细胞内ROI(Reactive oxygen intermediate)水平开始升高,6 h到达高峰,24 h恢复正常。本实验中 γ-射线照射巨噬细胞系RAW264.7 6 h后MMP-9 mRNA和蛋白就明显表达,24 h达到高峰,MMP-9表达并不与照射剂量和照射时间呈正比,在10 Gy 24 h表达最明显,说明10 Gy对细胞作用最强,与文献报道的一致[9]。MMP-9产生与核因子κB的活化和ROS有关,并且与内源性TNF-α关系非常密切。而电离辐射可以损伤DNA,产生ROS,激活转录因子 NF-κB[9],因此,我们推测 γ-照射引起MMP-9的产生可能与以下机制有关:①γ-照射产生ROS,ROI刺激 MMP-9转录与合成;②激活 NF-ΚB;③诱导内源性TNF-α产生。照射24 h后蛋白表达最显著,这可能与内源性的TNF-α产生有关,文献认为刺激巨噬细胞后24 h才可能引起TNF-α表达且较短暂[10]。当然也有文献认为MMP-9产生与JNK和p38 MAPK等信号通路有关[11]。在临床上,皮质类固醇激素是用来治疗放射性肺损伤的主要药物。本实验中我们发现皮质类固醇激素地塞米松可以抑制MMP-9的合成。关于γ-射线是如何调节RAW264.7 MMP-9表达这一机制仍需进一步深入的研究,MMP-9在放射性肺损伤中的详细作用机制仍未完全阐明,以此为特异性靶点来阻断MMP-9表达的信号通路,从而抑制MMP-9表达,中断或干预它与细胞因子之间的相互作用,可能成为预防和治疗放射性肺损伤的重要手段之一。
[1]Rubin P,Johnston CJ,Williams JP,et al.A perpetual cascade of cytokines postirradiation leads to pulmonary fibrosis〔J〕.Int J Radiat Oncol Biol Phys ,1995,33:99.
[2]Trott KR,Herrmann T,Kasper M.Target cells in radiation pneumopathy〔J〕.Int Radiat Oncol Biol Phys,2004,58(2):463.
[3]Yang K,Palm J,Seeland U,et al.Matrix-Metallo-Proteinases and their tissue inhibitors in radiation-induced lung injury〔J〕.Int J Radiat Biol,2007,83(10):665.
[4]Osman M,Tortorella M,Londei M,et al.Expression of matrix metalloproteinases and tissue inhibitors of metalloproteinases define the migratory characteristics of human monocyte-derived dendritic cells〔J〕.Immunology,2002,105(1):73.
[5]Ji Young Kim,Hyun Cheol Choeng,Cheolmin Ahn,et al.Early and late changes of MMP-2 and MMP-9 in bleomycininduced pulmonary fibrosis〔J〕.Yonsei Med J,2009,50(1):68.
[6]钟 军,刘 珺,陈文学,等.血浆TGF-β1与放射性肺损伤的相关性研究〔J〕.实用癌症杂志,2007,22(5):468.
[7]刁瑞英,宋良文,王少霞,等.Ⅳ型胶原、MMPs和TIMPs在放射性肺损伤重建中的作用〔J〕.中华放射医学与防护杂志,2007,27(6):517.
[8]饶亚岚,丛 悦,陈肖华,等.γ-射线与LPS作用于小鼠巨噬细胞RAW264.7的生物学效应细胞〔J〕.细胞分子免疫学杂志,2008,24(9):850.
[9]Ibuki Y,Mizuno S,Goto R.Gamma-irradiation-induced DNA damage enhances NO production via NF-kappa B activation in RAW264.7 cells〔J〕.Biochim Biophys Acta,2003,1593(2-3):159.
[10]McKinney LC,Aquilla EM,Coffin D,et al.Ionizing radiation potentiates the induction of nitric oxide synthase by interferon-gamma and/or lipopolysaccharide in murine macrophage cell lines-Role of tumor necrosis factor-alpha〔J〕.Ann N Y Acad Sci,2000,899:61.
[11]Yun-Song Lee,Huong Thi Lan Tran,Quang Van Ta.Regulation of expression of matrix metalloproteinase-9 by JNK in Raw 264.7 cells:presence of inhibitory factor(s)suppressing MMP-9 induction in serum and conditioned media〔J〕.Exp Mol Med,2009,41(4):259.

