NS398对SGC7901胃癌细胞生长及CD44V6、MMP-9基因表达的影响
双金权 吴 婷 庄则豪
环氧合酶-2(cyclooxygenase-2)是环氧合酶的1种异构体,正常生理情况下在机体多数组织中不表达,可被多种刺激物如有丝分裂原、细胞因子等刺激而表达[1]。近年来,多项研究发现COX-2在胃癌组织中呈高表达,且与胃癌的侵袭、转移有关[1,2],且 COX-2 抑制剂能抑制肿瘤的生长、转移[3,4]。本实验观察了COX-2特异性抑制剂-NS398(分子式C13H18N2O5S,购于Cayman Chemical USA)对胃癌细胞CD44V6、MMP-9基因表达的影响,探讨COX-2抑制剂抑制胃癌侵袭、转移的可能分子机制。
1 材料与方法
1.1 材料
人胃腺癌细胞株SGC7901引自福建医科大学药理学教研室。RPMI 1640培养基(Gibco公司),新生小牛血清(杭州四季青公司),NS398(分子式C13H18N2O5S Cayman,USA),酶联免疫吸附试剂盒(Cayman chemical,USA),Trizol(lifescience technology),逆转录试剂盒,TaqDNA聚合酶(晶美公司),DMSO(sigma),MMP-9、CD44V6单克隆抗体(福州迈新公司)。
1.2 细胞培养
SGC7901细胞贴壁生长于含10%热灭活小牛血清的1640培养基中,于37℃、5%CO2饱和湿度的培养箱中培养,每2~3天0.25%胰酶消化传代。
1.3 免疫细胞化学检测 COX-2、CD44V6、MMP-9蛋白表达
取对数生长期SGC7901胃癌细胞,胰酶消化制成单细胞悬液,苔盼兰染色细胞成活率大于98%后,在清洁6孔板的每孔底部平放1片清洁的盖玻片,再按每孔2×105个细胞将胃癌细胞接种于6孔板中,待细胞贴壁后再培养24 h,取出盖玻片,PBS冲洗数次,4℃冷丙酮固定10 min,PBS冲洗3次,每次3~5 min。按说明书步骤常规行S-P法染色。结果判定:细胞膜及胞质出现棕黄色颗粒为阳性。
1.4 酶连免疫吸附实验
细胞生长至培养瓶70%~80%时更换新鲜培养基,并在实验组中加入不同量的NS398储存液使培养液终浓度分别为 1、10、100、200 μmol/L,再继续培养24 h,吸取培养上清液 500 μl,12 000 r、4℃离心 5~10 min,去除细胞碎片。实验步骤参照试剂盒说明书进行。上清液经1∶10稀释后加入检测PGE2的96孔板中,各样本在ELISA检测仪中读取450 nm处的吸光值,并根据试剂盒中提供的标准蛋白描绘出标准曲线并计算各样本的PGE2含量。每个浓度设3个复孔,实验重复3次。
1.5 MTT检测NS398对胃癌细胞生长的影响
取对数期生长的SGC7901胃癌细胞,胰酶消化制成单细胞悬液,按5×103个细胞/孔,接种于96孔板中,常规培养24 h,更换新鲜培养液并加入NS398,使各组培养液中 NS398浓度分别为 0、50、100、200 μmol/L。分别在加药后24、48、72 h倾去培养基,每孔加入MTT溶液(5 g/L)20 μL,继续孵育4 h。每孔加入150 μL的DMSO,振荡10 min,应用酶连免疫检测仪读取每孔的吸光度(A0)值(λ实验=490 nm,λ参考=630 nm)。细胞增殖抑制率(%)=[1-(实验组)/(对照组)]×100%。实验重复3次,每次、每浓度、每时间点均设3个复孔。
1.6 总RNA提取
SGC7901胃癌细胞胰酶消化制成单细胞悬液,按5×105个细胞/瓶,接种于25 ml培养瓶中,常规培养过夜,待细胞贴壁后更换培养基,并加入一定量的NS398,使终浓度为 10、100、200 μmol/L,继续培养24 h,倾去培养基,0.25%胰酶消化、离心收集细胞,按105~106个细胞/1 ml Trizol加入Trizol,反复吹打至细胞完全溶解,按说明书进行总RNA提取,测 OD260/OD280≥1.80,说明RNA完整性良好,行PCR扩增。
1.7 逆转录聚合酶链反应(RT-PCR)
参照试剂说明书取总RNA 2 μg作逆转录反应,逆转录反应体系 20 μl:mRNA 2 μg,MgCL24 μl,dntp 2 μl ,amv 0.75 μl,oligo 1 μl,rnasin 0.5 μl,distilled water 补足20 μl。反应条件:42℃ 1 h,95℃ 5 min。取逆转录反应产物2 μl进行PCR反应,以β-actin作为内参照。参照文献,各引物序列为:CD44V6[5](129 bp),P1:5 '-tccaggcaactcctagtagt-3,P2:5-cagctgtccctgttgtcgaa-3。MMP-9[6](494 bp),P1:5-tgggagcatggcgatggata-3,P2:5-acagtggacatggcggtctca-3。CD44V6 反应体系50 μl:10 × bufferul 5 μl,10 mM dNTP 4 μl,MgCL23 μl(25 mM),cDNA 2 μl,Taq 酶 2U,β-actin 上下游引物各0.5 μl(10 pmol/μl),CD44V6 上下游引物各 2 μl(10 pmol/μl),去离子水补足至 50 μl。在 9 700 型PCR扩增仪(Bechman)上进行PCR扩增,94℃预变性5 min后开始PCR循环:95℃变性30 s,56℃退火45 s,72℃延伸1 min,共扩增32个循环。最后72℃延伸10 min。MMP-9 反应体系50 μl:10 × bufferul 5 μl,10 mM dNTP 4 μl,MgCl23 μl(25 mM),cDNA 2 μl,Taq 酶 2 U,β-actin 上下游引物各 0.5 μl(10 pmol/μl),MMP-9上下游引物各2 μl(10 pmol/μl),去离子水补足至50 μl。将反转录产物于95℃预变性5 min后,开始PCR热循环:反应条件:95℃45 s,60℃退火 45 s,72℃延伸1 min,共扩增35个循环,末次72℃延伸10 min。取8 μl产物加2 μl溴酚兰混合后经0.2%琼脂糖凝胶电泳,图像分析仪扫描得出峰值,进行半定量分析,以CD44V6/β-actin、MMP-9/β-actin 作为其 mRNA 表达量。
1.8 统计学方法
2 结果
2.1 胃癌细胞中COX-2、CD44V6、MMP-9表达情况
免疫细胞化学结果发现,COX-2、CD44V6、MMP-9在SGC7901胃癌细胞中呈阳性表达,其中 COX-2、MMP-9主要是胞质染色,CD44V6主要是细胞膜呈阳性染色,且三者表达强度较强。
2.2 不同浓度NS398对胃癌细胞产生PGE2的影响
ELISA试验发现,NS398可有效抑制SGC7901胃癌细胞PGE2的分泌水平。与对照组比较,当NS398浓度达10 μmol/L时,开始出现 SGC7901胃癌细胞PGE2分泌水平下降,NS398浓度为200 μmol/L时能显著抑制胃癌细胞PGE2的分泌,PGE2分泌水平下降了64.3%,NS398对SGC7901胃癌细胞PGE2分泌水平抑制作用呈浓度相关性,见表1和图1。

图1 NS398作用后胃癌细胞PGE2分泌水平的变化
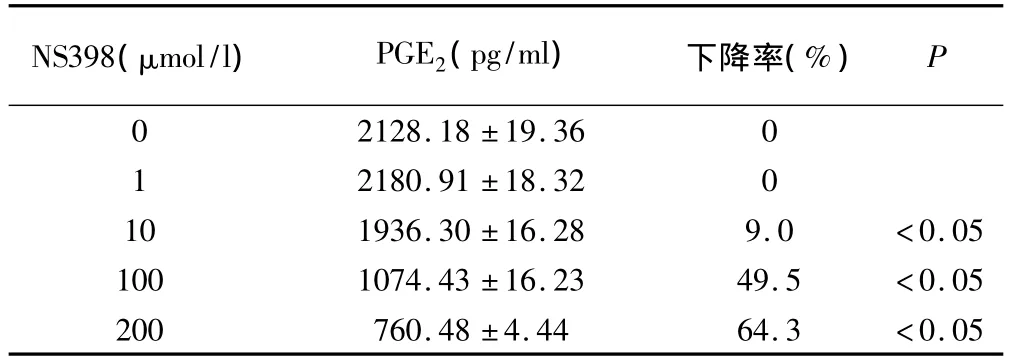
表1 不同浓度NS398作用后胃癌细胞PGE2分泌水平变化
2.3 NS398对胃癌细胞生长的影响
不同浓度NS398作用不同时间,实验组A0值均小于对照组,而DMSO(200 μmol/L)组与空白对照组比较无显著性差异(P<0.01),因此,DMSO对胃癌细胞的生长无影响。当NS398浓度为50 μmol/L时,SGC7901胃癌细胞生长出现抑制效应,与对照组比较差异有显著性(P<0.05)。200 μmol/L NS398作用24 h细胞生长抑制率为30.5%,48 h为29.5%,72 h为42.9%。且发现NS398对胃癌细胞增殖抑制率随其浓度的增高而增高;其中200 μmol/L NS398作用72 h对细胞增殖的抑制率最高,为42.9%,见表2、3。
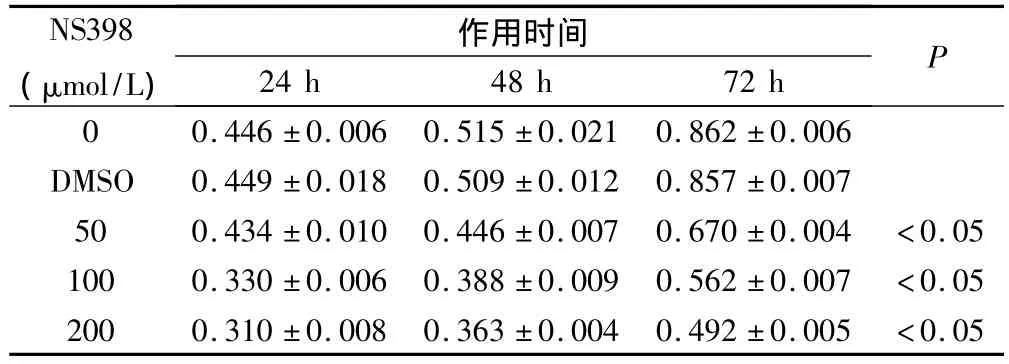
表2 不同浓度NS398作用不同时间后对SGC7901胃癌细胞生长的影响
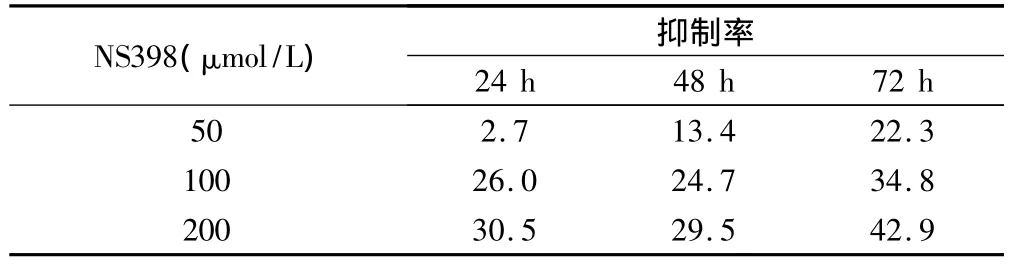
表3 不同浓度NS398作用不同时间后SGC7901胃癌细胞增殖抑制率(%)
2.4 NS398对胃癌细胞中CD44V6、MMP-9基因表达的影响
NS398作用24 h后,与对照组比较,DMSO(200 μmol/L)组CD44V6、MMP-9基因表达水平无明显变化(P<0.05),DMSO 对胃癌细胞中 CD44V6、MMP-9基因表达无影响;而各实验组mRNA相对表达量均低于对照组;200 μmol/L NS398作用24 h时,胃癌细胞中CD44V6、MMP-9基因表达水平分别下降45.7%和43.6%。NS398能在基因表达水平上抑制 CD44V6、MMP-9表达,且这种抑制效应与 DMSO无关,是由NS398 作用引起的,见表4,图2、3、4。

图2 SGC7901胃癌细胞中各目的基因的表达

表4 NS398对胃癌细胞中CD44V6、MMP-9基因表达的影响(/β-actin)
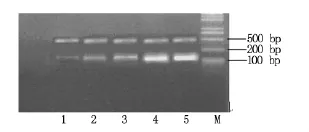
图3 NS398作用后SGC7901胃癌细胞CD44V6基因表达变化

图4 NS398作用后SGC7901胃癌细胞MMP-9基因表达变化
3 讨论
近年研究发现,COX-2高表达与胃癌等多种肿瘤发生有关,COX-2高表达不仅促进了肿瘤的发生,且能促进肿瘤的侵袭和转移[2,7,8],也有研究发现 COX-2 抑制剂可抑制某些肿瘤细胞的黏附运动和侵袭性[4]。
NS398是1种特异性的COX-2抑制剂,可有效抑制前列腺素(PGs)的产生。在实验中应用酶联免疫吸附检测NS398对SGC7901胃癌细胞分泌前列腺素-2(PGE2)水平的影响,发现NS398可有效抑制SGC7901胃癌细胞PGE2的产生,且抑制程度随浓度增加而增强。200 μmol/L NS398作用24 h,胃癌细胞前列腺素分泌水平下降64.3%。NS398能有效抑制COX-2的PGE2的产生,从而阻断COX-2的作用。
吴汉平等[9]将COX-2反义RNA转染到胃癌细胞后,与对照组相比,胃癌细胞生长显著受抑制。可见COX-2参与了肿瘤生长的调控。Cheng等[10]观察NS398对肝细胞癌生长的影响,发现NS398呈剂量依赖性抑制Hep3B和HKCI-4细胞的增殖,100 μmol/L使Hep3B细胞增殖下降17%,HKCI-4细胞下降15%。国内王纯雁等[11]也观察到NS398能显著抑制卵巢癌细胞的增殖。MTT试验是1种有效的间接检测细胞生长的方法,我们在实验中应用MTT法检测NS398对SGC7901胃癌细胞生长的影响,发现不同浓度NS398作用不同时间胃癌细胞的生长均受抑制。当NS398的浓度为50 μmol/L时开始出现对SGC7901胃癌细胞增殖的抑制效应,且抑制效应随其浓度增加而增强。其中200 μmol/L作用72 h对细胞增殖的抑制率为42.9%,充分显示了NS398抑制SGC7901胃癌细胞体外生长的效应。
肿瘤细胞与基质的黏附及基质的降解是肿瘤侵袭、转移过程中的重要步骤,其中包括黏附分子CD44及基质金属蛋白酶(MMP-2、MMP-9)的参与。MMP-9能降解基质便于肿瘤细胞的移动、侵袭。Yu等[12]认为CD44V6作为MMP-9在细胞表面的附着点,以确保CD44介导的肿瘤浸润与转移。Tsujii等[13]发现转染COX-2基因的结肠癌细胞表现出明显的侵袭性,而抑制COX-2表达可见癌细胞运动、侵袭能力下降。Pan等[14]发现COX-2抑制剂可显著抑制肺癌细胞的侵袭、运动能力及 CD44V6、MMP-2的基因表达,而对MMP-9基因表达无影响。但Yao等[15]研究发现COX-2选择性抑制剂NS398(100 mmol/L)能显著降低高转移性鼠结肠癌细胞MC-26侵袭性,且MMP-2及MMP-9的蛋白表达水平及酶活性均下降25%~30%,且癌细胞肝转移被延缓。我们在实验中运用RT-PCR检测NS398作用于 SGC7901胃癌细胞24 h后 CD44V6、MMP-9基因表达水平的变化,发现经NS398作用后,胃癌细胞CD44V6、MMP-9基因表达水平有不同程度下降。200 μmol/L NS398 作用 24 h,胃癌细胞CD44V6、MMP-9基因表达分别下降45.7%和43.7%。COX-2特异性抑制剂NS398抑制了SGC7901胃癌细胞CD44V6、MMP-9基因的表达。CD44V6、MMP-9基因是肿瘤细胞侵袭与转移过程中的重要分子,因此,COX-2可能在促进胃癌侵袭、转移的过程中发挥一定的调节作用,有可能是调节胃癌侵袭、转移过程的一个靶点。
NS398可抑制COX-2酶的活性、阻止PGs的产生和释放,因此,NS398抑制CD44V6、MMP-9表达与PGs的阻断有关。有研究发现[16],经PGs作用后,肺癌细胞前列腺素的EP4上调,且伴随CD44V6、MMP-2基因表达水平的升高,而抑制 PGs的释放,可见 EP4、CD44V6、MMP-2表达水平下降;而且发现若使细胞内cAMP水平升高,则 CD44、MMP-2表达上调,可见PGs、EP4、cAMP 参与 COX-2 对 CD44V6、MMP-2 基因表达的调节,而PGs并不能完全逆转这种作用,可能NS398本身对CD44、MMP-2基因表达有抑制作用,但具体在胃癌中的作用机制需进一步探讨。本实验中发现NS398作用SGC7901胃癌细胞后,其CD44V6、MMP-9基因表达水平下降,但尚不明确这一作用是否为COX-2依赖性,其可能的具体信号转导途径需要进一步的实验研究来明确。
本实验发现,COX-2特异性抑制剂NS398可抑制CD44V6、MMP-9的基因表达,而CD44V6、MMP-9是促进胃癌侵袭、转移的重要分子。COX-2及其抑制剂在胃癌侵袭与转移中的作用值得进一步研究,COX-2可能是胃癌侵袭、转移调节过程中的一个新靶点,COX-2特异性抑制剂NS398可能成为新的抑制肿瘤侵袭与转移的药物。可以设想,COX-2抑制剂将为胃癌的治疗提供新的思路。
[1]Lim HY,Joo HJ,Choi JH,et al.Increased expression of cyclooxygenase-2 protein in human gastric carcinoma〔J〕.Clin Cancer Res,2000,6(2):519.
[2]刘 军,朱海杭,卜 平,等.环氧合酶-2、P-gp在胃癌组织中的表达及其意义〔J〕.实用癌症杂志,2004,19(2):148.
[3]Heath CW,Thun MJ,Greenberg ER,et al.Nonsteroidal anti-inflammatory drugs and human cancer.Cancer〔J〕.1994,74(2):2885.
[4]Yamauchi T,Watanabe M,Hasegawa H,et al.The potential of a selective cyclooxygenase-2 inhibitor in the prevention of liver metastasis in human colorectal cancer〔J〕.Anticancer Res,2003,23(1A):245.
[5]Friedrichs K,Franke F,Lishon BW,et al.Expression of CD44V5 and-V6 in barrett's carcinoma is not increased compared to that in nondysplastic barrett's mucosa〔J〕.Experimental and Molecular Pathology,2002,72:207.
[6]Masaki Okada,Keisuke Miyake.Matrix metalloproteinase-2 and matrix metalloproteinase-9 expressions correlate with the recurrence of intracranial meningiomas〔J〕.Journal of NeuroOncology,2004,66:29.
[7]Kim HJ,Wu HG,Park IA,et al.High cyclooxygenase-2 expression is related with distant metastasis in cervical cancer treated with radiotherapy〔J〕.Int J Radiat Oncol Biol Phys,2003,55(1):16.
[8]Costa C,Soares R,Reis-Filho JS,et al.Cyclo-oxygenase 2 expression is associated with angiogenesis and lymph node metastasis in human breast cancer〔J〕.J Clin Pathol,2002,55(6):429.
[9]吴汉平,吴开春,李 玲,等.人环氧合酶-2(Hcox-2)编码基因的克隆及其反义核酸转染胃癌细胞的初步研究〔J〕.世界华人消化杂志,2000,8(11):1211.
[10]Cheng A S.Specific COX-2 inhibitor,NS-398,suppresses cellular proliferation and induces apoptosis in human hepatocellular carcinoma cells〔J〕.Int J Oncol,2003,23(1):113.
[11]王纯雁,王 敏,王欣彦,等.NS39对卵巢癌细胞系CA0V3和OVCAR3生长抑制作用的研究〔J〕.中华妇产科杂志,2003,38(7):415.
[12]Yu Q and I Stamenkovic.Localization of matrix metalloproteinase 9 to the cell surface provides a mechanism for CD44-mediated tumor invasion〔J〕.Genes Dev,1999,13(1):35.
[13]Tsujii M,S Kawano and R N DuBois.Cyclooxygenase-2 expression in human colon cancer cells increases metastatic potential〔J〕.Proc Natl Acad Sci USA,1997,94(7):3336.
[14]Mei-Ren an,Lea-Yea Chuang,Wen-Chun Hung.Non-steroidal anti-inflammatory drugs inhibit matrix metalloproteinase-2 expression via repression of transcription in lung cancer cells〔J〕.FEBS Letters,2001,508:365.
[15]Yao M,Lam EC,Kelly CR.Cyclooxygenase-2 selective inhibition with NS-398 suppresses proliferation and invasiveness and delays liver metastasis in colorectal cancer〔J〕.Br J Cancer,2004,90(3):712.
[16]Joo M,H K Lee and Y K Kang.Expression of E-cadherin,beta-catenin,CD44s and CD44V6 in gastric adenocarcinoma:relationship with lymph node metastasis〔J〕.Anticancer Res,2003,23(2B):1581.

