MT1-MMP和MMP11在肺癌中的表达及其预后价值
廖渝蓉 钟 萍 胡兴胜 邹心怡 刘雨松
目前肺癌的死亡率居男性恶性肿瘤的第1位和女性恶性肿瘤的第2位[1]。肺癌易发生浸润和转移,5年生存率低。目前有关肺癌浸润转移的机制尚不完全清楚,因此探索与肺癌浸润转移,尤其是与预后相关的生物学指标,显得尤为重要。基质金属蛋白酶(matrix mettallo-proteinases,MMPs)是一类降解细胞外基质的酶类,在肿瘤浸润转移过程中发挥着极其重要的作用。膜型基质金属蛋白酶1(membrane type-1 matrix metalloproteinase,MT1-MMP)是 MMP家族的新成员,是典型的细胞外基质降解酶。基质金属蛋白酶11(matrix metalloproteinase 11,MMP11)对肿瘤的发展过程必不可少。为此,我们采用免疫组化检测了MT1-MMP和MMP11在肺鳞癌和腺癌组织中的表达情况,分析它与肺癌临床病理特征及预后的关系。
1 材料与方法
1.1 一般资料
选取2003年1月至2006年1月重庆医科大学病理科的手术标本47例肺鳞癌和42例肺腺癌。所有患者术前均未化疗或放疗,均有完整的临床资料和明确的病理诊断。其中男性64例,女性25例;<60岁46例,≥60岁43例;不吸烟37例,吸烟52例;高分化13例,中分化61例,低分化15例;T1期11例,T2期62例,T3期11例,T4期 5例;N0期 62例,N1~3期 27例;Ⅰ期50例,Ⅱ期7例,Ⅲ期32例。
所有患者每3个月均进行电话、门诊或住院部随访,随访开始于2003年4月,结束至2011年1月,最短随访时间为4个月,最长随访时间为5年。期间有10例失访。
1.2 免疫组化检测MT1-MMP蛋白的表达
山羊抗人一抗MT1-MMP和MMP11多克隆抗体均购美国Santa Cruzz公司,免疫组化二抗SP试剂盒购自北京中杉生物公司。
石蜡包埋标本常规切片,厚度5 μm。应用免疫组化SP法,常规脱蜡至水,采用微波抗原热修复,阴性对照用PBS液代替一抗。具体步骤按说明书操作。结果判断:所有切片均采用双盲法由2位病理科医师独立阅片。MT1-MMP和MMP11阳性表达均定位于细胞质和(或)细胞膜,呈浅黄色、黄色或棕黄色。随机选择10个高倍镜视野(400倍),每个视野连续计数100个细胞,共计数1 000个细胞。最后表达以染色强度和阳性细胞率的得分之和进行判断:无染色记0分,弱染色记1分,中等染色记2分,强染色记3分;阳性细胞率<5%记0分,5%~25% 记1分,26%~50%记2分,>50%记3分。上述两项评分相加,<3分为阴性,>3分为阳性。
1.3 统计学处理
采用SPSS 17.0统计学软件包分析。MT1-MMP和MMP11与肺癌临床病理学特征的联系采用卡方或Fisher精确检验,MT1-MMP和MMP11之间的相关性采用spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 MT1-MMP和MMP11蛋白检测结果
MT1-MMP蛋白的阳性表达率在肺鳞癌和腺癌组织中分别为 68.1%(32/47)和 64.3%(27/42)(P=0.705),总阳性率为 66.3%(59/89)。MMP11 蛋白在肺鳞癌和腺癌组织中的阳性表达率分别为61.7%(29/47)和 57.1%(24/42)(P=0.662),总阳性率为59.6%(53/89)。
2.2 MT1-MMP、MMP11蛋白表达与肺癌临床病理特征的联系
统计学结果显示,MT1-MMP表达随着肺癌T分期的增加、淋巴结转移和TNM分期的增加而增加(P<0.05),而与性别、年龄、吸烟及组织学类型等无关(P>0.05)。MMP11表达随着肺癌淋巴结转移和TNM分期增加而增加(P<0.05),而与性别、年龄、吸烟、组织学类型及T分期等无关(P>0.05)。见表1。
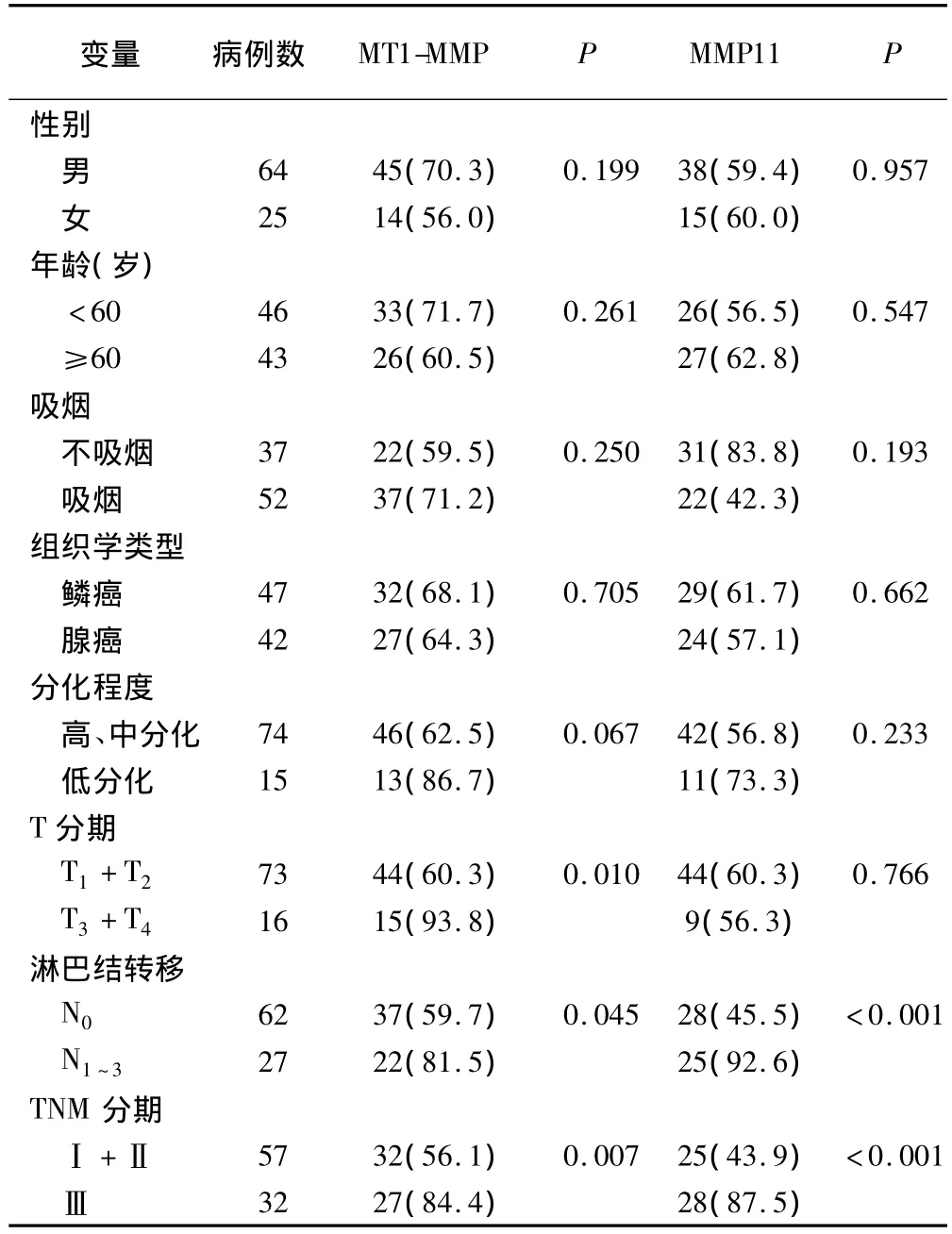
表1 MT1-MMP和MMP11的阳性表达与肺癌临床病理特征的关系(例,%)
2.3 MT1-MMP和MMP11表达的相关性
经spearman秩相关分析发现,在89例肺癌组织中MT1-MMP和MMP11的表达呈正相关,相关系数γ=0.332,P=0.001,见表2。

表2 肺癌组织中MT1-MMP和MMP11表达的相关性(例)
2.4 生存分析
Kaplan-Meier生存曲线显示,MT1-MMP阳性表达组的5年生存率为22.4%,显著低于阴性表达组49.3%(χ2=8.720,P=0.003)。MMP11 阳性表达组5年生存率为23.3%,显著低于阴性表达组44.9%(χ2=6.705,P=0.010),见图1,2。
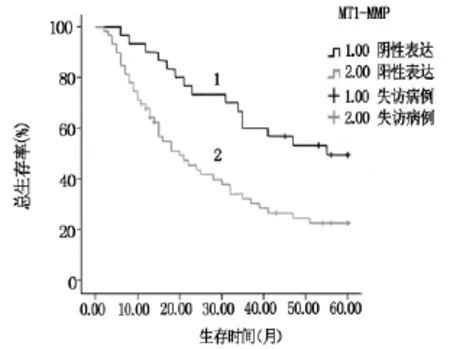
图1 MT1-MMP表达阳性和阴性肺癌患者Kaplan-Meier生存曲线

图2 MMP11表达阳性和阴性肺癌患者Kaplan-Meier生存曲线
3 讨论
肿瘤细胞的浸润和转移是极其复杂的过程。但肿瘤细胞要具有浸润转移的能力,首先必须突破细胞外基质的屏障和具有自身运动的潜能。MMPs是降解细胞外基质的主要酶类,已鉴别出28种,根据结构及降解底物的不同分4类,胶原酶类、明胶酶类、基质溶解素及膜型基质金属蛋白酶。MT1-MMP是膜型基质金属蛋白酶家族中首位被发现的成员,被认为是MMP家族中与肿瘤浸润转移关系最密切的酶类之一。MT1-MMP导致浸润转移的机制有:一是直接降解许多大分子的细胞外基质;二是激活酶原 MMP2和MMP13,引发水解效应的放大,其中MMP2在肿瘤侵袭作用中起着举足轻重的作用[2];三是通过与不同的细胞间黏附分子的作用,影响细胞在ECM上的迁移,或直接赋予无侵袭潜能的细胞穿透Ⅰ型胶原的能力。此外,MT1-MMP 还能促进血管的形成[3]。MMP11,亦被称为基质分解素3,据报道它是整个恶性肿瘤自然生长过程中癌细胞主动配体,对肿瘤的发展必不可少[4],与肿瘤发生、浸润和转移亦相关。MMP11具有与其他MMPs不同的独特性质,它以潜在的活性形式分泌,在细胞内处理前体MMP11,一般不直接降解大多数细胞外基质。
MT1-MMP和MMP11均被发现在多种恶性肿瘤组织中过表达,并与肿瘤的进展及预后相关。MT1-MMP在宫颈癌中的表达明显高于癌前病变组,其表达与浸润的深度、分期、淋巴结转移及微血管密度呈正相关[5]。MT1-MMP蛋白在食管癌和喉癌中的阳性率分别为62.5%(45/72)和 65.2%(47/72),在低分化组和有淋巴结转移组中的表达均显著高于高分化组和无淋巴结转移组[6,7]。Mimori等[8]检测发现 MT1-MMP在胃癌患者血液中的高表达与肿瘤腹腔播散、淋巴结播散、血管播散、淋巴结转移密切相关。Perentes等[9]发现下调MT1-MMP的表达,可以降低乳腺癌肺转移,其表达与血管浸润相关。MMP11在胃癌[10]组织中的高表达与临床分期和分级相关,并与IGF-1呈正相关,后者能刺激肿瘤细胞生长、延缓凋亡及促进转移。MMP11表达还与乳腺癌[11]的临床分期、淋巴结转移,喉癌[12]的T分期和淋巴结转移密切相关。MT1-MMP和MMP11高表达均是食管癌的不良预后影响因素[13]。目前有关MT1-MMP和MMP11在人肺癌组织中的表达研究甚少。在肺腺癌伴发脑转移的研究中,MT1-MMP 蛋白的阳性率为 80%(20/25)[14]。Kettunen等[15]用基因芯片技术检测发现,MMP11在肺癌组织中亦是高表达。
本研究发现,MT1-MMP在肺癌组织中的阳性率为66.3%,与文献报道基本一致。MT1-MMP的表达与肺癌的T分期、淋巴结转移和TNM分期有关。T分期是肿瘤增殖和侵袭能力的综合反应。提示MT1-MMP的阳性表达可能促进肺癌的增殖、侵袭和转移等能力,是肺癌恶性程度的一项判断指标。本研究中,虽然MT1-MMP在低分化组中的阳性率(86.7%),高于高、中分化组(62.5%),但未见统计学差异,这与某些文献报道有所差异,这可能与研究的病种、病例数、病例的个体差异等有关,有待进一步探索。目前有关MMP11在肺癌中的阳性率报道较少,本研究检测结果显示其阳性率为59.6%。在MMP11与肺癌临床病理学特征的关系中,我们研究发现,其表达与肺癌的淋巴结转移和TNM分期有关,但未见与分化程度、T分期相关,这与 Zhao等[10]和 Duan 等[12]的报道不符,但与 Yamashita等[13]的报道一致,这除了可能与病种、病例数等有关外,可能还与MMP11的不直接降解大多数细胞外基质有关。本研究结果还显示MT1-MMP和MMP11的表达呈正相关,提示两者可能存在着相互联系,其机制有待进一步研究,这与Yamashita等[13]的报道一致。目前有关MT1-MMP和MMP11与肿瘤预后的研究较少,尚未见两者与肺癌的预后报道。本研究生存分析显示,MT1-MMP和MMP11阳性表达组患者的5年生存率,均明显低于阴性组。提示MT1-MMP和MMP11基因的异常表达可能是肺癌发展过程中的2个分子事件,导致肺癌的不良预后,其机制可能为它们自身和(或)通过调节其他基因(如MMPs)的异常表达,促进肺癌的浸润和转移等。MT1-MMP和MMP11的异常表达均对肺癌的预后判断有着一定的参考价值。
综上所述,本研究发现MT1-MMP和MMP11在肺鳞癌和腺癌组织中高表达,其表达与肺癌浸润转移及预后密切相关。MT1-MMP是典型的ECM降解酶,在活化其他MMPs中起着重要的作用,还能赋予细胞转移潜能。而MMP11具有独特的性质,其机制有待进一步探索。MT1-MMP和MMP11均可能作为肺癌浸润转移及预后的判断指标。
[1]Jema A,Bray F,Center MM,et al.Global Cancer Statistics〔J〕.CA Cancer J Clin,2011,61(2):69.
[2]刘旭之,宋 桌.MMP-2、NM23在非小细胞肺癌组织和癌旁正常组织中表达及其临床意义〔J〕.实用癌症杂志,2010,25(3):255.
[3]Borrirukwanit K,Lafleur MA,Mercuri FA,et al.The type 1 collagen induction of MT1-MMP-mediated MMP-2 activation is repreased by alpha Vbeta3 integrin in human breast cancer cells〔J〕.Matrix Biol,2007,26(4):291.
[4]RIO MC.From a unique cell to metastasis is a long way to go:clues to stromelysin-3 participation〔J〕.Biochimie,2005,87(3~4):299.
[5]朱 燕,杨其昌,刘宏斌,等.宫颈癌组织中CD146和MMP-14表达的意义及相关性分析〔J〕.实用癌症杂志,2011,26(1):16.
[6]张 欣,张会超,郭建文,等.Axin与MMP一14在食管鳞癌中的表达及与浸润转移的关系〔J〕.第二军医大学学报,2008,29(11):1409.
[7]刘业海,唐平章,刘芝华,等.基质金属蛋白酶14基因在人喉鳞状细胞癌中表达差异的分析〔J〕.中华耳鼻喉科杂志,2004,39(8):501.
[8]Mimori K,Fukagawa T,Kosaka Y,et al.A large-scale study of MT1-MMP as a marker for isolated tumor cells in peripheral blood and bone marrow in gastric cancer cases〔J〕.Ann Surg Oncol,2008,15(10):2934.
[9]Perentes JY,Kirkpatrick ND,Nagano S,et al.Cancer cellassociated MT1-MMP promotes blood vessel invasion and distant metastasis in triple-negative mammary tumors〔J〕.Cancer Res,2011,71(13):4527.
[10]Zhao ZS,Chu YQ,Ye ZY,et al.Overexpression of matrix metalloproteinase 11 in human gastric carcinoma and its clinicopathologic significance〔J〕.Hum Pathol,2010,41(5):686.
[11]Cheng CW,Yu JC,Wang HW,et al.The clinical implications of MMP-11 and CK-20 expression in human breast cancer〔J〕.Clin Chim Acta,2010,411(3~4):234.
[12]Duan S,Guo Y.Expression and clinical significance of stromelysin-3 in laryngeal cancer〔J〕.Lin Chung Er Bi Yan Hou Tou Jing Wai Ke Za Zhi,2008,22(3):104.
[13]Yamashita K,Tanaka Y,Mimori K,et al.Differential expression of MMP and uPA systems and prognostic relevance of their expression in esophageal squamous cell carcinoma〔J〕.Int J Cancer,2004,110(2):201.
[14]Yoshida S,Takahashi H.Expression of extracellular matrix molecules in brain metastasis〔J〕.J Surg Oncol,2009,100(1):65.
[15]Kettunen E,Anttila S,Seppänen JK,et al.Differentially expressed genes in nonsmall cell lung cancer:expression profiling of cancer-related genes in squamous cell lung cancer〔J〕.Cancer Genet Cytogenet,2004,149(2):98.

