弓形虫棒状体蛋白18的原核表达及鉴定
鞠爱萍,吴亮,沈进,李礼,姜旭淦,陈盛霞
(江苏大学基础医学与医学技术学院,江苏镇江212013)
刚地弓形虫(Toxoplasma gondii)是一种广泛分布于世界范围内的重要的人兽共患寄生虫,几乎感染所有的恒温动物,人类普遍易感,据统计全球约有1/3人口感染弓形虫[1]。免疫功能正常人群感染弓形虫后不会出现明显的临床症状,仅表现为轻度流感样症状,但免疫功能降低、缺陷者或胎儿感染后则可引发严重的弓形虫病,从而导致人体各器官出现严重病变,新生儿脑炎、智力障碍,甚至流产、畸胎、死胎[2]。目前弓形虫感染已成为AIDS患者和器官移植者重要的死亡因素之一[3]。弓形虫棒状体蛋白(rhoptry proteins,ROPs)是棒状体分泌的一系列毒力蛋白,是弓形虫入侵宿主的重要作用因子[4-5]。近年来,国内外学者对弓形虫棒状体蛋白的研究取得了一定进展,证明 ROP18是一个毒力关键因子,对于弓形虫入侵宿主细胞及其在细胞内的生存是十分重要的[6],而国内对ROP18的研究较少。本研究通过原核表达技术成功构建了原核表达载体并获得重组ROP18,为深入研究ROP18的生物学功能及其在入侵中发挥的作用提供了帮助。
1 材料与方法
1.1 材料
1.1.1 细胞与虫株 HeLa细胞购自中国科学院细胞库。弓形虫RH株由本室液氮冷冻保存。
1.1.2 实验动物 家兔,2.0 kg,雄性,购自江苏省江陵动物实验中心,清洁级环境下饲养。
1.1.3 菌株与质粒 大肠埃希菌(E.coli)DH5α株和Rosetta株及原核表达质粒pET-28a(+)均由本实验室保存,pTG19-T载体购自上海捷瑞生物技术有限公司。
1.1.4 试剂与仪器 总RNA提取试剂盒、2×PCR预混液、琼脂糖凝胶回收试剂盒、牛血清白蛋白、DNA标准参照物、异丙基-D-硫代半乳糖苷均购自上海捷瑞生物技术有限公司,限制性核酸内切酶BamH I和HindⅢ购自立陶宛 Fermentas公司,T4连接酶购自宝生物大连有限公司,辣根过氧化物酶标记羊抗兔IgG(HRP-IgG)、FITC标记羊抗兔IgG、硝酸纤维素膜NC膜和ECL化学发光检测试剂盒均购自武汉博士德公司,低聚甲醛、Triton X-100、福氏完全佐剂和福氏不完全佐剂以及4,6-二脒基-2-苯基吲哚均购自美国Sigma公司,其余试剂均为国产分析纯。全自动凝胶成像仪及垂直电泳仪购自美国Bio-Rad公司,超声破碎仪购自北京迪索仪器有限公司,核酸蛋白分析仪购自英国WPA公司,温控摇床4YC-200购自上海福玛公司,脱色摇床购自金坛市医疗仪器厂。
1.2 方法
1.2.1 弓形虫的培养及总RNA提取 按吴亮等[7]报道的方法在HeLa细胞中传代培养弓形虫RH株速殖子。从液氮取出冻存的弓形虫 RH株,37℃水浴快速复苏,3 000 r/min离心5 min,用l%胎牛血清RPMI 1640重悬后接种HeLa细胞,置37℃ 5%CO2饱和湿度的细胞培养箱中进行培养,每天用倒置显微镜观察细胞和虫体的生长状态,镜下观察到大量虫体游离于细胞外时收集虫体,以灭菌PBS缓冲液(pH 7.4)洗涤3次,按照RNA提取试剂盒说明书抽提弓形虫速殖子总RNA,经反转录为cDNA,-20℃冻存备用。
1.2.2 ROP18基因扩增与克隆 根据ToxoDB基因库中弓形虫RH株基因组ROP18基因序列,用DNASTAR软件设计1对特异性引物。上游引物ROP18-F:5'-GGCGGATCCATGTTTTCGGTACAGCGGCCACCTCTTA-3'(BamHⅠ),下游引物 ROP18-R:5'-GGCAAGCTTTTATTCTGTGTGGAGATGTTCC TGC TGTTC-3'(HindⅢ),由上海生工生物工程技术服务有限公司合成。以弓形虫cDNA为模板进行PCR扩增,反应条件:94℃预变性1 min,94℃ 5 s,63.1℃ 90 s,72 ℃ 90 s,25 个循环,72 ℃延伸10 min。产物经琼脂糖凝胶电泳鉴定分析正确后,胶回收试剂盒回收 PCR产物,与克隆载体pTG19-T 4℃连接12 h后转化至感受态 DH5α,涂布于含100 μg/mL氨苄西林、200 μg/mL X-Gal和 100 μg/mL IPTG 的LB琼脂平板,37℃培养过夜,次日经蓝白斑筛选,挑取白色菌落转入液体LB培养基增菌,按碱裂解法提取重组质粒。
1.2.3 重组质粒ROP18/pTG19-T鉴定 提取的重组质粒经PCR和BamHⅠ酶切鉴定,阳性质粒送上海生工生物工程有限公司测序,基因测序结果经Blast比对分析,与基因库中弓形虫ROP18编码基因完全一致后,用于后续实验。
1.2.4 ROP18/pET-28a(+)表达载体构建 重组质粒ROP18/pTG19-T和表达质粒pET-28a(+)分别经BamHⅠ和HindⅢ双酶切后胶回收,经T4连接酶16℃过夜连接后转化至DH5α感受态细胞,按碱裂解法提取质粒,将重组表达质粒经PCR和双酶切鉴定,阳性质粒转入Rosetta感受态细胞。
1.2.5 重组蛋白表达 挑取阳性菌落接种于3 mL含卡那青霉素的LB液体培养基中,37℃,250 r/min振摇培养过夜;次日以1∶100比例接种含同种抗生素的200 mL LB培养基,继续培养约2 h,直至光密度(D)值为0.6左右,加入IPTG至终浓度为0.4 mmol/L,30℃ 250 r/min诱导培养6 h,收集菌体,洗涤后加入包涵体结合缓冲液,充分重悬菌体,静置30 min后超声裂解菌体,4℃ 15 000 r/min离心30 min,收集上清液。
1.2.6 重组蛋白纯化 根据目的蛋白相对分子质量大小配制分离胶,不插样品梳直接上样,SDSPAGE电泳参照文献[8]进行,直到溴酚蓝染料抵达分离胶底部时结束电泳。将胶块取下置于预冷KCl(250 mmol/L)溶液中,振摇染色10 min,胶块上可呈现一条白色的目的蛋白条带,将此条带切下置于PBS缓冲液中振摇洗涤5 min。根据后续实验需要进一步处理胶条:用于制备多克隆抗体时,将胶条与适量佐剂混合后于冰上充分研磨粉碎,形成“油包水”状即可免疫家兔;ELISA实验包被抗原时,将胶条置于EP管中,加入少许PBS缓冲液振荡混匀,-20℃反复冻溶3次,4℃ 16 400 r/min离心15 min,取上清液即为ELISA实验的包被抗原。
1.2.7 兔抗重组蛋白ROP18多克隆抗体制备 按姜旭淦等[9]报道方法进行。制备足量乳化抗原,经背部皮内多点注射法免疫家兔,初次免疫前采集兔耳缘静脉血液,取血清作阴性对照,第1次免疫3周后,进行第2次免疫,间隔1周进行第3次加强免疫,共免疫3次,剂量及免疫途径同首次免疫。加强免疫1周后经耳缘静脉采集兔血,分离血清,以ELISA法检测其血清抗体效价,当抗体效价>1∶51 200时,即可采用心脏采血法收集兔血,分离血清,此即兔多克隆抗体,分装后于-70℃保存备用。
1.2.8 蛋白质印迹检测ROP18在弓形虫速殖子中的表达 HeLa细胞中传代培养弓形虫RH株速殖子,收集1×107虫体于EP管中,加SDS-PAGE上样缓冲液,充分混匀后煮沸10 min,4℃ 16 400 r/min离心20 min,取上清液上样进行SDS-PAGE电泳。电泳结束后,将目的蛋白转印至NC膜上,以5%脱脂奶粉室温封闭1 h,加入1∶1 000兔抗ROP18抗血清,室温孵育2 h,TBST缓冲液洗涤3次后,与1∶5 000 HRP标记羊抗兔IgG室温孵育1 h,充分洗涤后进行ECL显影反应,化学发光仪观察结果。
1.2.9 间接免疫荧光(IFA)观察ROP18在弓形虫速殖子中的分布 在6孔细胞培养板内放置1块干净盖玻片,无菌操作接种 2.5×105个/孔HeLa细胞,置于37℃ 5%CO2培养箱中培养。镜下观察细胞生长融合至80%时,接种弓形虫速殖子1×106个/孔,继续置于37℃ 5%CO2培养箱中培养,共培养至4 h时取出盖玻片,以PBS缓冲液振摇洗涤3次,4%低聚甲醛室温固定15 min,经0.25%Triton X-100透化处理15 min后,5%BSA室温封闭1 h,滴加兔抗ROP18抗血清(1∶1 000)37℃孵育2 h,PBS缓冲液振摇洗涤3次,加FITC-IgG(1∶100)37℃孵育1 h,洗涤3次后加入适当浓度的DAPI溶液复染,洗涤后以抗荧光淬灭封片剂封片,立即置于荧光显微镜下观察结果。
2 结果
2.1 弓形虫ROP18基因体外扩增结果
以弓形虫 cDNA为模板,PCR扩增弓形虫ROP18基因,其扩增产物经1%琼脂糖凝胶电泳检测,片段大小约1 665 bp(图1),与弓形虫ROP18基因理论扩增片段大小相符。
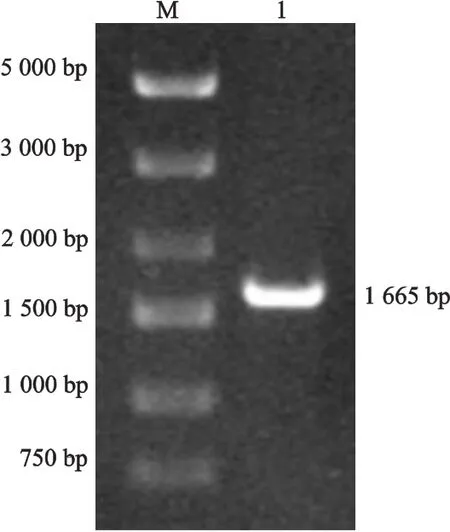
图1 PCR扩增弓形虫ROP18基因结果Fig 1 Amplification of ROP18 gene in T.gondii by PCR
2.2 ROP18/pET-28a(+)重组质粒的鉴定
重组质粒ROP18/pET-28a(+)经BamHⅠ和HindⅢ双酶切得到约1 665 bp和5 369 bp片段,与预期结果一致(图2),证明ROP18基因被完整插入表达载体pET-28a(+)中。

图2 ROP18/pET28a(+)重组质粒双酶切鉴定结果Fig 2 Identification of ROP18/pET28a(+)by restriction enzyme digestion
2.3 重组蛋白ROP18表达纯化
重组蛋白主要以包涵体形式存在,经 KCl染色(图3),可见相对分子质量67×103处有目的蛋白表达带,与ROP18蛋白理论预测值大小一致。采用切胶法纯化蛋白,将目的蛋白条带切下,经SDSPAGE电泳检测分析,可见67×103处一条目的蛋白回收带 (图4),此即为纯化的目的蛋白。
2.4 弓形虫速殖子ROP18的表达
经蛋白质印迹检测发现,免疫兔血清能识别相对分子质量为 55×103的反应条带(图 5),与ROP18相对分子质量值相符,表明采用KCl染色切胶法纯化蛋白方法可行,并且制备的兔多克隆抗体特异性较好。
2.5 弓形虫速殖子ROP18的分布
荧光显微镜下观察到ROP18蛋白的绿色荧光分布于弓形虫速殖子细胞核前端,与棒状体位置一致,与细胞核蓝色荧光不重合,A、B融合图可以清楚地定位ROP18蛋白在虫体内的分布(图 6)。

图3 重组ROP18蛋白KCl染色Fig 3 Recombinant ROP18 by KCl stain

图4 重组ROP18蛋白纯化结果SDS-PAGE分析Fig 4 Purification of recombinant ROP18 by SDS-PAGE analysis

图5 蛋白质印迹法检测弓形虫速殖子ROP18表达Fig 5 Western blotting analysis of ROP18 expression in T.gondii

图6 IFA检测弓形虫速殖子ROP18蛋白表达(×1 000)Fig 6 ROP18 expression in T.gondii tachyzoites by IFA
3 讨论
弓形虫ROP18是丝氨酸/苏氨酸蛋白激酶,具有激酶活性,是弓形虫的关键毒力因子[10-11]。对ROP18进行序列分析发现,它和ROP2家族中的另一成员ROP5最接近,有28%的同源性,和ROP2有25%的同源性[6],在RH株虫体中可以大量表达,相对分子质量约为55×103。已有研究发现,ROP18定位于弓形虫纳虫泡膜(parasitophorous vacuole membrane,PVM)[12],宿主体内 γ 干扰素可诱导机体产生免疫相关GTP酶(IRGs)因子,其中IRG6因子可自动聚积于PVM上,造成PVM损害,使虫体失去保护膜,从而使得机体免疫系统杀死PVM中的虫体[13]。而ROP18可与IRG6结合,使其磷酸化而丧失活性,不能聚积于PVM上,无法破坏弓形虫周围的保护膜,从而使虫体逃避宿主免疫系统的清除,保护PVM中虫体存活并正常生长繁殖[14]。
本研究采用原核表达系统,成功获得了重组弓形虫ROP18,经纯化后免疫家兔,制备了抗ROP18多克隆抗体;采用IFA和蛋白质印迹技术检测了ROP18在虫体中的分布和表达,为进一步研究ROP18在弓形虫入侵及生长繁殖中的作用提供了技术支撑。
本研究中对于表达的包涵体蛋白纯化方法,起初使用常规的Ni-NTA亲和层析法,但出现目的蛋白与Ni-NTA层析柱不结合的情况,造成目的蛋白的大量丢失,不能很好地纯化目的蛋白。本研究通过KCl染色切胶法纯化蛋白,获得了高浓度的目的蛋白,并成功免疫家兔,制备了相应的抗ROP18多克隆抗体,经ELISA技术检测证实此抗体具有较高的滴度;应用蛋白质印迹技术可以验证在55×103处有特异性条带。以上结果表明,通过KCl染色切胶法回收的ROP18蛋白仍保留天然蛋白的一级结构,从而保持了ROP18蛋白的抗原性。与传统的纯化包涵体蛋白方法相比,KCl染色切胶纯化法具有以下优点,①简单易行:实验步骤简单,避免了多次洗脱亲和层析柱的繁琐工作;② 经济实用:所用试剂数量少且普通,易得便宜,降低了实验成本;③快速省时:实验时间明显缩短,节省了实验时间。但不适用于纯化表达量较低的蛋白。KCl染色切胶免疫方法的应用为包涵体形式存在蛋白的多克隆抗体制备提供了一种便利方法,所分离的蛋白纯度高、量大,不仅为进一步研究蛋白的结构和生物学分析提供了技术支持;而且在乳化抗原中可以缓慢释放抗原,有效发挥免疫佐剂的作用[15-16]。有研究已证实切胶免疫还能满足单克隆抗体制备的要求[17-18]。因此,KCl染色切胶回收蛋白是一种可行的方案,值得应用推广。
[1] Dubey JP.The history of Toxoplasma gondii-the first 100 years[J].J Eukaryot Microbiol,2008,55(6):467-475.
[2] Joiner KA,Dubremetz JF.Toxoplasma gondii:a protozoan for the nineties[J].Infect Immun,1993,61(4):1169-1172.
[3] Fleige T,Limenitakis J,Soldati-Favre D.Apicoplast:keep it or leave it[J].Microbes Infect,2010,12(4):253-262.
[4] El Hajj H,Demey E,Poncet J,et al.The ROP2 family of Toxoplasma gondii rhoptry proteins:proteomic and genomic characterization and molecular modeling[J].Proteomics,2006,6(21):5773-5784.
[5] 刘苗苗,周鹏,朱兴金.弓形虫棒状体蛋白的研究进展[J].中国兽医科学,2008,38(5):443-446.
[6] El Hajj H,Lebrun M,Arold S,et al.ROP18 is a rhoptry kinase controlling the intracellular proliferation of Toxoplasma gondii[J].PLoS Pathog,2007,3(2):e14.
[7] 吴亮,陈盛霞,李琳婕,等.刚地弓形虫RH株速殖子在 HeLa细胞系体外培养的实验观察[J].中国寄生虫学与寄生虫病杂志,2008,26(6):452-456.
[8] J.萨姆布鲁克,拉塞尔DW.分子克隆实验指南[M].3版.黄培堂译.北京:科学出版社,2002:1716-1720.
[9] 姜旭淦,朱敏娟,葛彦文,等.Ⅱ型胶原蛋白抗血清的制备和检测[J].江苏大学学报:医学版,2008,18(1):34-38.
[10] Fentress SJ,Steinfeldt T,Howard JC,et al.The arginine-rich N-terminal domain of ROP18 is necessary for vacuole targeting and virulence of Toxoplasma gondii[J].Cell Microbiol,2012,14(12):1921 -1933.
[11] Behnke MS,Fentress SJ,Mashayekhi M,et al.The polymorphic pseudokinase ROP5 controls virulence in Toxoplasma gondiiby regulating theactive kinase ROP18[J].PLoS Pathog,2012,8(11):e1002992.
[12] Sinai AP.The Toxoplasma kinase ROP18:an active member of a degenerate family[J].PLoS Pathog,2007,3(2):e16.
[13] Steinfeldt T,Künen-Waisman S,Tong L,et al.Phosphorylation of mouse immunity-related GTPase(IRG)resistance proteins is an evasion strategy for virulent Toxoplasma gondii[J].PLoS Biol,2010,8(12):e1000576.
[14] Fentress SJ,Behnke MS,Dunay IR,et al.Phosphorylation of immunity-related GTPases by a Toxoplasma gondii secreted kinase promotes macrophage survival and virulence[J].Cell Host Microbe,2010,8(6):484 -495.
[15] 姜静,孙其飞,陈勇,等.切胶免疫制备腮腺液高丰度蛋白多克隆抗体[J].北京口腔医学,2007,15(5):254-256.
[16] 于在江,马学恩,周建华.切胶纯化表达蛋白包涵体的可行性分析[J].生物技术,2007,17(3):46-48.
[17] 陈鸿军,宋翠萍,秦爱建,等.MDV-1 VP22羧基端在大肠杆菌中高效可溶性表达[J].中国病毒学,2006,21(2):862-864.
[18] 宋翠萍,陈鸿军,秦爱建,等.抗MDV-1 VP22羧基端单克隆抗体的制备与免疫学特性鉴定[J].细胞与分子免疫学杂志,2007,23(3):249-252.

