基于口服免疫耐受原理的人肿瘤小鼠荷瘤模型的建立
刘霞,成静,范兴文,周小兵,周丹,吴卫疆,华晔,邵启祥
(1.江苏大学基础医学与医学技术学院,江苏镇江212013;2.江苏大学附属医院普外科,江苏镇江212001;3.江苏大学附属医院肿瘤科,江苏镇江212001)
肿瘤的发病原因和发生机制尚不完全清楚。因此,建立人类肿瘤的动物模型对研究肿瘤的发生机制和防治措施具有十分重要的意义。目前,肿瘤的动物模型大多是采用裸鼠、严重联合免疫缺陷(SCID)等动物接种人类肿瘤细胞系而建立的;此外,通过给动物局部注射化学致癌剂也可诱发肿瘤。这两种动物模型都有一定的缺点,首先,两者均不符合肿瘤自然发生的模式。其次,前者的实验动物价格昂贵,饲养环境要求高,易发生感染,影响实验结果;后者接受的化学致癌剂的剂量在自然环境中几乎是不可能的,其诱导的肿瘤类型比较单一,而且大量致癌剂的使用会造成环境污染。此外,还有一些采用基因修饰的肿瘤模型,与自然发生的肿瘤相差更远[1-2]。本研究拟利用口服免疫耐受的原理,建立一种简便、经济的特异性人肝癌小鼠模型。
1 材料与方法
1.1 材料
人肝癌HepG2细胞系(江苏大学药学院高静教授惠赠)和人卵巢癌3AO细胞系 (上海市肿瘤研究所覃文新研究员惠赠),用100 mL/L小牛血清DMEM培养液自行传代培养。90只清洁级昆明种小鼠、6~8周龄,由江苏大学实验动物中心提供。实验动物生产许可证:SCXK(苏)2009-0002;实验动物使用许可证:SYXK(苏)2008-0024。
1.2 方法
1.2.1 动物分组 将90只小鼠按随机数字表法分为空白对照组、无关肿瘤对照组和肿瘤模型组,每组30只。
1.2.2 基于口服免疫耐受的人肿瘤小鼠模型的建立
肿瘤模型组:小鼠以人肝癌HepG2细胞系(2×106个细胞/d)灌胃,连续7 d;无关肿瘤对照组:以同样数量的人卵巢3AO细胞系连续灌胃7 d;空白对照组以等体积的生理盐水连续灌胃7 d。然后,3组小鼠均于背部皮下接种HepG2细胞2×106/L。观察并记录肿瘤出现时间、肿瘤体积、肿瘤湿重、肿瘤生长速度、小鼠体质量及生活习性的改变等。肿瘤的大小以游标卡尺每三天测量1次。按照文献[3],采用公式V=ab2/2(V=肿瘤体积,a=瘤体最长径,b=瘤体最短径)计算肿瘤体积。
1.2.3 肿瘤组织的病理学检查 于肿瘤细胞接种后不同时间处死小鼠,剥离瘤体,去除四周脂肪组织,称量肿瘤的重量,然后依次经100 g/L甲醛溶液固定、常规脱水、石蜡包埋、切片及HE染色,光镜下观察。
2 结果
2.1 肿瘤模型的建立
肿瘤模型组小鼠以HepG2细胞灌胃7 d后,皮下接种HepG2细胞的致瘤率达90%(27/30),平均潜伏期为10 d(图1)。无关肿瘤对照组和空白对照组灌胃7 d后皮下接种HepG2细胞,均未见肿瘤形成(图2)。
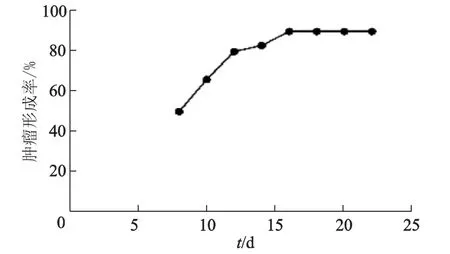
图1 注射肝癌细胞后的肿瘤形成率Fig 1 Incidence of tumor formation after cells injection
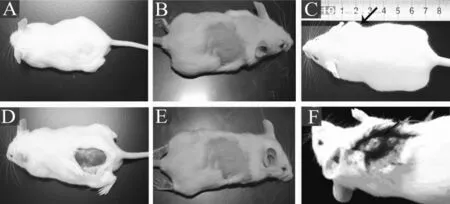
图2 3组小鼠形成的肿瘤外观Fig 2 Appearance changes of tumor formation in three groups
2.2 肿瘤的生长特点
肿瘤模型组小鼠皮下注射HepG2细胞后7~10 d,注射部位可触及实质性包块,在接种后12~20 d时,处于快速生长期(图3)。随着肿瘤的生长,肿瘤的湿重不断增加,但到后期(20 d后),由于肿瘤发生坏死,肿瘤体积增长缓慢,甚至缩小(表1)。初期肿瘤表面一般有被膜,在晚期因肿瘤向深层肌肉浸润而无明显界限;肿瘤组织与皮肤黏连,皮肤可发生破溃或坏死,出现结痂(图2F)。
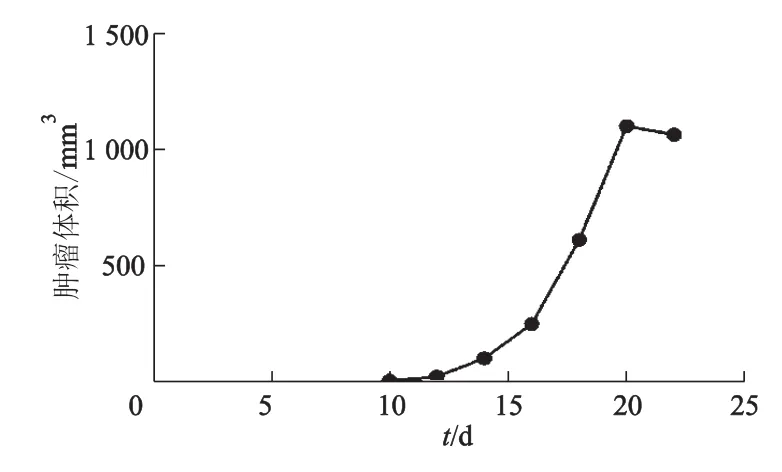
图3 注射HepG2细胞后小鼠体内肿瘤生长速度Fig 3 The growth rate of HepG2 cells in mice
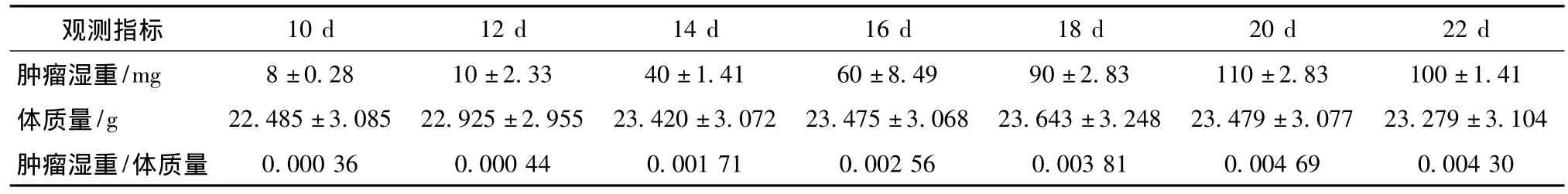
表1 接种HepG2细胞后不同时间肿瘤湿重、小鼠体质量以及两者之比的关系Tab 1 The relationship between tumor weight,body weight and the ratio at different time after HepG2 cells injection
2.3 肿瘤组织的病理学检查
经HE染色后于显微镜下观察,在毛细血管周围,肿瘤细胞呈团状(癌巢)或呈散在分布。肿瘤细胞的核较大,形态不一,核深染,核膜增厚,染色质增多且分布不均匀。无关肿瘤对照组和空白对照组小鼠接种1周后接种处组织病理切片显示仍有残存的肿瘤细胞;接种2周后肿瘤细胞几乎被小鼠机体的免疫系统清除,局部有大量浸润的淋巴细胞与中性粒细胞,以及少数呈空泡状的肿瘤细胞。见图4。
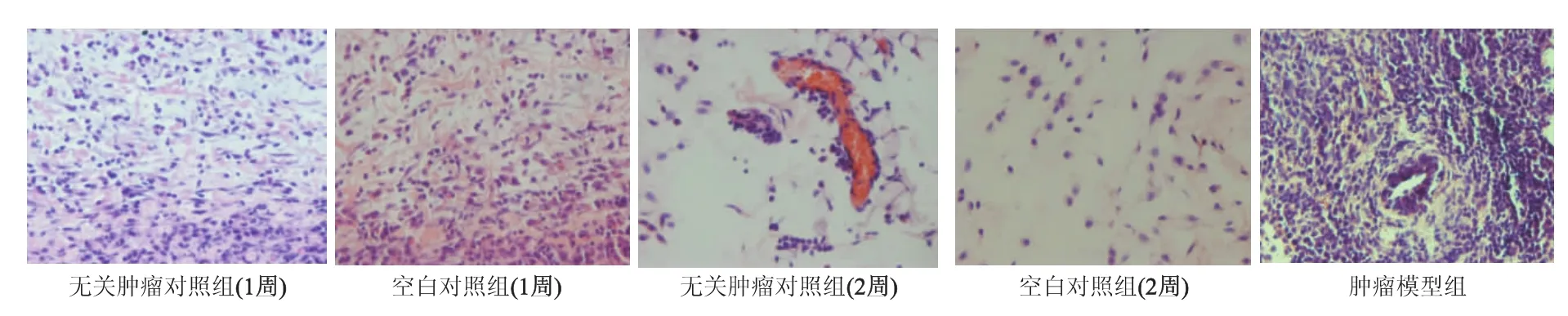
图4 各组小鼠肿瘤组织病理形态(HE染色×400)Fig 4 Pathological changes of tumor tissues in different groups
3 讨论
口服耐受是指口服某种抗原后,诱导局部肠相关淋巴组织(gut associated lymphoid tissues,GALT)的特异性免疫,从而抑制全身对该抗原的特异性免疫应答,但机体对其他抗原仍可产生正常的免疫性应答[4]。抗原口服后,首先接触到的是GALT中的树突状细胞(dendritic cells,DCs)。DCs捕获抗原,处理后提呈给局部的T细胞,并诱导其分化为调节性 T细胞(regulatory T cells,Treg细胞),Treg细胞可诱导机体对相应抗原产生全身性免疫耐受[2,5]。根据这一原理,我们假设通过口服免疫耐受途径可诱导肿瘤抗原对相应的肿瘤细胞产生免疫耐受。本实验给予小鼠较高剂量的人肝癌HepG2细胞系(2×106/L)连续灌胃7 d,试图诱导小鼠对HepG2细胞产生特异性免疫耐受,然后再于背部皮下接种HepG2细胞。结果显示,经HepG2细胞灌胃的小鼠对接种的HepG2细胞不产生免疫排斥反应,并可在其体内生长形成肿瘤结节;采用人卵巢癌3AO细胞系灌胃的小鼠对接种的HepG2细胞无容受性,不能在小鼠体内生长形成肿瘤。上述结果表明,通过口服免疫可诱导出相应肿瘤细胞的特异性免疫耐受。基于口服免疫耐受的原理,建立肿瘤动物模型尚未见类似的报道。
口服抗原诱导抗原特异性免疫耐受的方法,现已广泛应用于自身免疫性疾病、食物过敏及器官移植等疾病的治疗研究[6-8]。例如,口服胰岛来源的自身抗原治疗1型糖尿病[9];口服糖基化鸡2型胶原(UC-2,10 mg/d)治疗类风湿关节炎(女性患者)[10];口服尘螨抗原治疗过敏反应[11];口服牛Ⅱ型胶原(CⅡ)治疗幼年性类风湿关节炎[12];口服耐受抑制实验性卵巢早衰抗透明带抗体的产生[13];口服同源脊髓匀浆诱导昆明鼠耐受,治疗实验性自身免疫性脑脊髓炎[14]等。
本研究基于口服免疫耐受的机制建立的人肿瘤动物荷瘤模型,比较符合自然过程发生的肿瘤,且可以较好地模拟肿瘤的病理过程,便于肿瘤发生机制和防治的研究。此外,该模型的制备操作简便,成瘤率高,成本较裸鼠和SCID小鼠低,便于推广。
[1] Liu J,Johnston MR.Experimental animal models for studying lung cancer and evaluating novel intervention strategies[M]∥Keshamouni V,Arenberg D,Kalemkerian G.Lung cancer metastasis:novel biological mechanisms and impact on clinical practice.New York:Springer,2009:241-265.
[2] Park KS,Park MJ,Cho ML,et al.TypeⅡ collagen oral tolerance;mechanism and role in collagen-induced arthritis and rheumatoid arthritis[J].Mod Rheumatol,2009,19(6):581-589.
[3] 张煜,徐涵文,张太平,等.注射法制作ICR小鼠肝癌模型及其改进[J].细胞生物学杂志,2007,29(3):434-438.
[4] 解德琼,甘华,杜小刚.口服免疫耐受研究进展[J].国外医学:泌尿系统分册,2005,25(1):111-114.
[5] Spiekermann GM,Walker WA.Oral tolerance and its role in clinical disease[J].J Pediatr Gastroenterol Nutr,2001,32(3):237-255.
[6] Castro-Sánchez P,Martín-Villa JM.Gut immune system and oral tolerance[J].Br J Nutr,2013,109(Suppl 2):3-11.
[7] Ishida W,Fukuda K,Harada Y,et al.Oral administration of Ag suppresses Ag-induced allergic conjunctivitis in mice:critical timing and dose of Ag[J].Br J Ophthalmol,2013,97(4):492-497.
[8] Birmingham JM,Patil S,Li XM,et al.The effect of oral tolerance on the allergic airway response in younger and aged mice[J].J Asthma,2013,50(2):122-132.
[9] Martinez NR,Augstein P,Moustakas AK,et al.Disabling an integral CTL epitope allows suppression of autoimmune diabetes by intranasal proinsulin peptide[J].J Clin Invest,2003,111(9):1365-1371.
[10] Bagchi D,Misner B,Bagchi M,et al.Effects of orally administered undenatured typeⅡcollagen against arthritic inflammatory diseases:a mechanistic exploration[J].Int J Clin Pharmacol Res,2002,22(3/4):101-110.
[11] Sato MN,Carvalho AF,Silva AO,et al.Oral tolerance induced to house dust mite extract in naive and sensitized mice:evaluation of immunoglobulin G anti-immunoglobulin E autoantibodies and lgG-IgE complexes[J].Immunology,1998,95(2):193-199.
[12] Myers LK,Higgins GC,Finkel TH,et al.Juvenile arthritis and autoimmunity to typeⅡ collagen[J].Arthritis Rheum,2001,44(8):1775-1781.
[13] 付莉,黄冰玉,赵怡璇,等.口服耐受对实验性卵巢早衰抗透明带抗体的抑制作用研究[J].现代妇产科进展,2006,15(9):681-683.
[14] 鲍健,胡学强.经消化道诱导昆明鼠耐受实验性自身免疫性脑脊髓炎[J].中国免疫学杂志,2005,21(3):224-225.

