炎症环境下巨噬细胞对小鼠骨髓间质干细胞迁移能力的影响
高硕,蔡梦洁,毛飞,杨婷婷,张洁,张玲,赵露露,坎吉克孜·阿不来提,钱晖,许文荣
(江苏大学基础医学与医学技术学院,江苏镇江212013)
间质干细胞(mesenchymal stem cells,MSCs)是存在于大部分组织中的具有高度自我更新和多向分化潜能的成体干细胞[1]。在组织损伤等病理条件下,MSCs可以被动员到损伤部位,进而发挥抗炎和促损伤修复等作用[2],我们前期的研究发现,MSCs
能在多种疾病模型如胶原诱导的小鼠关节炎[3]、肾缺血再灌注损伤[4]以及肝纤维化[5]中发挥治疗作用。组织损伤往往伴有炎症反应和免疫细胞的活化[6]。巨噬细胞作为炎症反应的中心效应细胞和调节细胞,分泌多种细胞因子和趋化因子,是损伤局部微环境中关键因子的主要来源。因此,间质干细胞与巨噬细胞的相互作用逐渐成为研究的热点。有研究表明,MSCs可以在心肌梗死[7]和脊髓损伤[8]
等疾病模型中影响巨噬细胞的表型和功能,从而发挥积极的治疗作用。我们在前期的研究中也发现,
MSCs在体内能诱导巨噬细胞向M2型极化并影响其迁移数量,从而修复小鼠肾缺血再灌注损伤[9]。间质干细胞的迁移、活化以及功能的发挥均受到微环境的影响,而目前关于损伤环境下MSCs的迁移机制仍然不十分清楚。基于前期结果,我们考虑具有广泛分泌功能的巨噬细胞可能对MSCs的迁移能力和功能发挥起到一定的作用。本实验从炎性巨噬细胞角度出发,研究其对小鼠骨髓间质干细胞迁移功能的影响及细胞因子表达的改变,探寻炎症条件下MSCs募集的机制,为进一步探讨MSCs对于炎症环境的反应及其抗炎和促损伤修复作用的机制提供实验依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂 低糖 DMEM培养基、高糖DMEM培养基、胎牛血清(Gibco公司);细胞培养瓶(Nunc,Damerk公司);6孔板、transwell嵌合板(0.4 μm,8 μm)(Corning 公司);脂多糖(LPS,BY08069,Sigma-Aldrich公司);总RNA提取试剂 Trizol(Invitrogen公司);SYBR®Green实时定量PCR反应体系(ToYoBo公司),反转录试剂盒(Thermo Scientific公司)。
1.1.2 主要仪器 超净工作台(苏州净化厂),二氧化碳培养箱(Forma公司),倒置式生物显微镜(Nikon公司),PCR仪、台式离心机(Eppendorf公司),CFX96定量PCR仪(Bio-Rad公司)。
1.2 方法
1.2.1 小鼠骨髓间质干细胞的分离培养 分离方法参照之前报道[10]。6~8周雄性BALB/c小鼠购自扬州大学比较医学中心。断颈处死小鼠,乙醇浸泡消毒2 min后在超净台中取股骨,PBS冲出骨髓细胞,洗涤1次后用含15%胎牛血清的低糖DMEM培养液重悬,以5×106/mL密度接种于细胞培养瓶中,置5%CO2,饱和湿度37℃的培养箱中培养。4 d后换液去除非贴壁细胞,以后每隔3天换液。待细胞生长至80%~90%融合度时消化传代,倒置显微镜观察细胞生长状态,经成骨成脂诱导分化鉴定后,3~5代的MSC用于下一步实验。
1.2.2 巨噬细胞株RAW264.7的活化 小鼠巨噬细胞株RAW264.7购自中国科学院上海细胞库。将RAW264.7以2×105/mL密度接种于6孔板中,LPS(1 μg/mL)刺激12 h,显微镜下观察细胞形态。PBS洗涤后直接收集每孔RAW264.7细胞于1 mL Trizol试剂中,-70℃保存。
1.2.3 RAW264.7与MSCs共培养实验 MSCs以2×105/孔的密度接种于6孔板中,贴壁过夜后加入Transwell嵌合板(0.4 μm),上室中加入的作用因素分别为正常培养液对照、RAW264.7细胞、含LPS的培养液以及 LPS刺激的 RAW264.7细胞。RAW264.7细胞数量与MSCs相同,LPS终质量浓度为1 μg/mL,作用12 h后直接收集下室每孔中的MSCs于1 mL Trizol试剂中,-70℃保存。
1.2.4 迁移实验 在Transwell趋化小室(8 μm)上室种入含1×105MSCs的细胞悬液100 μL,下室的作用因素分别为正常培养液对照、RAW264.7细胞、含LPS的培养液以及LPS刺激的RAW264.7细胞。RAW264.7预先以1×105/孔的密度接种于24孔板中,培养液体积为600 μL,待细胞贴壁后在相应组别中加入LPS(1 μg/mL)。细胞置5%CO2,饱和湿度37℃的培养箱中培养12 h后将小室取出,擦去小室内细胞,PBS洗涤2次后用甲醇固定30 min,再用PBS洗涤1次,放入结晶紫染料中染色15 min,洗涤后计数拍照。
1.2.5 总RNA提取 将方法1.2.2和1.2.3中收集得到的标本进行总RNA提取。采用酚氯仿抽提法,紫外分光光度计检测RNA溶液D(260/280 nm)比值均在1.8~2.0之间。参照说明书进行反转录反应,cDNA保存于-20℃备用。
1.2.6 RT-PCR检测LPS刺激的RAW264.7表达炎症因子和趋化因子的变化 反应体系为25 μL,包括 cDNA 1 μL、10 × 缓冲液 2.5 μL、dNTP(10 mmol/L)0.5 μL、rTaq 酶 0.2 μL、上下游引物各 0.5 μL,ddH2O补足至25 μL。30个循环后取扩增产物8 μL,与 2 μL 6 × 上样缓冲液均匀混合后加样于1.5%琼脂糖凝胶中进行电泳,EB染色后用凝胶成像系统观察拍照。
1.2.7 实时荧光定量PCR检测共培养条件下MSCs的TGF-β1、IL-6及 MCP-1 mRNA 表达 反应体系包括:cDNA 1 μL、上下游引物各 0.4 μL(10 μmol/L),Taq DNA 聚合酶 0.1 μL,10 μL 2 × SYBG Mix及8.1 μL去RNA酶的水。反应循环数为35。β-肌动蛋白作为内参,采用绝对定量的分析方法对结果进行计算。各引物序列见表1。
1.3 统计分析
实验数据用GraphPad Prism 5.0软件分析处理。两组间比较采用t检验;多组比较采用单因素方差分析,进一步两两比较用SNK-q检验,P<0.05为差异有统计学意义。

表1 基因引物序列Tab1 Primer sequences of target genes
2 结果
2.1 小鼠骨髓间质干细胞的分离和体外扩增
原代培养的小鼠骨髓间质干细胞呈克隆性生长,贴壁,可见多角形和圆形细胞;传代后的MSCs贴壁生长,以梭形为主,生长较均一。见图1。
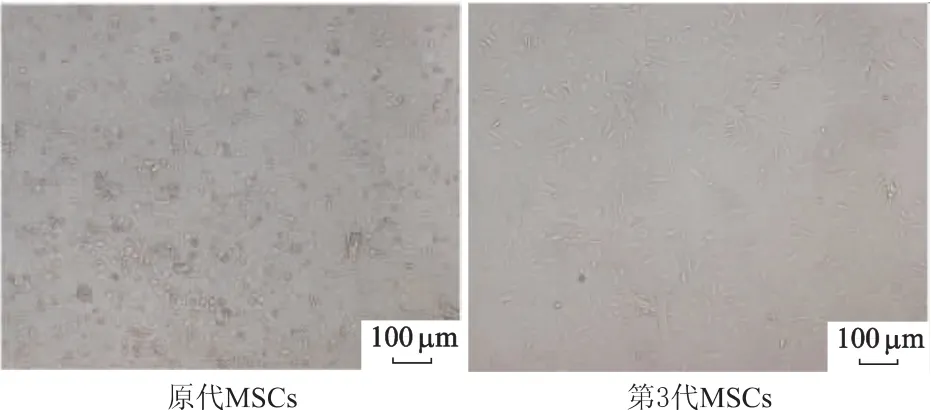
图1 小鼠骨髓间质干细胞形态特征(×100)Fig 1 Cell appearance of mouse bone marrow MSCs
2.2 LPS活化的RAW264.7在 mRNA水平高表达IL-6、TNF-α、IL-1β 和 MCP-1
小鼠巨噬细胞株RAW264.7正常状态下大部分呈圆形,贴壁生长;从400倍放大的图片中可以看到,当受到LPS刺激后,细胞胞体变大,有伪足,胞质内有空泡(图2箭头所示)。从形态变化上看,与对照组静息状态下的巨噬细胞相比,LPS组巨噬细胞已经明显活化。

图2 小鼠巨噬细胞株RAW264.7在LPS刺激后的形态特征Fig 2 Appearance of RAW264.7 under the stimulation of LPS
RT-PCR电泳结果显示,正常培养条件下的RAW264.7细胞不表达IL-6和IL-1β,低表达TNF-α和MCP-1。而LPS刺激后的RAW264.7细胞与对照组比较,IL-6(t=14.22,P <0.001)、TNF-α(t=33.6,P <0.001)、IL-1β(t=4.589,P <0.05)和 MCP-1(t=4.836,P<0.01)在 mRNA水平均显著升高,见图3。RAW264.7单独作用组和 LPS单独作用组比,在LPS刺激的条件下RAW264.7能显著增加MSCs迁移的数量,差异有统计学意义(q=9.457,P<0.001和q=12.79,P<0.001)。见图4。
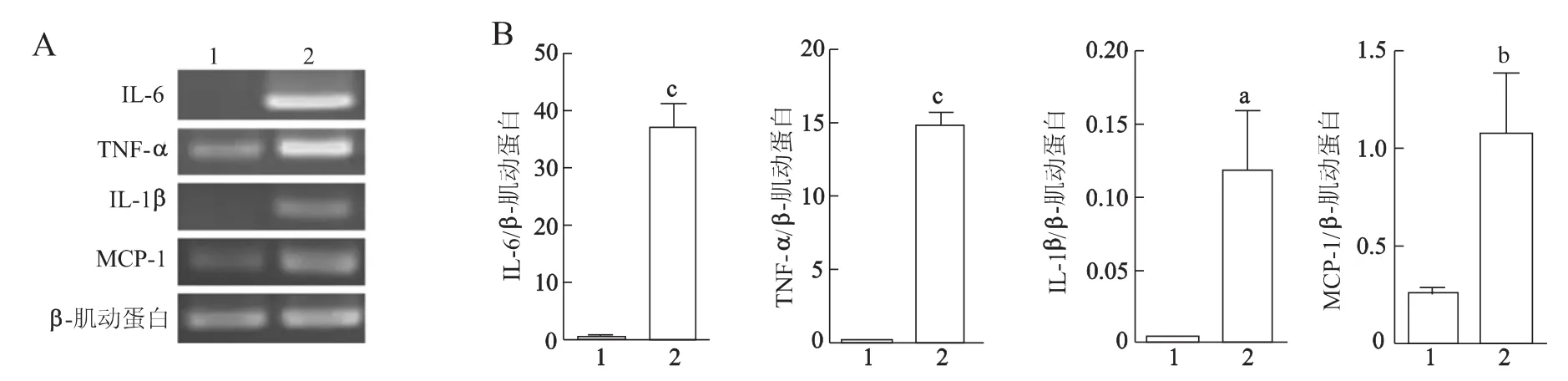
图3 LPS对RAW264.7细胞表达炎症因子的影响Fig 3 Effect of LPS on the inflammatory cytokine expression of RAW264.7

图4 RAW264.7在炎性环境下对MSC迁移能力的影响(结晶紫染色×200)Fig 4 Effect of RAW264.7 on the migration of MSC in inflammation
2.3 炎性条件下RAW264.7增加MSCs迁移数量
对Transwell小室底部迁移的细胞进行显微镜下计数,结果显示,与培养液对照相比,RAW264.7可诱导 MSCs的迁移(q=4.966,P<0.01)。与
2.4 炎性条件下RAW264.7增加MSCs的TGF-β1、IL-6和MCP-1 mRNA表达水平
荧光实时定量 PCR结果显示,LPS刺激后MSCs高表达IL-6(q=6.062,P<0.01)和MCP-1(q=4.405,P <0.05),TGF-β1 变化不明显(P >0.05)。而在 LPS存在的条件下,RAW264.7与MSCs共培养能显著增加 MSCs的 TGF-β1(q=4.287,P <0.05)、IL-6(q=6.836,P <0.01)和MCP-1(q=18.33,P<0.001)mRNA表达水平。见图5。

图5 炎性环境下RAW264.7对MSCs表达TGF-β1、IL-6以及MCP-1基因的影响Fig 5 Effect of RAW264.7 on the expression of TGF-β1、IL-6 and MCP-1 genes of MSCs in inflammation
3 讨论
间质干细胞来源于如骨髓、脂肪组织、肌肉组织以及脐带华通胶等多种组织,具有多向分化潜能,在不同的刺激和培养条件下能分化为成骨细胞、软骨细胞、肌肉细胞以及脂肪细胞[11]。近年来越来越多的研究发现了MSCs在组织修复再生中的积极作用,使其成为细胞治疗中十分具有前景的选择[12]。在组织损伤过程中,除了多向分化能力外,MSCs也具有抗炎和免疫调节作用,从而参与炎症消退和组织再生。
间质干细胞的另一重要生物学特征是对局部环境的感知和反应。损伤环境可以刺激MSCs的活化,促进损伤局部和骨髓的MSCs募集到损伤部位,并分泌一系列可溶性因子,如前列腺素E2(PGE2)、吲哚胺2,3-双加氧酶(IDO)、IL-6及IL-10。这些因子作用于免疫细胞,从而发挥抗炎和免疫调节作用[13]。本实验选取小鼠巨噬细胞为切入点,研究在LPS刺激的条件下巨噬细胞对MSCs迁移和细胞因子基因表达的影响。
目前在巨噬细胞对MSCs迁移能力的研究中存在着不同的观点。Anton等[14]研究指出巨噬细胞条件培养上清含有IL-8、MCP-1等趋化因子,能够促进MSCs的迁移,并使MSCs高表达IL-6和 CXCL10。而在Chen等[15]的研究中,诱导的单核细胞来源的巨噬细胞培养上清则能减少MSCs的迁移数量。本研究的不同点在于选择RAW264.7细胞与小鼠骨髓MSCs体外 Transwell间接共培养,并且加入了LPS作为刺激因素,探讨了在LPS存在的条件下巨噬细胞对MSCs迁移能力的影响和细胞因子表达的改变。研究结果表明,LPS刺激使RAW264.7细胞在基因水平高表达炎症因子IL-6、TNF-α、IL-1β和MCP-1,RAW264.7细胞能促进MSCs的迁移,这与Anton等的研究结果类似。而在LPS刺激条件下,RAW264.7细胞的这种作用则显著增强,这可能与活化的巨噬细胞分泌的细胞因子发生改变有关。除了迁移能力,我们也观察了LPS存在下巨噬细胞对MSCs表达细胞因子(TGF-β1、IL-6 及 MCP-1)的影响。我们发现在炎症条件下,活化的巨噬细胞能在基因水平显著增加 MSCs表达 TGF-β1、IL-6和MCP-1,即巨噬细胞可以在炎性环境下改变MSCs部分细胞因子的表达模式。有研究表明TGF-β1在组织重建的过程中能够调控间质干细胞的募集[16],而IL-6虽为炎症因子,却有促进细胞迁移和血管生成的作用[17-18]。作为典型的趋化因子,MCP-1能够趋化单核细胞到达炎症部位。也有研究认为MCP-1在间质干细胞的趋化中发挥重要作用[19]。尚需进一步实验证明是否这些因子在巨噬细胞促进MSCs迁移过程中发挥直接作用,是否活化的巨噬细胞使MSCs自分泌增强也是其促迁移的机制之一。
综上所述,我们的研究初步探讨了炎症环境下巨噬细胞对小鼠骨髓间质干细胞迁移和部分细胞因子表达的影响,在今后的研究中我们将进一步关注炎性巨噬细胞影响MSCs迁移过程中的关键因子,以及体内炎症或损伤微环境下巨噬细胞参与的MSCs迁移和修复作用,从而为探讨MSCs在组织损伤修复过程中作用机制提供实验依据。
[1] Caplan AI.Mesenchymal stem cells[J].J Orthop Res,1991,9(5):641-650.
[2] Shi Y,Su J,Roberts AI,et al.How mesenchymal stem cells interact with tissue immune responses[J].Trends Immunol,2012,33(3):136 -143.
[3] Mao F,Xu WR,Qian H,et al.Immunosuppressive effects of mesenchymal stem cells in collagen-induced mouse arthritis[J].Inflamm Res,2010,59(3):219 -225.
[4] Chen Y,Qian H,Zhu W,et al.Hepatocyte growth factor modification promotes the amelioration effects of human umbilical cord mesenchymal stem cells on rat acute kidney injury[J].Stem Cells Dev,2011,20(1):103 -113.
[5] Xu H,Qian H,Zhu W,et al.Mesenchymal stem cells relieve fibrosis of Schistosoma japonicum-induced mouse liver injury[J].Exp Biol Med(Maywood),2012,237(5):585-592.
[6] Medzhitov R.Origin and physiological roles of inflammation[J].Nature,2008,454(7203):428-435.
[7] Dayan V,Yannarelli G,Billia F,et al.Mesenchymal stromal cells mediate a switch to alternatively activated monocytes/macrophages after acute myocardial infarction[J].Basic Res Cardiol,2011,106(6):1299 -1310.
[8] Nakajima H,Uchida K,Guerrero AR,et al.Transplantation of mesenchymal stem cells promotes an alternative pathway of macrophage activation and functional recovery after spinal cord injury[J].J Neurotrauma,2012,29(8):1614-1625.
[9] Li W,Zhang Q,Wang M,et al.Macrophages are involved in the protective role of human umbilical cord-derived stromal cells in renal ischemia-reperfusion injury[J].Stem Cell Res,2013,10(3):405 -416.
[10] 毛飞,高硕,钱晖,等.LacZ转基因小鼠间充质干细胞的分离培养和生物学特性研究[J].临床检验杂志,2011,29(7):542-544.
[11] Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.
[12] Caplan AI.Adult mesenchymal stem cells for tissue engineering versus regenerative medicine[J].J Cell Physiol,2007,213(2):341 -347.
[13] Singer NG,Caplan AI.Mesenchymal stem cells:mechanisms of inflammation [J].Annu Rev Pathol,2011,6:457-478.
[14] Anton K,Banerjee D,Glod J.Macrophage-associated mesenchymal stem cells assume an activated,migratory,pro-inflammatory phenotype with increased IL-6 and CXCL10 secretion[J].PLoS One,2012,7(4):e35036.
[15] Chen C,UludagˇH,Wang Z,et al.Macrophages inhibit migration,metabolic activity and osteogenic differentiation of human mesenchymal stem cells in vitro[J].Cells Tissues Organs,2012,195(6):473-483.
[16] Zhang F,Tsai S,Kato K,et al.Transforming growth factor-β promotes recruitment of bone marrow cells and bone marrow-derived mesenchymal stem cells through stimulation of MCP-1 production in vascular smooth muscle cells[J].J Biol Chem,2009,284(26):17564-17574.
[17] Wan M,Li C,Zhen G,et al.Injury-activated transforming growth factor β controls mobilization of mesenchymal stem cells for tissue remodeling[J].Stem Cells,2012,30(11):2498-2511.
[18] Yew TL,Hung YT,Li HY,et al.Enhancement of wound healing by human multipotent stromal cell conditioned medium:the paracrine factors and p38 MAPK activation[J].Cell Transplant,2011,20(5):693 -706.
[19] Botto S,Streblow DN,DeFilippis V,et al.IL-6 in human cytomegalovirus secretome promotes angiogenesis and survival of endothelial cells through the stimulation of survivin[J].Blood,2011,117(1):352 -361.

