近红外光谱法测定麦芽中的β-葡聚糖
周青梅,郭立芸,林智平
(北京燕京啤酒股份有限公司,北京,101300)
近10年来,近红外分析技术已应用于啤酒制麦行业,对大麦粗蛋白、水分进行分析,获得较好的研究结果。但是采用近红外分析技术在测定麦芽β-葡聚糖含量,快速了解胚乳细胞壁溶解状况的研究尚未见报道。麦芽中的β-葡聚糖是反应麦芽溶解状况的重要指标,成品麦芽中β-葡聚糖含量高,说明麦芽细胞壁分解不完全,会影响淀粉和蛋白质的分解,使麦汁组成不合理,导致发酵时酵母营养不良,过滤困难,β-葡聚糖沉淀等问题[1]。另一方面,适量的β-葡聚糖存在是构成啤酒酒体和泡沫的主要成分。与传统分析技术相比,近红外分析具有无损检测,分析效率高,分析速度快,分析成本低,重现性好,样品测量一般不需预处理,光谱测量方便,适合于现场检测(如大批量抽检)和在线分析等独特优势[2]。本文研究利用近红外光谱技术,采用对不同的数学处理方法、散射校正法和统计方法等建模条件进行分析比较分析,寻找合理的建模条件,建立麦芽β-葡聚糖的近红外分析模型,实现快速检测。
1 材料与方法
1.1 主要材料
所用样品来自燕京啤酒制麦车间产的麦芽样品,共选取160个样品,其中100个用于定标集,60个用于预测集。选用 Baudin、Scarlett、Gairnder、Schooner、国麦内蒙古大麦、国麦甘啤4号等6个品种的麦芽。
将样品分为2份,1份用酶法测定β-葡聚糖含量的手工值,另1份用近红外光谱采集,建立检测模型。
1.2 主要试剂及配制
磷酸钠缓冲液(20 mmol/L,pH 6.5):900 mL蒸馏水溶解3.12 g NaH2PO4·2H2O,用100 mmol/L NaOH(4 g/L)调节pH到6.5,定容至1 L,4℃保存,稳定2个月。
醋酸钠缓冲液(50 mmol/L,pH 4.0):将2.9 mL冰醋酸加入900 mL蒸馏水,用1 mol/L NaOH调节pH到4.0,然后定容至1L,加入0.2g叠氮化钠,4℃保存,稳定2个月。
β-葡聚糖测定试剂盒:购于Megazyme公司。
1.3 主要仪器
分光光度计,UNICO公司7200型;控温水浴锅(1028S型),美国Bioetechnology公司;近红外谷物分析仪,FOSS公司生产的1241,配套 IFT3.2、WinISIⅢ,1.50V、ODIN等化学计量软件。
1.4 酶法测定β-葡聚糖
参照AOAC方法995.16。
1.5 近红外定标模型的建立与检测
1.5.1 光谱收集与光谱分析
收集有代表性的样品,进行近红外扫描及光谱分析,近红外扫描采用Foss公司生产的Infratec 1241近红外谷物分析仪进行样品扫描,样品要重复装样扫描2次[3],保存光谱,同一样品2次扫描使用相同的样品名,扫描温度控制在20~25℃,收集样品的吸收波长为850~1048 nm。将样品倒入进样口,然后按分析键,每个定标样品扫描2次,每次扫描设置5个子样品,所得每一样品吸收光谱即为10个子样的平均吸收光谱。
1.5.2 近红外检测模型的建立
在进行光谱分析时,先采用数学处理和光谱预处理两类方法来滤除噪音,以提高光谱的精细度。前者主要有导数和平滑处理两种方法[4],其中导数处理可提高光谱的分辨率及减小基线漂移,而平滑处理则可以去掉高频噪音对光谱信号的干扰,本试验选取“0.0.1”(依次为导数处理、数据间隔点、平滑处理间隔点)、“1.2.2”、“1.4.4”3 种方式。后者则采用不作散射校正、标准正常化处理、去散射处理、标准正常化+散射处理、多元散射校正、加权多元散射校正、反向多元散射校正等7种方法进行光谱散射处理。回归方法主要采用WINISIⅢ,V1.50软件提供的改进偏最小二乘法、偏最小二乘法和主成分分析3种回归算法与3种数学处理和7种光谱处理方式进行组合分析,从而选取最优的方式来建立应用模型。
本研究采用全波段进行回归分析构建回归方程,因此,用一些重要参数来衡量回归方程优劣,这些参数主要包括定标标准差(SEC),定标相关系数(RSQ),交叉验证误差(SECV),交叉验证相关系数(1-VR)。SEC是通过建立的定标模型对定标样品集进行预测所获得的化学分析值和近红外分析值的标准差;SECV是定标建模过程中,进行交叉验证时所获得的近红外预测值与化学分析值的标准差,通过SECV可以大致评估定标模型的预测准确度;RSQ即定标模型对定标样品变异所描述的百分率;1-VR是定标建模过程中进行交互验证时所得到的相关系数,即模型对样品集浓度变化所能描述出的百分率。构建回归方程时,相应各类标准差越小越好,决定系数越大越好。
1.5.3 近红外模型的应用
定标模型建立后,选用一批有代表性的样品(未用于建立定标模型)对所建立模型进行检验[5],用预测集样品进行预测,以酶法测定结果为纵坐标,近红外预测结果为横坐标,用一元线性回归法评价模型的准确性和适用性。
2 结果与讨论
2.1 定标样品的代表性
利用酶法测定了收集的100个定标集样品,其分析结果统计列于表1中所示。
从表1可以看出,用于近红外方法建模的麦芽样品中的β-葡聚糖含量范围比较广,其值已经基本覆盖了代表麦芽中β-葡聚糖含量的高、中、低等各级水平,因此说明收集的定标集样品具有很好的代表性。
2.2 光谱收集与光谱分析
近红外仪扫描所得麦芽近红外原始光谱图见图1,麦芽中β-葡聚糖在近红外区吸收谱带图见图2。
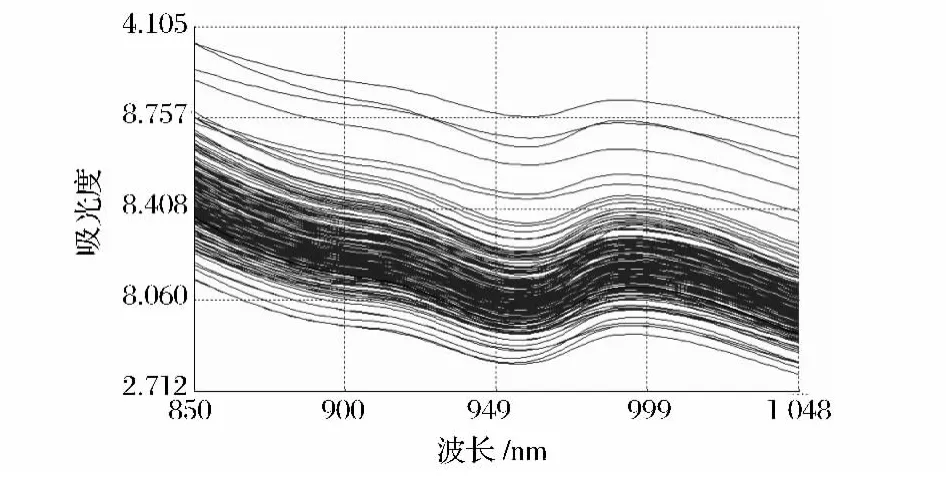
图1 麦芽定标样品的吸收光谱Fig.1 The absorlution spectrum of calibration malt samples
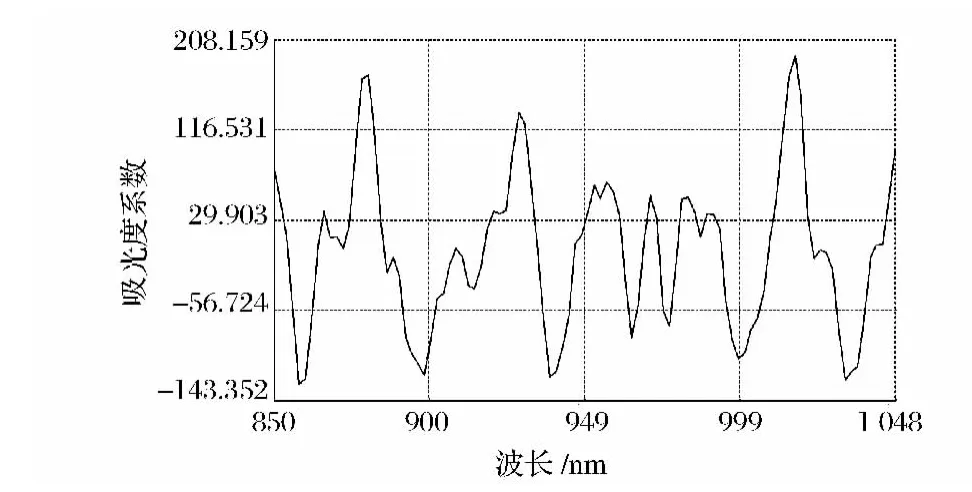
图2 麦芽中β-葡聚糖在近红外区吸收光谱带Fig.2 The absorption spectrum of β-glucan in malt by NIR
从图1中可见,所有光谱排列整齐有序,没有异常的样品光谱,且不同麦芽的吸收峰的大小不同,所以可以用近红外光谱技术对麦芽的有关成分进行定量,且从图2可以看出,麦芽β-葡聚糖在不同波长处吸收强度有很大差异,其中在波长886 nm、906 nm、934 nm、960 nm、1018 nm等几处都有较明显的吸收,可用近红外光谱与麦芽β-葡聚糖建立对应关系后,预测麦芽的β-葡聚糖含量。
2.3 定标方式的选择
2.3.1 不同回归方法的定标模型结果
近红外光谱中采用不同回归方法对定标效果的影响见表2所示。
由表2可知,不同回归分析方法对定标效果有一定的影响,PLS的定标效果好于MPLS和PCR。在用偏最小二乘法建立定标模型时,其难点是如何确定建立模型所使用的主成分数目。如果建立模型使用的主成分过少,就难以反映出未知样品被测组分的光谱变化,预测精度随之下降,出现不充分拟合(underfit)的现象;反之,如果建立模型使用的主成分过多,就会将代表噪音的主成分加入模型之中,使模型预测能力下降,导致过拟合(overfit)。目前,常用交叉验证法来处理。本试验利用WINISIⅢ,V1.50软件自带的交叉验证(Crossing Validation)功能处理后,剔除异常样品,确定其定标集样本为93个,主成分数为12。

表2 近红外光谱分析β-葡聚糖时不同回归方法对定标效果的影响Table 2 Effections of different regression methods onβ-glucan Tcalibration by NIR analysis in malt
2.3.2 不同散射校正的定标模型结果
定标样品经光谱散射校正后,对麦芽β-葡聚糖定标模型有一定的影响,各种散射校正对麦芽β-葡聚糖的定标模型的影响见表3。从表3中可看出不作散射处理能达到较高的RSQ和1-VR且SEC和SECV也最低,所以不作散射处理的光谱定标效果最好,说明在建立麦芽β-葡聚糖模型时。来自光散射的噪音信息较弱,无需对光谱进行散射处理。

表3 近红外光谱分析β-葡聚糖时不同散射校正对定标效果的影响Table 3 Effections of different scatter correction on nβ-glucan Tcalibration by NIR spectrum analysis in malt
2.3.3 不同数学处理的定标模型结果
在WINISIⅢ,V1.50分析软件中,将数学处理方法置于一个窗口中,可同时设置所需的处理方法。通过对“导数阶数、导数处理的数据间隔点、平滑处理的数据间隔点”不同组合处理样品光谱,得到β-葡聚糖的近红外模型结果见表4。

表4 不同数学处理对麦芽β-葡聚糖定标效果的影响Table 4 Effections of different mathematical analysis on β-glucan calibration in malt
不同数学组合处理对定标的效果不是很明显,但通过不同组合的测试结果可看出“1.4.4”(1阶导数以减少光谱中噪音等因素的影响、数据间隔点取4、平滑处理间隔点取4)得到的效果更好。
2.3.4 近红外模型的建立
结合表2、3、4通过对数学处理方法、散射校正和统计方法进行对比分析,最后选择偏最小二乘法、不作散射校正、数学处理采用“1.4.4”等条件建立定标模型。其定标模型各参数如表5所示。

表5 麦芽β-葡聚糖的近红外定标系数Table 5 The calibration coefficient of β-glucan in malt by NIR spectrum analysis
从表5可看出该定标模型的SEC为0.05、SECV为0.06、1-VR 为0.8275、RSQ 为0.856,有较低的各类标准差和较高的相关系数。内部验证相关图见图3。样品比较均匀地分布在中心线两侧,说明近红外法的测定结果与实验室酶法实际测定值趋势一致,整体分布情况良好。

图3 麦芽β-葡聚糖的近红外定标内部验证相关图Fig.3 The cross validation correlation of β-glucan in malt by NIR spectrum analysis
2.4 近红外测试的适用性和准确性
对预测集的60个麦芽样品利用酶法测定其β-葡聚糖含量,并用建立的近红外检测模型进行预测,用一元线性回归得到测定麦芽中β-葡聚糖含量的近红外法预测值与酶法测定值之间的相关性,结果示于图4。从图4可以看出,近红外模型对麦芽中β-葡聚糖含量的预测值与酶法测定结果的R2为0.827,可区分出麦芽中β-葡聚糖含量的高、中、低各水平,可用于生产过程中麦芽β-葡聚糖的分级控制,初步了解麦芽中β-葡聚糖含量,判断麦芽细胞壁的分解状况有着良好的应用前景。
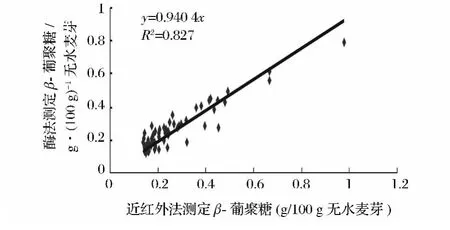
图4 酶法测定结果与近红外测定结果的相关性Fig.4 The correlation of β-glucan between Enzymatic detection and NIR spectum analysis
3 结论
通过对数学处理方法、散射校正和统计方法进行对比分析,选择偏最小二乘法、不作散射校正、数学处理采用“1.4.4”等条件建立了定标模型。该定标模型的 SEC 为 0.05、SECV 为 0.06、1-VR 为 0.8275、RSQ为0.856。有较低的各类标准差和较高的相关系数。说明建立的模型具有较好的稳定性和较高的准确度。
在对60个麦芽样品分别利用酶法进行实际测定的基础上,再利用近红外光谱技术进行预测,结果发现酶法测定值与近红外预测值之间的 R2达到0.827,一般情况下,近红外法与标准方法的相关性达到0.8表明近红外法可代替标准方法用于分级控制。说明本研究中建议的近红外光谱法能够对麦芽中的β-葡聚糖含量进行预测,有利于在生产过程中对麦芽β-葡聚糖的分级控制。
[1]王志坚.β-葡聚糖对啤酒酿造的影响及控制[J].中国啤酒,2004(2):24-25.
[2]Blanco M,Villaroya I.NIR spectroscopy:A rapid-response analytical tool[J].Trends in Anal Chem,2002,21(4):240-250.
[3]LU Wang-zhen,YUAN Hong-fu,XU Guang-tong,et al.Modern Analysis Technique of Near-infrated Spectrum[M].Beijing:China Petrochemical Press,2000.
[4]刘辉军,吕进,张维刚,等.茶叶中茶多酚含量的近红外光谱检测模型研究[J].红外技术,2007,29(7):429-432.
[5]周学秋.建立稳定、可靠、使用近红外定量分析模型的方法探讨[J].第九届全国计算机化学学术会议论文摘要集,2007.

