鳖甲煎丸及罗格列酮药物血清对大鼠肝星状细胞TβRⅡ和Smad3mRNA表达的影响*
河北医科大学第二医院
王宇涵 孙玉凤 王 卜△ 张艺凡△△ 王会青△△△ (石家庄050000)
肝纤维化是慢性肝损伤的病理特征之一。肝星状细胞(HSC)的活化是肝纤维化发生的核心环节,TGF-β1 是最重要的促进HSC 活化增殖的细胞因子和最强的促ECM 生成因子。[1]TGF-β1 与TβR-I、TβR-Ⅱ等受体结合发挥生物学效应,是TGF-β1 信号转导的起点和关键。[2]Smads 蛋白是目前已知唯一的TGF-β1 跨细胞膜传入HSC 细胞核的下游底物,[3]其中Smad3 与肝纤维化关系更为密切。[4]罗格列酮为PPAR-γ 合成配体,已证实在肝星状细胞由静止表型向活化表型的转化中起重要作用。鳖甲煎丸为中药消癥化结之名方,但其具体作用靶点及途径尚未明确。本实验采用血清药理学方法,配制含药物血清的干预培养基作用于体外培养的大鼠HSC,并运用RT-PCR 检测方法观察不同浓度鳖甲煎丸和罗格列酮药物血清对TGF-β1-Smad 信号转导通路最为关键的两个位点:TβR-Ⅱ和Smad3mRNA表达水平的影响,明确鳖甲煎丸和罗格列酮抗肝纤维化效果及可能作用机制。
1 材料
1.1 实验动物 SD 雄性大鼠25 只购自河北省实验动物中心(合格证编号:1008093),体质量200 g±20 g,按清洁级大鼠的饲养要求适应性喂养至平均体质量250 g±30 g。
1.2 实验药物及试剂 鳖甲煎丸水蜜丸购自武汉中联药业集团股份有限公司,罗格列酮片(爱能)购自成都恒瑞制药。TGF-β1 购自Peprotech 公司,反转录及RT-PCR扩增试剂盒购自Fermentas 公司,DNA Marker 购自上海捷瑞生物工程有限公司,PCR 引物由上海捷瑞生物工程有限公司鉴定并合成。
1.3 主要仪器 CHK2-F-GS 显微镜(日本Olympus公司),二氧化碳培养箱 (Reveo Scientifics Fac 公司),Nano Drop ND-1000 超微量紫外分光光度计(美国Nanodrop 公司),DYY-12 型电脑三恒多用电泳仪和DG-3A 型水平电泳槽(北京市六一仪器厂),GBOX-HR 凝胶成像分析仪(美国UVP 公司),C1000TM 梯度基因扩增仪(德国Biometra 公司)。
2 方法
2.1 各实验组药物血清及干预培养基的制备 25 只按体质量随机分为5 组。西药组灌服相当于成人千克体质量日用量7 倍的罗格列酮溶液(浓度为45.5 μg/mL),中药低、中、高剂量组分别灌服相当于成人千克体质量日用量3.5、7、14 倍的鳖甲煎丸溶液(浓度分别为26.25 mg/mL、52.5 mg/mL、105 mg/mL),每只大鼠每次灌胃2 mL,每日2次,对照组灌服相应剂量的蒸馏水。每次灌胃间隔12 h,连灌7 次,第7 次给药前禁食12 h,给药后1 h 无菌条件下每只下腔静脉取血后分离血清,过滤除菌后56℃灭活30 min。用10%FBS-DMEM 培养液配置大鼠含药血清体积分数为0.1 的各实验组干预培养基:含正常大鼠血清的FBSDMEM 培养液为对照组干预培养基,含正常大鼠血清的FBS-浓度5 μg/L TGF-β1[5]的DMEM 培养液为模型组干预培养基,含罗格列酮药物血清的FBS-DMEM 培养液作为西药组干预培养基,含鳖甲煎丸低、中、高剂量药物血清的FBS-DMEM 培养液分别作为鳖甲煎丸低、中、高剂量组干预培养基。
2.2 细胞培养传代及分组 肝星状细胞系HSC-T6 由河北医科大学第二医院消化病研究所惠赠。HSC 复苏后,培养传代2~3 次,制备细胞悬液,均匀接种于18 个细胞培养瓶,将实验分为6 组,每组3 瓶细胞。在5%CO237℃细胞培养箱中培养至细胞近50%汇聚时,换用不含血清的DMEM 同步化处理24 h,弃上清,对照组加入配制好的对照组干预培养基4 mL,模型组和各治疗组加入模型组培养基4 mL 24 h 后,吸去上清液,分别加入对照组和各治疗组干预培养基4 mL,5%CO237℃细胞培养箱中培养24 h。
2.3 用RT-PCR法检测各实验组HSCTβR-Ⅱ,Smad3mRNA 表达 按试剂盒说明,以Trizol 试剂提取各实验组总RNA。根据试剂盒说明进行RT-PCR (Fermentas 公司)。引物序列如下:TβR-Ⅱ:F:5'-GGAAGTCTGCGTGGCCGTGTGG-3'R:5'-CTATGGCAATCCCCAGTGGAGG-3',扩增产物长度为299 bp。Smad3:F:5'-TGACAGTGCTATTTTCGTCCAGTCT-3'R:5'-CGATCCCTTTACTCCCAGTGTCT-3'扩增产物长度为375 bp。每个反应体系加入1 μg RNA,采用C 1000TM 梯度基因扩增仪(德国Biometra 公司),按各自反应条件进行扩增,产物经1%琼脂糖凝胶电泳,GBOX-HR 凝胶成像分析仪进行吸光度扫描,用目的基因的吸光度与内参GAPDH 吸光度的比值代表目的基因的相对表达含量。每个样本每个指标重复做3 次,取其均值。
2.4 统计学处理 应用SPSS16.0 统计分析软件进行统计分析,数据以均数±标准差表示。多组间比较采用单因素方差分析(one way ANOVA),进一步两两比较采用SNK法。P<0.05 即认为组间差异有显著性。
3 结果
各组肝星状细胞TβR-Ⅱ、Smad3mRNA 表达结果显示:与对照组相比,模型组及各药物干预组TβR-Ⅱ、Smad3mRNA 表达均明显增高(P﹤0.05);与模型组相比,各药物干预组TβR-Ⅱ、Smad3mRNA 表达均明显减低(P﹤0.05);与罗格列酮组相比,鳖甲煎丸高剂量组TβR-Ⅱ、Smad3mRNA 表达均明显减低(P﹤0.05),鳖甲煎丸中剂量组TβR-Ⅱ、Smad3mRNA 表达差异无显著性(P﹥0.05),鳖甲煎丸低剂量组TβR-Ⅱ、Smad3mRNA 表达均明显增高(P﹤0.05);鳖甲煎丸低、中、高剂量组TβR-Ⅱ、Smad3mRNA 表达均依次减低(P﹤0.05),详见图1~图3、表1。

图1 RT-PCR 检测各组大鼠HSC 中TβR-ⅡmRNA 电泳条带
图2 RT-PCR 检测各组大鼠HSC 中Smad3mRNA 电泳条带
图3 RT-PCR 检测各组大鼠HSC 中GAPDHmRNA 电泳条带
表1 各组大鼠HSC 中TβR-ⅡmRNA、Smad3mRNA表达水平的比较 (±s)
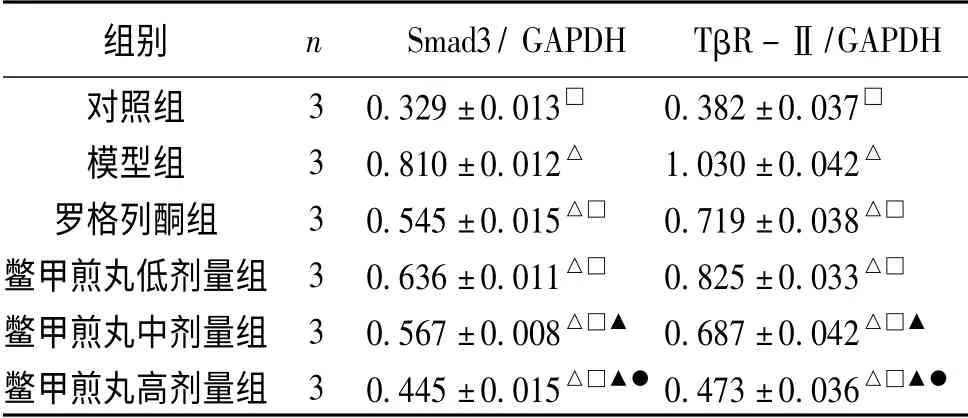
表1 各组大鼠HSC 中TβR-ⅡmRNA、Smad3mRNA表达水平的比较 (±s)
注:与对照组比较,△P﹤0.05;与模型组比较,□P﹤0.05;与鳖甲煎丸低剂量组比较,▲P﹤0.05;与鳖甲煎丸中剂量组比较,●P﹤0.05
组别 n Smad3/ GAPDH TβR-Ⅱ/GAPDH对照组 3 0.329±0.013□ 0.382±0.037□模型组 3 0.810±0.012△ 1.030±0.042△罗格列酮组 3 0.545±0.015△□ 0.719±0.038△□鳖甲煎丸低剂量组 3 0.636±0.011△□ 0.825±0.033△□鳖甲煎丸中剂量组 3 0.567±0.008△□▲ 0.687±0.042△□▲鳖甲煎丸高剂量组 3 0.445±0.015△□▲●0.473±0.036△□▲●
4 讨论
肝纤维化(HF)是肝脏持续损伤组织发生、修复时因ECM 合成、降解与沉积平衡破坏所致的病理过程。HSC 是肝纤维化时ECM 过多产生和沉积的关键。TGF-β1 是已知最为关键的致纤维化细胞因子,也是HSC 的激活、增殖,ECM 的合成分泌是这一病理过程中重要的生物调节因子。[6]TGF-β1 首先通过与细胞膜上的TβRⅡ结合,激活TβRⅠ,而后形成异源四聚体复合物发挥以上生物效应。从异源四聚体而致的信息,是通过胞质内被称为Smad 的信号分子活化而实现的,而smad3 是包括肝纤维化在内的TGF-β1 相关致病机制中的关键物质。
中药复方鳖甲煎丸具有活血化瘀,软坚散结,滋阴清热等作用,改善血液循环,增加肝内循环血量,抑制肝内纤维增生,促进胶原纤维降解吸收,改善肝功能;亦能直接抑制肝内胶原的沉积,从而减缓肝纤维化的发生;罗格列酮为PPARr 激动剂,通过上调PPARr 抑制HSC 增值活化,增加ECM 降解,促进HSC 凋亡,逆转肝纤维化。[7]
本实验结果证实TGF-β1 促HSC 增殖活化的作用与在各位点激活TGF-β1-Smad 信号转导通路有关。罗格列酮,鳖甲煎丸药物血清均能下调由TGF-β1 刺激后的HSC表达TβR-Ⅱ,Smad3mRNA,说明两药抑制HSC 增殖活化的作用均与在以上两个位点阻断TGF-β1-Smad 信号转导通路有关。但其对下游因子Smad3 的作用是对上游因子TβR-Ⅱ作用产生的级联反应,还是直接与Smad 发生反应,亦或两者兼而有之,有待进一步研究探讨。本实验进一步证实中药鳖甲煎丸抗肝纤维化效果确切且呈显著量效关系,为其进一步科学研究和临床应用奠定基础。
[1]Knittel T,Mehde M,Kobold D,etal.Expreeion patterns of Matrix metallo proteinases and their inhibitors in parenchy-mal and non-parenchymal cells of rat liver:regulation by TNF-alpha and TGF-beta I [J].Hepatol,1999,30:48
[2]Qi Z.Atsuchi N,Ooshima A,Tokeshita A,UenoH,etal.Blockat e of type beta transforming growth factor signaling prevents liver fibrosis and dysfunction in the rat[J].Proc Natl Acad Sci USA,1999,96 (5):2 345-2 349
[3]Bassing CH,Yingling JM,Howe DJ,etal.A transforming growth factor beta type I receptor that signals to activate gene expression[J].Science,1994,263 (5143):87-89
[4]Dijke PT,Goumans MJ,Itoh F,etal.Regulation of cell proliferation by Smad.proteins [J].Cell Physiol,2002,191 (1):1-16
[5]Zhang Z,Garron TM,LiXj,etal.Recombinant human decorin inhibits TGF-beta1 induce contraction of collagen lattice by hypertrophic scar fibroblasts.Burns 2007,33:634-41
[6]Bissell DM,Roulot D,George J.Transforming growth fact or beta and the liver[J].Hepatology,2001,34 (5):859-867
[7]Miyahara T,Schrum L,Rippe R,etal.Peroxisome proliferatoractivated recptors and hepatic stellate cell activation [J].Biol Chem,2000,275 (46):35 715-35 722

