以免疫球蛋白和T细胞受体基因重排为标志定量检测MLL基因重排儿童急性淋巴细胞白血病的微小残留病和预后关系
高 超 李伟京 崔 蕾 赵晓曦 刘曙光 吴敏媛 李志刚
急性淋巴细胞白血病(ALL)是B或T淋巴细胞在分化过程中阻滞于某一不成熟阶段,并且克隆性恶性扩增的结果。免疫球蛋白(Ig)和T细胞受体(TCR)基因重排作为淋巴系恶性疾病的克隆性标志已被广泛应用,为临床上PCR方法检测微小残留病(MRD)最常见和重要的标志[1]。国外大样本前瞻性MRD研究结果表明,定量监测MRD水平及其动态变化,能对肿瘤负荷动力学做出精确的分析,更好地反映疾病过程、评价治疗效果,有助于预后判断、完善白血病的临床分型及实施个体化治疗。混合谱系白血病(MLL)基因重排为造血系统恶性肿瘤常见分子/遗传学异常,见于2%~6%的儿童ALL[2]。MLL基因重排已公认为划分儿童高危ALL的标准之一,相应给予高强度化疗或造血干细胞移植,但部分患儿常规化疗也可获得长期持续缓解。因此,MRD检查在临床决策中无疑具有重要价值。本研究以Ig和TCR基因重排为靶分子,利用RQ-PCR方法监测MLL基因重排阳性患儿MRD水平,探讨其变化规律及其对临床的指导意义。
1 方法
1.1 研究对象2003年4月至2009年12月首都医科大学附属北京儿童医院(我院)血液肿瘤中心收治的MLL基因重排的ALL患儿,且有足量的临床检查剩余骨髓样本可用于Ig和TCR检测,同时具有MRD检测结果。
1.2 知情同意和伦理 本文检测ALL患儿Ig和TCR取得了监护人的知情同意,研究方案获得我院伦理委员会的批准。
1.3 分组 根据诱导治疗结束时骨髓MRD水平作为分组依据,MRD≥10-4为MRD阳性组,<10-4为MRD阴性组。1.4 基因组DNA的提取 按照DNA提取试剂盒(安徽优晶)说明书提取骨髓基因组DNA,紫外分光光度计检测A260和A280,计算两者比值和 D NA浓度。DNA浓度(μg·μL-1)=A260×50×稀释倍数/1 000。
1.5 Ig和TCR基因重排及连接区序列分析 利用多重PCR反应筛查Ig和TCR基因重排,包括:①IgH:VH-DHJH,DH-JH;②IgK:VK-JK,VK-Kde,Intr-Kde;③IgL:Vλ-Jλ;④TRD:Vδ-Dδ-Jδ,Vδ-Jδ,Vδ-Dδ,Dδ-Dδ;⑤TRG:Vγ-Jγ;⑥TRB:Vβ-Dβ-Jβ,Vβ-Jβ,Dβ-Jβ。PCR 条件为:95℃ 7 min,95℃变性 4 5 s,60℃退火45 s,72℃延伸1.5 min,共35 个循环。所用引物及反应体系见文献[3]。PCR产物经电泳后,选择克隆性重排的样本,纯化后送上海生工生物工程技术服务有限公司,采用ABI PRISM 3730型测序仪进行测序。然后将测序所得的DNA序列输入BLAST和IMGT数据库与保守的VDJ序列进行比对,未比对上的序列为患者白血病细胞特异性连接区序列。
1.6 以患儿特异性Ig和TCR基因重排序列为靶标进行MRD追踪 以患儿特异性IgH,IgK,IgL,Kde,TRB,TRG及TRD基因重排为标志设计白血病细胞特异性引物。采用阴性对照DNA,10倍系列稀释ALL患儿初诊时骨髓细胞DNA,制备10-1~10-5共5个梯度的系列标准品(设0.2μg·μL-1为100稀释度)。应用标准曲线,根据随访期标本的Ct值自动得出相应的拷贝数,取平均拷贝数除以该样本扩增 N -ras基因得到的拷贝数,即为 M RD 定量值[4,5]。对于重复检测3次的平均Ct值﹥可重复敏感度(10-4)的最大Ct值的样本,依据欧洲 A LL MRD检测研究组织(ESG-MRD-ALL)推荐的标准,定义为+,即 < 10-4。25μL RQ-PCR反应体系中含有RoxMix 12.5μL,上下游引物各7.5 pmol,探针 5 pmol,DNA 600 ng。反应条件为 9 5℃15 min,95℃ 3 0 s,56~60℃ 1 min,共50 个循环。家族性引物和探针序列见参考文献[6~12]。
1.7 以MLL基因重排融合mRNA为靶标进行MRD追踪将含有融合转录本的质粒依次稀释,制备成102~106拷贝·μL-1的标准品,应用标准曲线,得到随访期标本的拷贝数,并以ABL基因作为内参。以每104ABL中含有的目的基因拷贝数作为 M RD值。25μL体系中含有RoxMix 12.5μL,上下游引物各 7 .5 pmol,探针 5 pmol,cDNA 80 ng。反应条件为 9 5℃ 15 min,95℃ 30 s,60℃ 1 min,共50个循环。引物及探针序列见表1。
1.8 统计学分析 应用SPSS 16.0 for windows软件进行统计分析。利用精确概率法χ2检验比较诱导缓解治疗结束时MRD高低水平两组初诊临床特征及对泼尼松实验治疗敏感性的差异。利用Spearman's相关性分析比较两种方法检测MRD结果的相关性。生存率分析采用Kaplan-Meier法;MRD不同水平组间无事件生存率(EFS)的比较采用Log-Rank检验。随访时间定义为自诊断之日至发生事件之日或研究观察终止之日。事件定义为死亡、复发或第二肿瘤。(P<0.05)为差异有统计学意义。

表1 以MLL融合基因为分子标志检测MRD所用引物与探针Tab 1The primers and probes used in MRDdetection withMLLfusion transcripts as targets
2 结果
2.1 一般情况2003年4月至2009年12月我院血液肿瘤中心收治的24例MLL基因重排ALL患儿,年龄6个月至11岁10个月,中位年龄2岁4个月。B-ALL 21例,T-ALL3例。其中4例在确诊后放弃治疗,14例在我院接受BCH-2003方案、6例接受CCLG-2008方案规范性化疗。其中14例在诱导治疗结束时(开始化疗后第33天)进行了MRD检测进入分析,其中9例长期缓解,5例复发。
2.2 MLL重排阳性患儿MRD的水平 表2显示,14例在诱导化疗结束时,即化疗开始后第33天,进行了以Ig和TCR为标志的MRD检测,MRD水平为0~7 770×10-4,中位数为4.85×10-4。9例长期缓解患儿MRD水平低于5例复发患儿(<10-4vs 448×10-4)。14例同时进行了该时间点融合转录本的定量检测,检测水平从0至4 020.1拷贝·10-4ABL,中位数为7.91拷贝·10-4ABL。复发患儿融合转录本定量水平显著高于长期缓解患儿,中位数前者为1.09拷贝·10-4ABL,后者为322.5拷贝·10-4ABL。两种方法的相关性为0.942,(P<0.05)。

表2MLL基因重排阳性患儿MRD与临床特征Tab 2The MRD and clinical characteristics of patients withMLLgene rearrangments
2.3 MLL重排阳性患儿MRD与临床特征的关系 诱导缓解治疗末MRD阳性组8例中男7例,MLL-AF4+4例,其他MLL重排4例,BCH-2003方案5例,CCLG-2008方案3例;MRD阴性组6例中男4例,MLL-AF4+3例,其他MLL重排3例,BCH-2003和CCLG-2008方案各3例。MRD阴性组5/6例初诊时外周血WBC<100×109·L-1,MRD阳性组1/8例WBC<100×109·L-1。MRD阴性组6例第8天外周血幼稚细胞绝对值均<1 000个·μL-1,MRD阳性组中4/8例外周血幼稚细胞绝对值<1 000个·μL-1。
2.4 MLL重排阳性患儿MRD与预后的关系14例在诱导缓解治疗结束时进行了MRD检测患儿随访3~132个月,中位时间为64个月,5年EFS为(63.5±13.2)%。图1显示,MRD阳性组和阴性组间EFS存在显著差异(P=0.022),MRD阴性组目前全部缓解,而MRD阳性组5年EFS为(37.5±17.1)%。
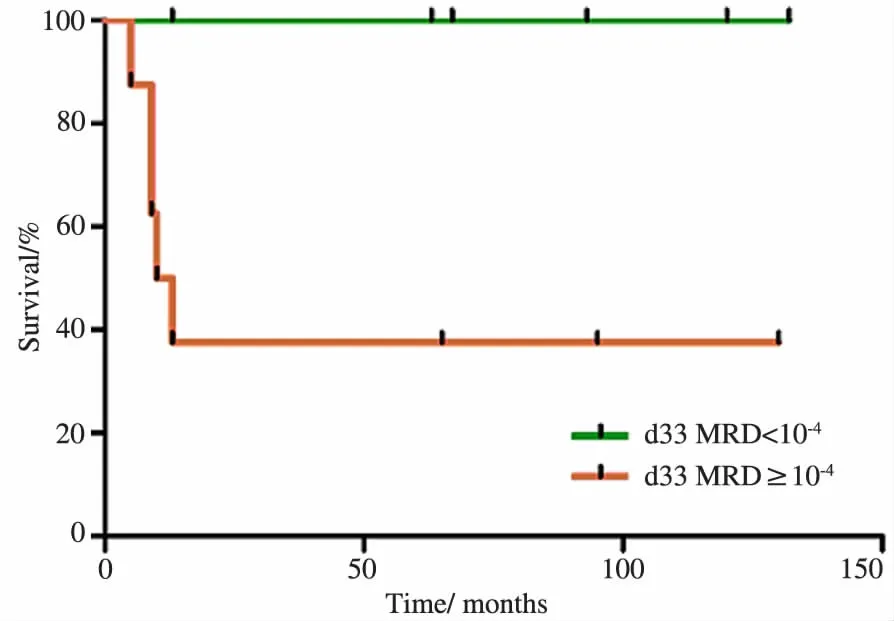
图1 MRD阳性组与阴性组生存曲线图Fig 1The events-free survival rates of patients withdifferent MRD level
3 讨论
大量研究证实,MRD的定量检测对于ALL的预后判断、预防复发具有重要意义。本研究对两种MRD标志,即Ig和TCR以及融合转录本,进行检测。结果显示,两种方法的检测结果高度一致,提示在临床应用中,可任选其一对患儿进行MRD追踪。此外,在ALL治疗中的关键时间点进行连续的MRD检测,能对肿瘤负荷动力学作出精确的判断,有助于评估危险度,从而调整治疗方案,实施个体化治疗。研究表明,对诱导缓解治疗的早期反应是儿童ALL最重要的预后因素之一。BFM协作组自1986年起将泼尼松实验治疗反应作为评价早期治疗反应的方法,泼尼松实验治疗反应良好的患者预后较好,而反应差者则预后较差。但泼尼松实验治疗仅反映了白血病细胞对糖皮质激素的敏感性,这对于准确判断预后是不够的。诱导缓解治疗结束时的MRD水平反映了患者对4种化疗药物的综合疗效(泼尼松/地塞米松、长春新碱、柔红霉素和左旋门冬酰胺酶),以及目前尚未认识的机体抗白血病机制和耐药等方面信息,因此这一时期的MRD检测将有助于区分出预后不同的患儿。有研究指出,诱导缓解治疗结束时MRD呈阴性或低水平(<10-4)的患儿,提示体内白血病细胞对化疗敏感,预后较好[13,14]。
本研究检测了14例患儿诱导缓解治疗结束时的MRD,结果表明该时间点MRD阴性和阳性患儿相比,生存率上存在显著性差异,MRD阴性患儿目前均处于骨髓形态学完全缓解状态,而 MRD阳性的患儿5年 EFS仅为37.5%。此外,MRD阴性患儿泼尼松实验治疗的反应均较好,第8天外周血幼稚细胞绝对值均<1 000个·μL-1;而MRD阳性患儿仅50%反应良好,MRD阴性组的泼尼松治疗反应有好于阳性组的趋势(P=0.085),需要增加病例数继续观察。
既往的研究表明,性别、年龄、初诊时外周血WBC计数等临床特征都是影响白血病预后的因素。对来自11个协作组的497例MLL重排阳性患儿的研究显示,年龄是重要的预后因素,≤1岁的预后差于 >1岁者[15]。性别仅对MLL-ENL+患儿有影响,女性的 5年 EFS低于男性[16]。NOPHO协作组对1 425例儿童ALL的研究发现,高WBC计数与MLL重排相关[17]。此外,对不同亚型影响预后的研究显示,MLL-AF4+和MLL-AF9+患儿的预后差于MLLENL+的患儿[16]。但这些研究并未揭示 MLL重排阳性者中MRD水平与临床特点的相关性。本研究中,比较了MRD水平不同的两组患儿以上临床特点的差异。结果显示,两组初诊时外周血WBC与MRD水平有关,MRD阳性组WBC≥100×109·L-1患儿占87.5%;而MRD阴性组这一比例仅为16.7%。提示,初诊时肿瘤负荷严重的患儿,更不容易获得缓解。但两组在性别、年龄及融合基因类型上均无差异。
此外,由于本组患儿中使用了两种不同的化疗方案,即BCH-2003方案和CCLG-2008方案,两种方案在诱导缓解治疗阶段的药物和剂量大致相同,区别在于CCLG-2008方案在7d泼尼松实验治疗结束后,改用地塞米松继续治疗,而BCH-2003方案则继续使用泼尼松。有报道显示体外实验中地塞米松抗ALL的作用为泼尼松的16倍,而且地塞米松有更好的预防CNS复发和提高无病生存率 (85%vs 77%,P=0.002)的作用[18],有逐渐取代泼尼松用于诱导治疗的趋势。
本研究结果显示两种方案对诱导缓解治疗结束时的MRD结果没有影响,提示此时间点MRD的结果是多种药物联合作用的结果,地塞米松与泼尼松对MLL重排患儿白血病细胞的作用效果相近。
[1]Gao C, Zhao XX, Li WJ,et al.Clinical features, early treatment responses,and outcomes of pediatric acute lymphoblastic leukemia in China with or without specific fusion transcripts:a single institutional study of 1,004 patients.Am J Hematol, 2012, 87(11):1022-1027
[2]Chowdhury T,Brady HJ.Insights from clinical studies into the role of the MLL gene in infant and childhood leukemia.Blood Cells Mol Dis, 2008, 40(2):192-199
[3]van Dongen JJ, Langerak AW, Bruggemann M, et al.Design and standardization of PCR primers and protocols for detection of clonal immunoglobulin and T-cell receptor gene recombinations in suspect lymphoproliferatons:Report of the BIOMED-2 Concerted Action BMH4-CT98-3936.Leukemia,2003,17(12):2257-2317
[4]Cui L, Li Z, Wu M, et al.Combined analysis of minimal residual disease at two time points and its value for risk stratification in childhood B-lineage acute lymphoblastic leukemia.Leuk Res, 2010, 34(10):1314-1319
[5]Mei YY(梅妍妍),Gao C,Cui L, et al.Prognostic significance of CASP8AP2 and joint detection of minimal residual disease in pediatric acute lymphoblastic leukemia.Chin J Evid Based Pediatr(中国循证儿科杂志),2013,8(2):122-125
[6]Verhagen OJ, Willemse MJ, Breunis WB, et al.Application of germline IGH probes in real-time quantitative PCR for the detection of minimal residual disease in acute lymphoblastic leukemia.Leukemia, 2000,14(8):1426-1435
[7]van der Velden VHJ, Willemse MJ, van der Schoot CE, et al.Immunoglobulin kappa deletiong element rearrangements in precursor-B acute lymphoblastic leukemia are stable targets for detection of minimal residual disease by real-time quantitative PCR.Leukemia, 2002, 16(5):928-936
[8]van der Velden VHJ, de Bie M, van Wering ER, et al.Immunoglobulin light chain gene rearrangements in precursor-B-acute lymphoblastic leukemia:characteristics and applicability for the detection of minimal residual disease.Heamatologica,2006, 91(5):679-681
[9]Bruggemann M, van der Velden VHJ, Raff T, et al.Rearranged T-cell receptor beta genes represent powerful targets for quantification of minimal residual disease in childhood and adult T-cell acute lymphoblastic leukemia.Leukemia, 2004,18(4):709-719
[10]Langerak AW,Wolvers-Tettero I LM, van Gastel-Mol EJ,et al.Basic helix-loop-helix proteins E2A and HEB induce immature T-cell receptor rearrangements in nonlymphoid cells.Blood,2001,98(8):2456-2465
[11]Szczepanski T, van der Velden VHJ,van Dongen JJM.Realtime quantitative(RQ)-PCR for the detection of minimal residual disease in childhood acute lymphoblastic leukemia.Haematologica,2002, 87(S1):183-195
[12]van der Velden VHJ,Wijkhuijs JM, Jacobs DCH, et al.T cell receptor gamma gene rearrangements as targents ofr detection of minimal residual disease in acute lymphoblastic leukemia by real-time quantivative PCR analysis.Leukemia,2002, 16(8):1372-1380
[13]Panzer-Grumayer ER, Schneider M, Panzer S, et al.Rapid molecular response during early induction chemotherapy predicts a good outcome in childhood acute lymphoblastic leukemia.Blood,2000,95(3):790-794
[14]Coustan-Smith E, Sancho J, Behm FG, et al.Prognostic importance of measuring early clearance of leukemic cells by flow cytometry in childhood acute lymphoblastic leukemia.Blood,2002,100(1):52-58
[15]Pui CH, Gaynon PS, Boyett JM, et al.Outcome of treatment in childhood acute lymphoblastic leukaemia with rearrangements of the 11q23 chromosomal region.Lancet, 2002, 359(9321):1909-1915
[16]Pui CH, Chessells JM, Camitta B,et al.Clinical heterogeneity in childhood acute lymphoblastic leukemia with 11q23 rearrangements.Leukemia,2003, 17(4):700-706
[17]Forestier E, Schmiegelow K.The incidence peaks of the childhood acute leukemias reflect specific cytogenetic aberrations.J Pediatr Hematol Oncol.2006,28(8):486-495
[18]Deangelo DJ.The treatment of adolescents and young adults with acute lymphoblastic leukemia.Hematology,2005:123-130

