一种新型多元均相时间分辨荧光免疫分析方法的建立
陈振华,陈玫君,侯经远,郑洁纯,吴英松,刘天才
(1.南方医科大学生物技术学院,广东 广州 510515;2.南方医科大学公共卫生与热带医学学院,广东 广州 510515)
0 引言
现代免疫分析方法最早的形式是放射免疫分析法,但该法最大的缺陷是其带来的放射性污染对实验人员和环境有很大危害,因此现代免疫分析中采用放射性同位素作为标记物的方法所占的比例正在迅速减少.自20世纪中期以来,随着科学研究的不断深入,多种非放射性免疫分析技术进入了人们的视野,如荧光偏振免疫分析、酶联免疫分析、时间分辨荧光免疫分析、生物发光分析、化学发光免疫分析、电化学发光免疫分析等.尽管这些分析方法正日趋成熟,但它们依然存在检测样品下限浓度不够低、灵敏度不高、难以实现自动化等缺点,研究开发更加高效、快速、灵敏、可靠、无辐射的多元免疫分析已经成为现代科技发展的必然趋势.
多元免疫分析与传统免疫分析相比有众多优势:可一次性对多个待测物进行筛选,与单一靶点作用的传统免疫分析筛选方法相比通量更高;能有效降低采样产生的偏差;可进行痕量检测;检测下限浓度低,灵敏度高;减少分析样品的用量,可有效提高筛选质量和降低分析成本.另外,根据待测物是否悬浮在分析样品中,免疫分析技术可分为均相与非均相两种类别.一般而言,非均相分析(如ELISA,TRFIA)具有操作过程繁杂,需要洗涤步骤来分离结合标记与游离标记,耗费时间长,不易自动化等缺点[1-3].因此,多元均相时间分辨荧光免疫分析技术[4-6]的出现和发展成为了必然.均相时间分辨荧光免疫分析的检测原理是基于荧光共振能量转移,依赖于能量转移的供体与受体特异性荧光性质.具有时间分辨荧光性质的镧系螯合物,其荧光有特异性,如衰变时间长,激发光与发射光之间的Stokes位移大等;它成为均相时间分辨荧光免疫分析最为常用的供体荧光发色基团.量子点以其独特的光学性质在生物医学应用中举足轻重,研究至今已十余年,依然方兴未艾[7-9].与传统有机染料相比,量子点的优势在于:不同尺寸的量子点具有不同的颜色;荧光发射峰最大半峰宽窄而对称;激发谱宽;Stokes位移大;同一激发光源可以同时激发多色量子点;具有较高的量子产率和抗光漂白性;摩尔消光系数大.因此,它作为荧光共振能量转移受体荧光发色基团,是实现多元均相时间分辨荧光免疫分析的理想材料.
基于前期研究,本课题以供体与受体之间因抗原与抗体的相互作用而产生的时间分辨荧光共振能量转移(TR-FRET)机制为切入点,充分利用镧系铽螯合物与多色量子点的特异性光学性质,采用双抗体夹心法模式,分别将癌胚抗原(CEA)、甲胎蛋白(AFP)和乙肝表面抗原(HBsAg)两株抗体偶联到多色量子点纳米微球和铽螯合物,实现一次性定量分析CEA、AFP及HBsAg的浓度,从而建立一种新型多元均相时间分辨荧光免疫分析方法.该多元均相时间分辨荧光免疫分析方法具有无放射性污染,灵敏度高,背景荧光低,性质稳定,不需要洗涤和分离步骤,多个待测分子同时分析,操作简便,分析快速,易于微型化自动化,应用范围广等优点,对疾病的及早发现和预防起重要作用.
1 材料与方法
1.1材料癌胚抗原(CEA)、甲胎蛋白(AFP)和乙肝表面抗原(HBsAg)及其配对的单克隆抗体(6F11和S001、E010和E014、5909和5910)购自中山大学达安基因股份有限公司,羧基化合物修饰的聚苯乙烯微球(CPs,205 nm,10%,100 mg/mL)购自Thermofisher公司,偶联剂N-羟基硫代琥珀酰亚胺(Sulfo-NHS)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC.HCl.99%)购自Sigma公司,荧光测量仪为美国MDS公司的SpectraMax M5多功能酶标仪,白色反光96孔微孔板为Labsystem公司产品.Eppendorf Centrifuge 5418离心机,IKA WERKE MS 3 basic基本型振荡器,超声除气装置NEY CELTRAsonik,10 kDa、50 kDa的离心管为Millipore公司产品.
1.2 方法
1.2.1 量子点微球的制备 荧光发射峰分别为565,605和655 nm的脂溶性量子点参照我们已发表的文章制备[10-12].量子点聚苯乙烯微球(QPs)的制备参照已发表文献[13-15],首先进行纳米微球的预处理,即先将0.1 mL纳米微球(粒径(205±3) nm,质量浓度为100 mg/mL,含量10%)于14 000 r/min,4 ℃离心15 min.沉淀中加入1.5 mL异丙醇,超声处理,使得溶液沉淀悬浮充分,离心,去液相.最终混合于0.45 mL异丙醇溶液中,超声处理.然后,将脂溶性量子点三氯甲烷溶液滴加入纳米微球悬浊液,室温超声振荡15 min;轻微振荡(200 r/min)孵育24 h(期间穿插进行5次的超声振荡,每次持续5 min).孵育后离心处理,去除上清液,加入异丙醇悬浮超声,8 000 r/min离心,重复3次.再用去离子水洗涤3次,最后,将沉淀加入PBS缓冲液(50 mmol/L,pH=7.4)重悬,充分振荡超声混匀得到量子点纳米微球悬浮液.
1.2.2 量子点纳米微球与生物偶联分子表面修饰 MES缓冲液(0.1 mL,50 mmol/L)、去离子水(0.47 mL)和量子点纳米微球(0.1 mL)混合均匀,加入0.1 mL EDCA(10 mg/mL)混匀振荡15 min,再加入sulfo-NHS(0.23 mL,100 mmol/L)振荡30 min.离心10 000 r/min,10 min.去除上清液,向沉淀中加入1 mL的50 mmol/L的MES,超声3 min,重悬量子点微球.离心10 000 r/min,10 min,去除上清液.向沉淀再加入1 mL的50 mmol/L的MES,重悬.加入单克隆抗体0.1 mL(2 mg/mL),孵育30 min,加入乙醇胺(0.05 mL,1 mol/L),继续孵育15 min,离心10 000 r/min,5 min,去除上清液.沉淀中加入PBS(50 mmol/L,pH=7.4)重悬,再离心,重复此步骤3次,向QPs-抗体沉淀物加入1 mL PBS(50 mmol/L,pH=7.4)重悬,4 ℃冰箱保存.
1.2.3 铽螯合物的制备及其抗体偶联 参考已发表文章[15-16]制备得到铽螯合剂LTC(42 μg/mL).0.1 mL的LTC溶液加入到0.1 mL的抗体(1 mg/mL)中,搅拌均匀,加入等摩尔量的BS3并在室温下孵育1 h.混合物使用超滤柱纯化,并用PBS溶液(50 mmol/L,pH 7.4)洗涤5次.得到的LTC-抗体加入0.01%的叠氮钠并稀释到0.1 mg/mL,储存待用.
1.2.4 抗原标准品的制备 癌胚抗原(CEA)、甲胎蛋白(AFP)和乙肝表面抗原(HBsAg)使用抗原稀释液稀释,并得到标准品浓度分别为CEA(0、1、5、10、100、400 ng/mL),AFP(0、2、10、50、200、800 ng/mL)和HBsAg(0、0.2、1、5、25、150 ng/mL).
1.2.5 量子点纳米微球的光谱分析 以上具有不同荧光发射波谱的QPs-抗体溶液的吸收光谱以及荧光光谱分析分别在UV-vis紫外-可见分光光度计(UV-2550,Shimadzu,Japan)和LS-55荧光分光光度计(PerkinElmer Inc.,Waltham,MA,USA)上进行.
1.2.6 均相时间分辨荧光免疫分析方法 采用双抗体夹心一步法,为了加样方便,3种抗原及其对应的抗体加入体积一样.在96孔板上分别加入25 μL抗原标准品、25 μL的LTC-抗体以及50 μL QPs-抗体;37 ℃振荡孵育1 h,在1 420 Victor 3TM(PerkinElmer Inc.,Waltham,MA,USA)多功能酶标仪上进行时间分辨荧光检测,检测条件为:延迟时间500 μs,门控时间1 400 μs,采集次数2 000次,激发波长340 nm,带宽10 nm;荧光发射数据采集的中心波长分别为545、565、605和655 nm,其带宽均为8 nm.
2 结果
该新型多元均相时间分辨荧光免疫分析是基于时间分辨荧光及其荧光共振能量转移来实现的.检测的信号来源于本来不具有时间分辨荧光的量子点纳米微球.该纳米微球因为双抗体与抗原形成抗原复合体而与铽螯合剂靠近,其距离小于佛斯特距离(Förster distance)R0时[17],铽螯合剂所具有的时间分辨荧光与量子点纳米微球发生荧光共振能量转移,从而激发镶嵌在纳米微球中的量子点发射荧光而发出信号.
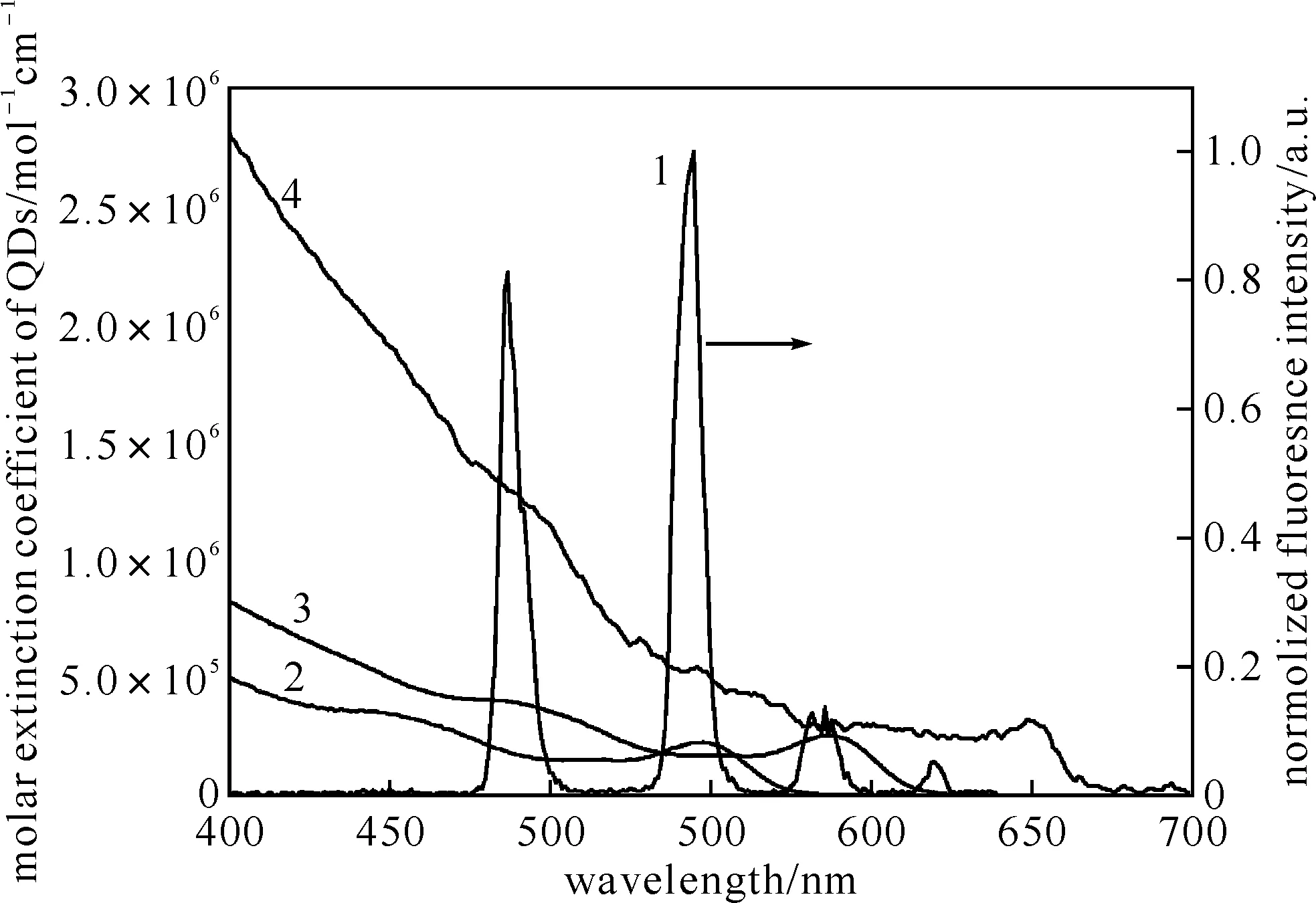
图1 多元均相时间分辨荧光免疫分析能量供体与受体的光谱图匹配波谱1~4分别表示能量供体铽螯合剂时间分辨荧光光谱、发射波长分别为565、605和655 nm的三色量子点能量受体的摩尔消光光谱
根据其信号的强弱判定标记在量子点纳米微球上的抗体所结合的抗原的量.不同的量子点纳米微球标记有不同的抗体,不同量子点发出不同波长的荧光,从而实现多元待分析物的定性定量分析.为满足能量共振转移的条件,各色量子点与铽螯合剂的波谱应相互匹配,具有不同荧光发射峰的量子点纳米微球的吸收光谱、铽螯合剂的时间分辨荧光发射光谱如图1所示.
利用铽螯合剂与三色量子点检测CEA、AFP和HBsAg抗原的多元均相分析原理如图2所示.铽螯合剂标记有不同的单克隆抗体,对应的三色量子点标记有不同的3种单克隆抗体,它们在同一个孔进行CEA、AFP和HBsAg抗原的检测原理如图2所示.对3种抗原标准品的检测数据进行统计分析后,得到线性相关的3组数据,如图3所示.

图2 多元均相时间分辨荧光免疫分析的原理图(以甲胎蛋白AFP抗原的检测为例)
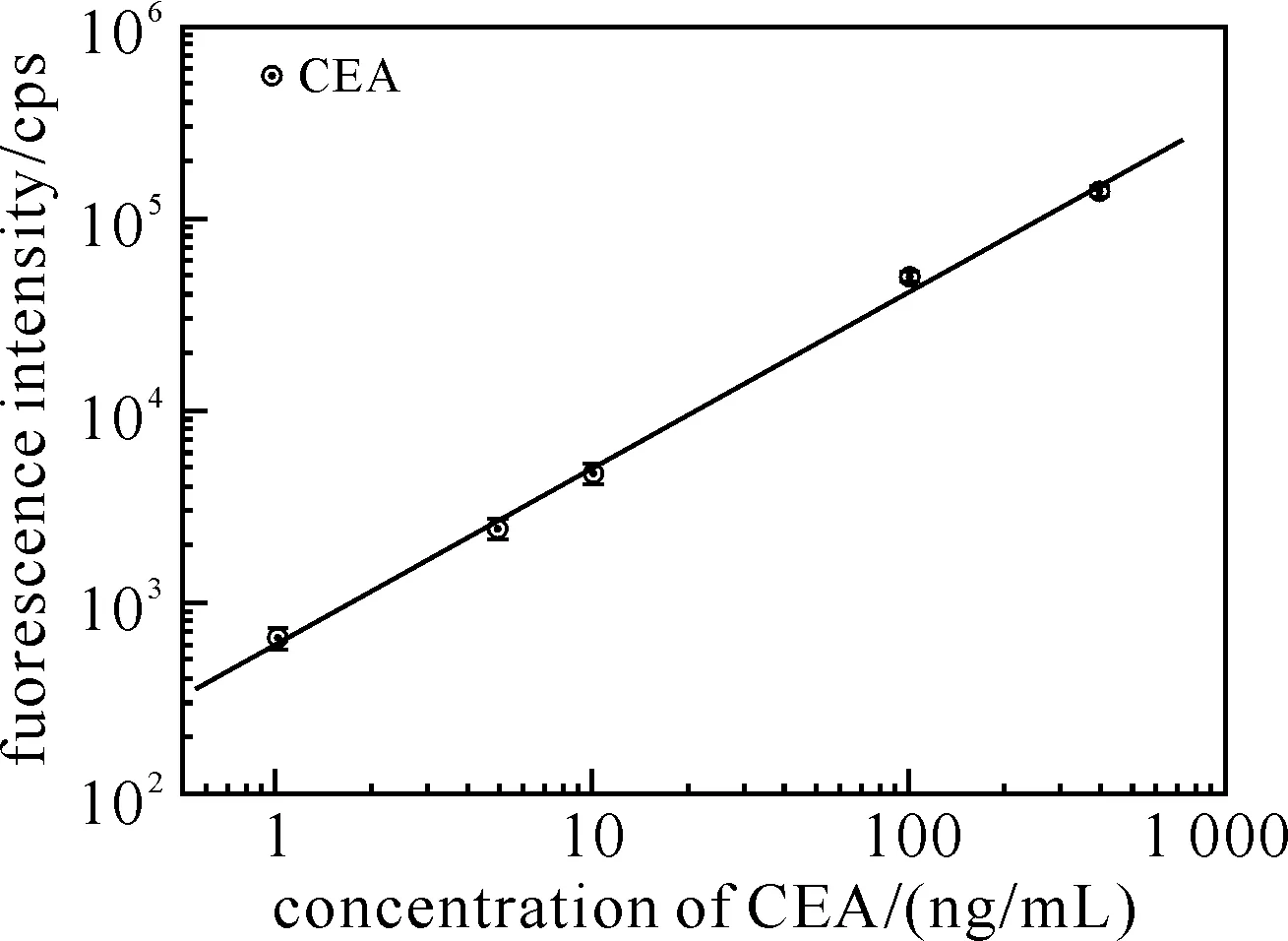
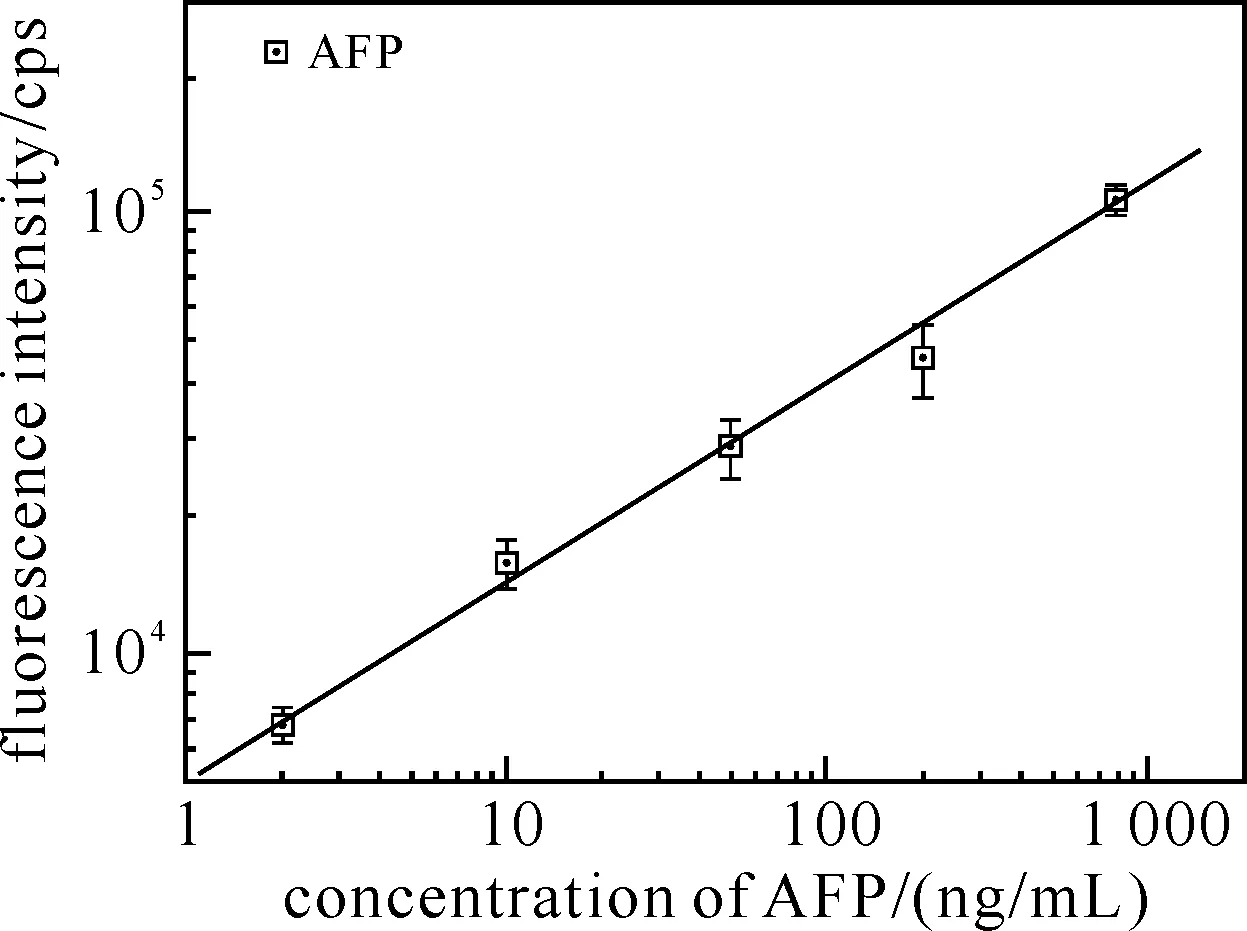

图3 均相时间分辨荧光免疫分析CEA、AFP和HBsAg的工作曲线
3 讨论
根据荧光共振能量转移原理[17],使用到的稀土铽金属螯合物与镶嵌在纳米微球的量子点之间发生能量转移的佛斯特距离(Förster distance)R0:

其中,QD为能量供体荧光量子产率;N为阿弗加德罗常数;n为折射率,极稀的缓冲液的n与纯水的接近,约为4/3;К2为能量供体和受体动力学运动系数,通常情况下其值为2/3;FD(λ)和εA(λ)分别为能量供体荧光发射谱和能量受体的摩尔激发光谱(如图1所示),λ为波长.本实验中能量供体为稀土金属铽螯合物,其量子产率QD=67%,依据其时间分辨荧光发射光谱与能量受体量子点纳米微球的摩尔激发光谱,计算出各色量子点的R0分别为R0,565=6.2 nm、R0,605=7.4 nm和R0,655=8.3 nm;
而荧光共振能量转移效率(其中r为能量供体铽螯合剂与受体量子点的空间距离):

发生时间分辨荧光能量转移效率E具有实际意义,其值应满足0.015 与此同时,使用双抗体夹心法形成的免疫复合体的数量越多,其形成的铽螯合剂与量子点的匹配就越多,不同的量子点纳米微球标记有不同的抗原对应的单克隆抗体,进而实现抗原的定性定量分析.其表现在于量子点的荧光信号强弱与抗原的量成线性关系,如图3所示.由此可见,检测CEA、AFP和HBsAg抗原的工作曲线呈线性关系,其函数分别为:LogY=2.791 73+0.915 84 LogX(R=0.998 08)、LogY=3.695 43+0.456 44 LogX(R=0.998 48)和LogY=4.128 98+0.409 45 LogX(R=0.998 45),由此计算其分析灵敏度(阴性信号+2倍信号标准偏差)分别为:0.44、0.24和0.02 ng/mL. 另外,在已知CEA、AFP和HBsAg浓度的血清样品中分别加入纯抗原,使得血清中抗原浓度达到期望浓度,并计算其回收率,结果如表4所示. 表4 均相时间分辨荧光免疫分析CEA、AFP和HBsAg回收率测试结果 以上分析结果表明了新型多元均相时间分辨荧光免疫分析的建立,同时反映了铽螯合剂与量子点纳米微球在分析诊断领域潜在的应用价值. 本课题研究了一种基于量子点纳米微球的制备及新型均相时间分辨荧光分析方法.首先是将3种不同发射波长或不同颜色的脂溶性量子点包被入羧酸改性的胶乳制备出量子点纳米微球;之后,进行微球非特异性处理,得到量子点纳米微球.分别将该纳米微球和稀土金属铽螯合物与待测CEA、AFP和HBsAg抗原配对的两株单克隆抗体偶联.最后,利用双抗体夹心法,检测待测标准品CEA、AFP和HBsAg,实现多元均相时间分辨荧光分析.当然FRET还可用于蛋白质构象变化[19]、监测蛋白之间的交换反应以及进行酶活性等小分子分析等[20].总之,基于量子点纳米微球的分析技术,不仅可提高分析灵敏度,还可以减少对昂贵红敏光子探测器的依赖,在临床分子诊断和食品检测等生物化学分析中具有非常重要的意义. [1] De Pauw P E, Vermeulen I, Ubani OC, et al. Simultaneous measurement of plasma concentrations of proinsulin and C-peptide and their ratio with a trefoil-type time-resolved fluorescence immunoassay[J]. Clin Chem,2008,54(12):1990-1998. [2] Bacigalupo M A, Meroni G, Secundo F, et al. Time-resolved fluoroimmunoassay for quantitative determination of ampicillin in cow milk samples with different fat contents[J]. Talanta,2008,77(1):126-130. [3] 徐伟文,吴英松,杭建峰,等.时间分辨荧光免疫法定量检测AFP试剂盒临床应用研究[J].标记免疫分析与临床,2006,13(1):43-45. [4] Kimura H, Matsumoto K, Mukaida M. Rapid and simple quantitation of methamphetamine by using a homogeneous time-resolved fluoroimmunoassay based on fluorescence resonance energy transfer from europium to Cy5[J]. J Anal Toxicol,2005,29(8):799-804. [5] Leblanc V, Delaunay V, Claude Lelong J, et al. Homogeneous time-resolved fluorescence assay for identifying p53 interactions with its protein partners, directly in a cellular extract[J]. Anal Biochem,2002,308(2):247-254. [6] 王永成,唐棣,常文宝,等.时间分辨荧光免疫分析法间接测定雌二醇[J].分析科学学报,2001,17(2):89-92. [7] Chan W C, Nie S. Quantum dot bioconjugates for ultrasensitive nonisotopic detection[J]. Science,1998,281(5385):2016-2018. [8] Dahan M, Lévi S, Luccardini C, et al. Diffusion dynamics of glycine receptors revealed by single-quantum dot tracking[J]. Science,2003,302(5644):442-445. [9] Resch-Genger U, Grabolle M, Cavaliere-Jaricot S, et al. Quantum dots versus organic dyes as fluorescent labels[J]. Nat Methods,2008,5(9):763-775. [10] 张海丽,刘天才,王建浩,等.量子点成像的新研究进展[J].分析化学,2006,10(1):1491-1495. [11] Liu T C, Huang Z L, Wang H Q, et al. Temperature-dependent photoluminescence of water-soluble quantum dots for a bioprobe[J]. Anal Chim Acta,2006,559:120-123. [12] Dong Z N, Wu Y S, Wang Z, et al. Effect of temperature on the photoproperties of luminescent terbium sensors for homogeneous bioassays[J]. Luminescence,2013,28(2):156-161. [13] Wang H Q, Liu T C, Cao Y C, et al. A flow cytometric assay technology based on quantum dots-encoded beads[J]. Anal Chim Acta,2006,580:18-23. [14] Cao Y C, Liu T C, Hua X F, et al. Quantum dots optical encoded polystyrene beads for DNA detection[J]. J of Biomed Opt,2006,11:054025. [15] Chen M J, Wu Y S, Lin G F, et al. Quantum-dot-based homogeneous time-resolved fluoroimmunoassay of alpha-fetoprotein[J]. Analytical Chimica Acta,2012,741:100-105. [16] Dong Z N, Wu Y S, Wang Z, et al. Effect of temperature on the photoproperties of luminescent terbium sensors for homogeneous bioassays[J]. Luminescence,2013,28(2):156-161. [17] Foster T. Intramolecular energy migration and fluorescence[J]. Ann Phys,1948,2:55-75. [18] Riegler J, Ehlert O, Nann T. Afacile method for coding and labeling assays on polystyrene beads with differently colored luminescent nanocyrstals[J]. Anal Bioanal Chem,2006,383:645-650. [19] Day R N, Periasamy A, Schaufele F. Fluorescence resonance energy transfer microscopy of localized protein interactions in the living cell nucleus[J]. Methods,2001,25:4-18. [20] Li J J, Bugg T D. A fluorescent analogue of UDP-N-acetylglucosamine:application for FRET assay of peptidoglycan translocase Ⅱ(MurG)[J]. Chem Commun,2004,21:182-183.
4 结论

