基于人工微台阶分选与捕获肿瘤细胞的微流控芯片
洪丹丹,蔡博,王加庆,国世上,赵兴中,刘威
(武汉大学物理科学与技术学院,人工微结构教育部重点实验室,湖北 武汉 430072)
0 引言
在过去的二三十年间,生活节奏加快,不健康的生活方式和高危食品的出现,以及人类生存环境持续恶化等因素使得恶性肿瘤致死占据了我国人口死因的第一位.我国在恶性肿瘤的预防、早期诊断、临床治疗等方面发展不足,对于中晚期恶性肿瘤的治疗效果不能令人满意.这些不完善的地方不仅给患者家人和亲友带来沉重的经济负担和巨大的精神痛苦,也成为影响社会稳定的不良因素.世界卫生组织估计,约有1/3的癌症可因早诊而根治,因此开发新一代的早期诊断手段成为新的攻克恶性肿瘤的热门研究方向.此外,肿瘤的转移和复发是中晚期癌症病人最主要的死因.为降低癌症死亡率,提高生存率以及改善预后患者生活质量,对于肿瘤的转移和复发机制的研究也是当前的一个研究热点[1].
循环肿瘤细胞(circulating tumor cells,CTCs)通常是指来自于原发肿瘤组织,经脱落和侵染而进入人体外周血的细胞.相当多的事实表明CTCs在转移过程中能够在不同的组织上寄居,并可以在许多转移后的固相肿瘤上发现.因而这些细胞可以作为早期肿瘤诊断的重要标志.此外据研究,CTCs在肿瘤的转移和复发中起着重要作用,关于CTCs生理机制的研究对于我们理解肿瘤转移与复发也具有重要意义.然而,CTCs的数目在人体外周血中绝对浓度非常低,这就使得针对CTCs细胞本身的研究非常困难.因此在技术层面上,分选和捕获CTCs是当前CTCs研究领域的一个热点[2].
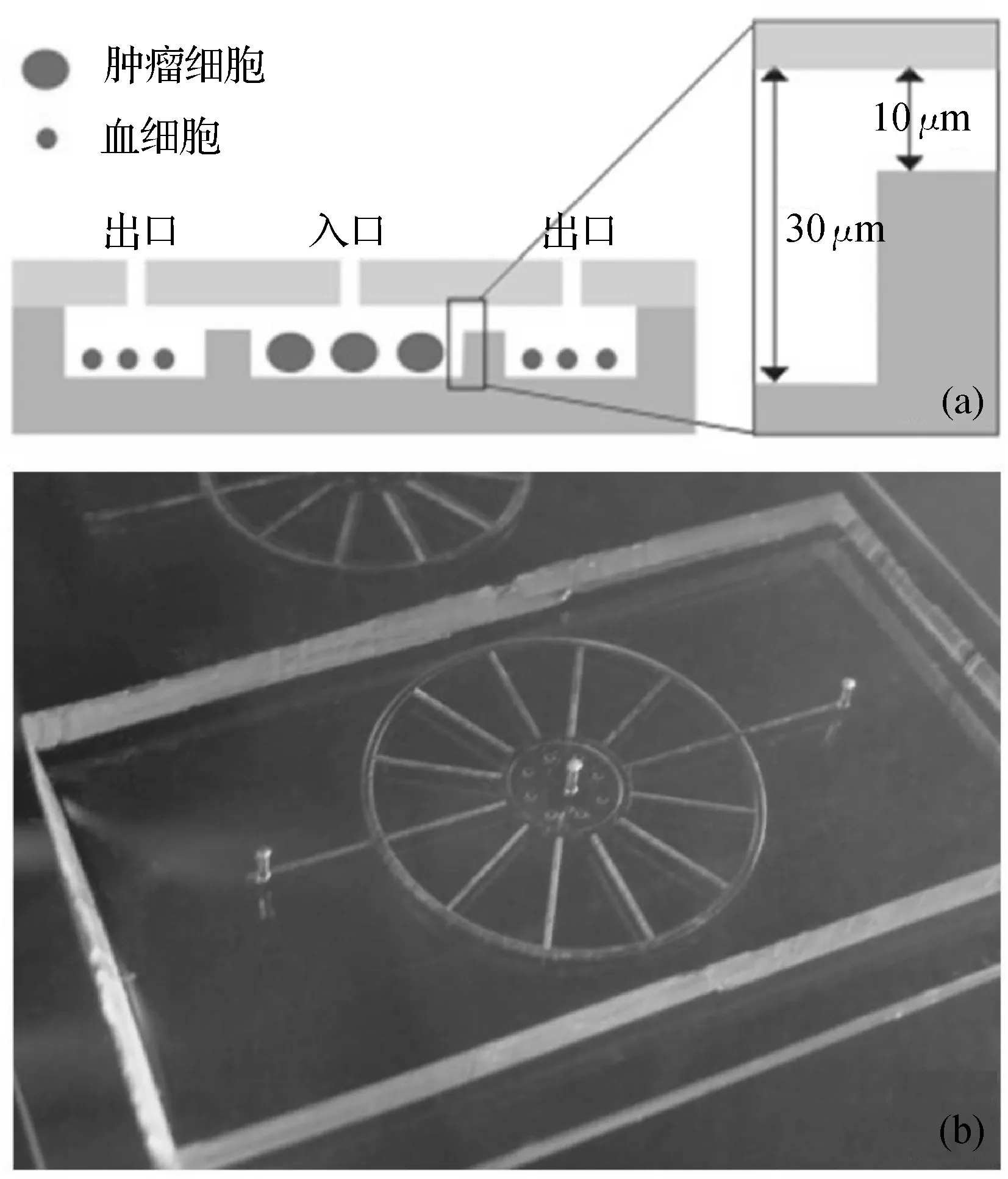
图1 (a)利用具有人工微台阶结构的微流控芯片捕获肿瘤细胞原理图;(b)芯片实物图,器件上部为打孔的PDMS盖片,下部为具有特殊阶梯结构的玻璃衬底.
肿瘤细胞的分选和捕获属于从大量细胞群体中获取某种目标细胞的技术,其在临床医学领域和细胞生物学领域的研究中均有着很高的科学价值.目前常用的细胞分选技术是流式细胞术(flow cytometry),但是由于设备昂贵、体积庞大、需专业人员操作、细胞用量较大等缺点,难在实验室和医院普及推广[3].微流控芯片技术以自身具有的微型化、集成化、自动化、细胞和试剂用量少、污染风险低等优点[4],在一定程度上克服了上述局限性.近期在微流控芯片中使用较多的肿瘤细胞捕获方法是利用针对某些肿瘤细胞中上皮细胞粘附分子(epithelial cell adhesion molecule,EpCAM)的特异性表达来进行特异性分选.美国加州大学洛杉矶分校的Tseng课题组先对基底材料进行特定的表面处理使之具有纳米结构,再进行表面化学修饰将Anti-EpCAM抗体偶联到基底上来捕获肿瘤细胞.但是该方法具有两个明显的不足:1.EpCAM作为一种上皮细胞表面标记物,在不同类型的肿瘤细胞中的表达程度是不一样的,其使用必然受到肿瘤细胞种类的限制.2.对于衬底有相当多的化学修饰步骤,并且此类衬底均需制作有纳米结构[5-6],此过程不仅操作繁琐耗时,而且增加了很多不确定的因素干扰实验的成功率.Tony Huang课题组通过操控声表面波的驻波,利用声辐射力来直接操控肿瘤细胞对其进行分选和捕获[7];Joel Voldman课题组采用介电泳的方法,利用电介质粒子在不均匀电场中受力的不同从而对细胞进行分选和捕获[8].但是外加的声场或者电场都不可避免地对细胞活产生不良影响.美国Veridex公司生产的CellSearch系统是目前市场上唯一通过美国FDA认证的商业化肿瘤细胞专用检测仪器,该仪器基于免疫磁分选技术和免疫细胞化学方法,利用经特异性抗体包被的磁珠对靶细胞进行免疫识别,再借助外加磁场完成细胞的分选,经过免疫细胞化学染色后可借助多重荧光成像技术完成对肿瘤细胞的鉴别和计数检测[9-10].但该仪器的捕获效率不甚理想,同时设备造价和检测费用非常昂贵,因此在基础研究和临床检测领域很难获得推广普及.以上捕获肿瘤细胞的技术需进行化学修饰或者利用声[11-12]、电[13-14]、磁[15-16]等技术,操作过程复杂、耗时,且过多的操作对细胞的活性会有较大的影响,不利于后续的相关实验.此外,虽然不同的微流控芯片器件能够成功地捕获到肿瘤细胞,但它们缺乏在芯片上分析细胞的能力,捕获的细胞需要转移至离心管中后才能进行后续的试验,该转移过程不易做到并且会造成相当量的细胞损失.因此,开发一种流程简便、对细胞损伤小并且可集成多功能细胞生物学操作的微流控芯片来进行肿瘤细胞分选是很有必要的.
实际上,肿瘤细胞也可以因其与血细胞的尺寸不同而被分选出来,而无需利用抗体抗原反应以及相应的化学修饰.这样不仅能更快速地进行细胞筛选,而且由于不需要考虑抗原特异性表达的情况而能够捕获更多种类的肿瘤细胞[17-18].因此在本文中,我们结合标准光刻技术和湿法刻蚀方法,设计并制作了以玻璃和有机高聚物PDMS为材料的具有人工微台阶结构的微流控芯片.该芯片由捕获腔室、分选细胞的微台阶结构以及排液区组成,如图1所示.该芯片可以有效捕获悬浮于磷酸盐缓冲盐溶液中的肿瘤细胞以及混合于正常血细胞中的肿瘤细胞,操作简便,被捕获的细胞可保持良好的活性,同时芯片的透明玻璃基底便于对捕获的细胞进行实时原位观测.与此同时,被捕获与固定在芯片中的细胞可进行一系列后续实验,诸如免疫荧光染色、荧光原位杂交等.
1 实验方法
1.1试剂和材料匀胶铬板:长沙韶光铬板有限公司,型号SG2506,Vm等级,63 mm×63 mm,三层结构(铬型LRC,厚145 nm,光胶类别S-1805,厚570 nm);
刻蚀液:由体积比为1∶0.5∶0.5的2 mol/L HF∶2 mol/LNH4F∶2 mol/L HNO3配制而成;
去铬液:由25 g硝酸铈铵和6.45 mL高氯酸(70%)溶于110 mL的去离子水中而成.
聚二甲基硅氧烷(Polydimethylsiloxane,PDMS):GE Toshiba Silicones Co. Ltd(USA),型号RTV615.
1.2细胞培养和细胞悬浮液的准备乳腺癌肿瘤细胞系MCF-7由武汉大学中南医院肿瘤科提供,培养在含有10%的胎牛血清和1%的青霉素和链霉素的DMEM(Dulbecco’s modified eagle’s medium)培养基中,培养箱条件为37 ℃和5%的二氧化碳.在收获细胞之后,将含有细胞的培养基以1 000 r/min离心后去除上清液,再将细胞按需要的浓度重新悬浮于磷酸盐缓冲液中备用.
1.3 微流控芯片的制作
1.3.1 具有特殊阶梯结构的玻璃基底的制作 采用标准光刻技术与湿法刻蚀方法相结合的加工方法制备微流控芯片.首先利用CorelDraw软件设计实验所须掩膜图形,采用高分辨率的激光照排机在胶片上制得光刻掩膜.
将掩膜与铬板光胶层贴紧并用铁夹固定以保证掩膜紧贴铬板,避免由于空隙造成光的衍射而导致曝光不足或通道变形.再将铬板放置在光刻机下方曝光,利用掩膜对铬版上的光刻胶进行选择性紫外光照射.在光照的地方光刻胶发生化学反应,性质发生变化,在显影时被显影液除去,未曝光部分则相反,从而获得与掩膜相同的图形.曝光后,将铬版放入0.5% NaOH溶液中显影,几秒钟后即可显影完全.之后用水冲洗掉多余显影液,吹干水分后把铬板放置于110 ℃烘台上10 min以固化剩余光胶.
待铬板冷却至室温后放入去铬液中除去裸露的铬层,可得到有透明通道图形的基片.在基片背面以及边缘贴上胶带纸作为保护层,浸入盛有刻蚀液的塑料盒中,在40 ℃水浴环境中进行刻蚀.通过控制刻蚀液浓度和刻蚀时间可以控制通道的深度.
之后将基片除去胶带纸并清洗干净吹干,用匀胶机再次在铬版表面旋涂一层AZ5214正光刻胶,匀胶后120 ℃烘烤10 min,利用另一块掩模进行紫外曝光.此时掩膜需要对准之前刻蚀的沟道以保证进行第二次湿法刻蚀之后可在玻璃基底上形成阶梯结构.将曝光后的基片经过显影、去铬、刻蚀再去铬的过程之后清洗干净,我们即制得了具有微台阶结构且透明的单层玻璃基底.
1.3.2 PDMS盖片的制作 在平整的玻璃板上浇注以5∶1的比例混合均匀的PDMS的A胶和B胶,80 ℃烘烤2 h进行固化,切片后按实验所设计的图样用空心管切割法对PDMS打孔,其与制备好的有微结构的玻璃基片一起经过氧等离子处理后使得PDMS层与玻璃基片键合在一起.芯片置于80 ℃的烘箱中烘3 h左右即可使用.整个芯片的制作流程如图2所示.
1.4 肿瘤细胞捕获及染色
1.4.1 悬浮于磷酸盐缓冲液中的肿瘤细胞捕获及染色 将浓度为每毫升溶液有2×106个的MCF-7细胞悬浮液加入到1 mL注射器内,利用聚四氟乙烯导管连接好注射器和芯片.将注射器装配到注射泵上,把芯片固定在显微镜(IX71,Olympus)的载物台上.调节注射泵流速,利用电荷耦合器件(Charge-coupled Device,CCD)进行观察和拍摄.捕获完成后,用注射泵向芯片里通入FDA/PI(fluorescein diacetate/propidium iodide,二乙酸荧光素/碘化丙啶)混合溶液进行染色,染色完成后通入磷酸盐缓冲液以去除多余的染色剂,利用荧光显微镜进行观测和记录.
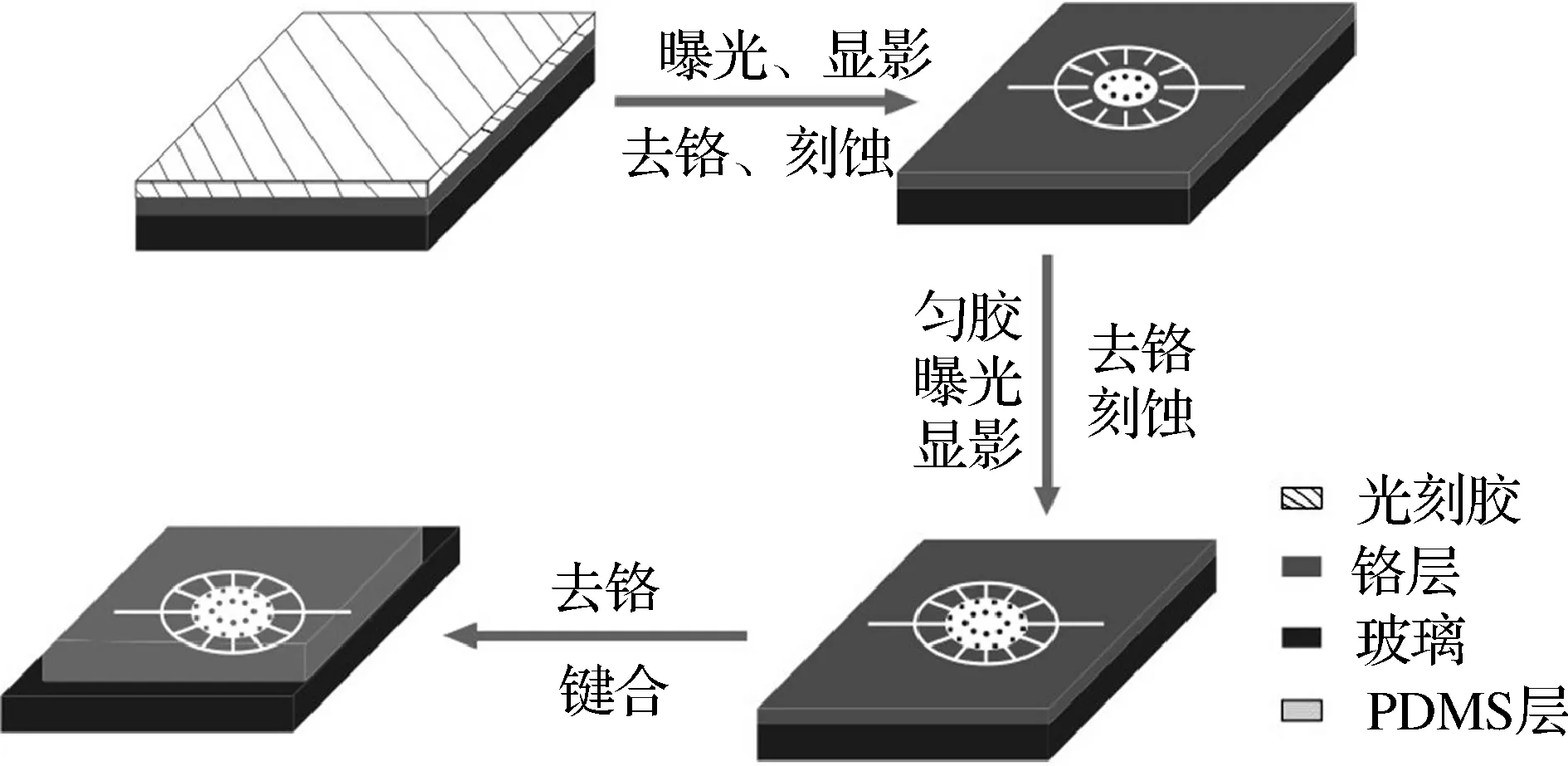
图2 微流控器件的制作流程图
1.4.2 对混合于正常血细胞中的肿瘤细胞的特异性捕获 用于制备正常血细胞/肿瘤细胞混合悬液的健康人血液样本由武汉大学中南医院血液检验科提供.利用淋巴细胞分离液对血液进行梯度离心处理,取用分离出来的正常血细胞(红细胞)并重悬于磷酸盐缓冲液后向其中加入含有肿瘤细胞MCF-7的磷酸盐缓冲液并充分混合均匀.将该正常血细胞/肿瘤细胞混合悬液加入到1 mL注射器,利用聚四氟乙烯导管连接好注射器和芯片.将注射器装配到注射泵上,并把芯片固定在显微镜的载物台上.调节注射泵流速,利用CCD进行观察和拍摄该芯片从正常血细胞/肿瘤细胞混合悬液中特异性捕获肿瘤细胞.
2 结果与讨论

图3 芯片特殊阶梯处被捕获的MCF-7细胞
2.1芯片设计与加工我们通过将铬板经微加工处理而形成的一个具有微台阶结构的玻璃基片之后与PDMS层相键合来制成具有人工微台阶结构的微流控芯片.芯片的沟道及捕获腔室的深度由两次腐蚀的时间决定,第一次腐蚀后,细胞捕获腔室区域和沟道的深度约有20 μm,与此同时在捕获肿瘤细胞的圆形腔室周围由于有铬层的保护未被腐蚀而形成20 μm高的台阶.第二次腐蚀的深度为10 μm,在第一次腐蚀区域上增加了对台阶的腐蚀,因而台阶处形成的沟道深度是10 μm,其他沟道以及细胞捕获腔室的深度均为30 μm.鉴于乳腺癌细胞系MCF-7的尺寸主要集中在22 μm左右,因此芯片可以捕获MCF-7乳腺癌细胞.捕获效果如图3所示.
芯片沟道宽度200 μm,细胞捕获腔室深度约为30 μm,因而芯片中流体阻力非常小,使得我们可以在保持细胞悬液的较高流速(100 μL/h)下仍然有着较好的捕获效果,提高了芯片的捕获通量.较大的细胞捕获腔室使得后续的片上肿瘤细胞培养、药物筛选等应用成为可能.利用均匀分布于捕获区域的微柱阵列可以有效避免因流速等因素造成的PDMS层与微台阶间的高度发生微小的变化,使得整个腔室以及台阶与PDMS层间的高度保持均匀恒定,从而保持细胞捕获率的稳定.此外,刻蚀在玻璃上的微结构非常稳固,进行相关的清洗后该芯片可以重复使用.
2.2细胞捕获与后续染色利用制作好的微流控芯片,我们能便捷快速地捕获到大量的肿瘤细胞.作为片上细胞生化处理的展示,我们直接在芯片上进行了细胞FDA/PI染色的活性测试实验.FDA是一种可进入活细胞脱脂释放荧光素显荧光的荧光指示剂,常用于检测细胞存活率.PI则是一种可对DNA染色的细胞核染色试剂,常用于对凋亡细胞的检测.通常将FDA和PI两者一起使用,能同时对活细胞和死细胞染色.作为检测细胞活性的常用试剂,FDA本身不发荧光,渗入活细胞后释放出荧光素,在蓝色光激发下发射出黄绿色的荧光;PI只能进入有缺损或固定的死亡细胞,在绿色光激发下发出橘红色的荧光.图4为利用本芯片对于MCF-7细胞悬浮液进行细胞捕获以及FDA/PI染色后的图片,绝大部分被捕获的肿瘤细胞发射出强烈的FDA(即黄绿色)荧光,只有极少数细胞显现出PI(即橘红色)荧光,这表明绝大部分细胞都具有良好的活性.

图4 (a)芯片中固定住的MCF-7细胞中的绝大部分在约488 nm波长的激发光下发射出FDA荧光;(b)芯片中固定住的MCF-7细胞中只有很少的几个细胞在约536 nm波长的激发光下发射出PI荧光
整个捕获过程中无须其他操作,在快速简便地捕获细胞后可在芯片上直接通入染色液即可对于捕获的细胞进行染色处理以验证细胞活性.如果有其他研究需要,我们同样可以通入其他的试剂,在芯片上直接对细胞进行相关处理,简便的操作手段即可实现更深入的研究.
2.3捕获人造血中的肿瘤细胞人体血液主要由液态的血浆和悬浮于其中的血细胞组成.血细胞的尺寸一般不大于10 μm,肿瘤细胞的尺寸通常在10~40 μm(实验用乳腺癌细胞系MCF-7尺寸为22 μm左右).利用正常血细胞与肿瘤细胞之间这种在大小尺寸上的明显差异,我们设计的具有特殊高度微台阶结构的微流控芯片就能够有效将肿瘤细胞从正常血细胞中分离并捕获下来。在实验中,我们选取了血细胞的最主要成分的红细胞作为对照,在悬浮有红细胞中混合进一定量的肿瘤细胞(乳腺癌细胞系MCF-7),在两种细胞混合均匀后将该混合悬液通入制作好的该微流控芯片中,我们能非常直观地观察到尺寸较大的肿瘤细胞由于微台阶作用而被特异性捕获,而尺寸较小的红细胞则快速地流出捕获区并从排液区流走,从而完成了对不同尺寸的细胞进行分选,特异性捕获尺寸较大的肿瘤细胞的功能,如图5所示.

图5 连续地特异性捕获正常血细胞/肿瘤细胞悬浮液中的肿瘤细胞(a)(b)(c)中线框部分连续地表明一个红细胞穿过捕获区域并流向排液区.图中明显可见较大的肿瘤细胞被捕获于特殊微台阶处,而较小的红细胞则会穿过捕获区流向排液区.
由于我们设计的具有特殊人工微台阶结构的微流控芯片是基于细胞的尺寸来对不同的细胞进行分选,因此对于不同种类大小不一但尺寸又明显区别于正常血细胞的各类肿瘤细胞,我们可以通过改变刻蚀时间来调节微台阶的高度对这些不同种类的肿瘤细胞进行捕获,这就使得该芯片可以广泛地处理不同肿瘤类型的血液样品,具有高度的通用性和灵活性.该芯片可以简便快速地从正常的血细胞中捕获到肿瘤细胞,在实际的临床应用和相关研究方面都具有相当大的潜力.
3 结论与展望
我们结合微加工技术设计并制作了具有人工微台阶结构用以捕获肿瘤细胞的微流控芯片.利用该芯片能够有效地捕获到悬浮于磷酸盐缓冲盐溶液中的大量的乳腺癌细胞,且被捕获的细胞具有良好的活性.通过芯片的透明玻璃基底可以对捕获的肿瘤细胞进行实时原位观测.此外,利用该芯片,我们可以快速有效地特异性分离并捕获正常血细胞/肿瘤细胞混合悬液中的肿瘤细胞.该芯片操作非常简便,可重复利用,处理速度快,在对于细胞活性要求比较高的相关细胞研究领域以及时间宝贵的临床应用中,这无疑是一大优势.此外,我们可以通过控制刻蚀时间以控制台阶的高度对不同尺寸的细胞进行捕获和分析,这使得该芯片具有更为广泛的应用前景.
[1] 张南刚.基于微流控技术的循环肿瘤细胞的捕获及检测的研究[D].武汉:武汉大学,2012.
[2] Gupta1 G P, Massagué1 J. Cancer metastasis:building a framework[J]. Cell,2006,127(4):679-695.
[3] Bare J C, Miller O J, Taly V, et al. Fluorescent-activated droplet sorting(FADS): efficient microfluidic cell sorting based on enzymatic activity[J]. Lab Chip,2009,9(13):1850-1858.
[4] 林炳承,秦建华.微流控芯片实验室[M].北京:科学出版社,2006:1-11.
[5] Wang S T, Wang H, Jiao J, et al. Three-dimensional nanostructured substrates toward efficient capture of circulating tumor cells[J]. Angew Chem,2009,121(47):9132-9135.
[6] Zhang N G, Deng Y L, Tai Q D, et al. Electrospun nanofiber-based cell capture assay for detecting circulating tumor cells from colorectal and gastric cancer patients[J]. Adv Mater,2012,24(20):2756-2760.
[7] Ding X Y, Sz-Chin Steven Lin, Lapsley M I, et al. Standing surface acoustic wave(SSAW) based multichannel cell sorting[J]. Lab Chip,2012,12(21):4228-4231.
[8] Voldman J Annu. Electrical forces for microscale cell manipulation[J]. Rev Biomed Eng,2006,8:425-454.
[9] E Racila, D Euhus, A J Weiss, et al. Detection and characterization of carcinoma cells in the blood[J]. P Natl Acad Sci USA,1998,95(8):4589-4594.
[10] Furlani E P. Magnetophoretic separation of blood cells at the microscale[J]. J Phys D Appl Phys,2007,40(5):1313-1319.
[11] Nam J, Lee Y J, Shin S. Size-dependent microparticles separation through standing surface acoustic waves[J]. Microfluid Nanofluid,2011,11(3):317-326.
[12] Nam J, Lim H J, Kim D, et al. Separation of platelets from whole blood using standing surface acoustic waves in a microchannel[J]. Lab Chip,2011,11(19):3361-3364.
[13] Han K H, Han A, Frazier A B. Microsystems for isolation and electrophysiological analysis of breast cancer cells from blood[J]. Biosensors and Bioelectronics,2006,21(10):1907-1914.
[14] Gascoyne P R C, Vykoukal J. Particle separation by dielectrophoresis[J]. Electrophoresis,2002,23(13):1973-1983.
[15] Pamme N, Wilhelm C. Continuous sorting of magnetic cells via on-chip free-flow magnetophoresis[J]. Lab Chip,2006,6(8):24-38.
[16] Kirby D, Siegrist J, Kijanka G. Centrifugo-magnetophoretic particle separation[J]. Microfluid Nanofluid,2012,13(6):899-908.
[17] Chung J, Shao H L, Reiner T, et al. Microfluidic cell sorter(μFCS) for on-chip capture and analysis of single cells[J]. Adv Healthcare Mater,2012,1(4):432-436.
[18] Hosokawa M, Hayata T, Fukuda Y, et al. Size-selective microcavity array for rapid and efficient detection of circulating tumor cells[J]. Anal Chem,2010,82(15):6629-6635.

