自体骨髓间充质干细胞移植对急性心肌梗死后心功能不全家兔基质金属蛋白酶-9的影响
李树仁 王天红 刘东霞 张素巧 乔建晶 胡 炜 荀丽颖 郝淸卿 苑可心 吴 迪 董 洁 齐晓勇
(河北省人民医院心脏内科,河北 石家庄 050051)
基质金属蛋白酶(MMPs)的表达和活性的增加,在急性心肌梗死(AMI)后心室重塑过程中具有重要的推动作用〔1,2〕。近来,应用选择性MMPs抑制剂缓解左室扩张,减轻心肌梗死后心室重塑,取得了一定成果,抑制MMPs表达可能将成为AMI后防治心室重塑的新途径〔3〕。最近又发现骨髓间充质干细胞(BMSCs)也可以抑制MMPs表达,缓解左室扩张,减轻心肌梗死后心室重塑〔4,5〕。目前,多数BMSCs移植主要从细胞增殖及机械功能角度分析心功能及毛细血管再生情况。而对于BMSCs归巢后是否通过改变MMPs的表达影响对周围间质纤维化重塑研究较少。因此,进一步明确BMSCs对心肌梗死后抑制心室重塑的影响有可能揭示BMSCs治疗心肌梗死的新机制。本实验通过复制家兔心肌梗死后心衰模型,观察BMSCs移植后MMP-9、核转录因子-κB(NF-κB)及心功能的变化,探讨BMSCs移植影响梗死后心室重塑的机制。
1 材料与方法
1.1 材料 5月龄健康雄性新西兰白兔34只,体重1.8~2.3 kg,随机分为假手术组、AMI后心衰模型组、BMSCs移植组。组间体重差异无显著性(P>0.05)。以上动物均由河北医科大学实验动物中心提供(许可证号:SCXK冀2008-1-003),实验家兔依照美国国立卫生研究所颁布的《实验动物饲养和使用指南》(NIH publication No.23-85,revised 1996)受到良好对待。实验试剂:低糖DMEM培养基胎牛血清(美国hyclone公司);Percoll原液(美国Pharmacia公司);DAPI(瑞士Roche公司);5-氮胞苷(美国SIGMA公司)。
1.2 方法
1.2.1 BMSCs的分离、培养、诱导及标记 取雄性新西兰白兔,在股骨处,予2%利多卡因局麻后,用骨穿针垂直刺入骨髓腔,外接肝素(250 U,1 ml)润洗过的10 ml无菌注射器,抽取5 ml骨髓,放入10 ml离心管中,加等量DMEM液稀释。梯度密度离心法及贴壁法分离、提取、培养BMSCs。于移植前2 h用含DAPI(50 μg/ml)标记培养基继续培养2 h。移植前使用PBS洗6遍。最后收集1×107BMSCs用DMEM浓缩至1 ml,移植备用。取一滴DAPI标记过的BMSCs于载玻片上,用荧光显微镜观察DAPI标记情况。
1.2.2 兔AMI后心衰模型的制备和BMSCs移植
1.2.2.1 兔AMI后心衰模型的建立 兔称重后,仰卧于手术台,经兔耳缘静脉注射3%戊巴比妥钠1 ml/kg麻醉后,剪除胸毛、消毒铺无菌洞巾,沿胸骨正中线第2,3肋间稍偏左切皮,做长约3 cm切口,分离肋间肌、剪断肋骨、剪开心包暴露心脏,用6/0医用无损伤缝扎左冠状动脉前降支中段紧邻第一对角支处,观察心电图动态变化。心电图可见相应导联ST段抬高,同时肉眼观察结扎区域心肌变白为结扎成功,逐层关胸,缝合切口。术后3 d肌注青霉素80万U预防感染。术前及术后2 h记录体表心电图。
1.2.2.2 细胞移植 AMI术后14~21 d,仍以3%戊巴比妥钠1 ml/kg耳缘静脉麻醉兔子二次开胸,再次行胸骨左侧切口打开胸腔,暴露心脏,选取心肌梗死周边区域4个注射点,分别注射PBS液及BMSCs悬液。每点注射体积0.25 ml,注射位置以6/0手术线标记。3/0手术线关胸。术后分笼精心饲养,术后3 d肌注青霉素80万U预防感染。
1.2.3 超声心动图左心功能测定 采用美国惠普公司5500型彩色多普勒超声心动图仪在术前、AMI后7 d、细胞移植后28 d分别由同一专科医生进行超声心动图检测。二维记录胸骨旁左室长轴、短轴和心尖两腔、四腔图像,与左室长轴和短轴切面记录M型曲线。重点测算左室舒张末内径(EDD)、左室射血分数(EF)、短轴缩短率(FS),所有测量值均取3次测量的平均值,由超声心动图医生进行操作。
1.2.4 取材 各项检测完成后,各组动物饲养至细胞移植后4 w,在全身麻醉下再次开胸,心内注射10%氯化钾2 ml使心脏停搏于舒张期,迅速取下心脏,冰盐水冲洗干净,在相应梗死周边区切取标本,置入液氮罐冷冻保存备用。
1.2.5 ELISA法测血清MMP-9的浓度 分别于术前、心梗后7 d、细胞移植后28 d(处死前)经耳缘静脉抽血2~3 ml,避免溶血,抗凝剂用EDTA,2 000 r/min离心8 min,取上清-20℃保存,采用ELISA检测血清MMP-9的浓度。试剂盒由美国ADL公司提供,严格按照试剂盒说明书操作。
1.2.6 采用RT-PCR的方法检测心肌组织NF-кB、MMP-9 mRNA表达 试剂:RNA提取试剂Trizol Reagent为Invitrogen公司产品;逆转录酶(M-MLV)、核糖核酸酶抑制剂(RNasin)、dNTP、Taq DNA聚合酶、随机引物、琼脂糖为美国Promega公司产品;荧光定量试剂盒:Hot Start Fluorescent PCR Core Reagent Kits(SYBR Green I),BBI公司。
RNA提取:取约100 mg组织于冰浴匀浆器中,加入1 ml Trizol(Invitrogen,USA),迅速研磨成匀浆液,加入 200 μl氯仿,震荡 30 s,冰上放置 5 min。4℃,12 000 r/min,离心 10 min,取上层水相转移至另一1.5 ml离心管中,加入等体积的异丙醇,颠倒混匀,-20℃ 静置 2 h。然后 4℃,12 000 r/min,离心20 min,弃 上 清,加 入 1 ml 75% 乙 醇,轻 轻 混 匀,4℃,12 000 r/min,离心10 min,吸净上清液,于室温下晾干,加入20 μl DEPC处理的去离子水溶解沉淀。反转录(RT):(试剂盒:Promega,USA)42℃ RJ 50 min,95℃ 5 min灭活反转录酶。Syber Green荧光定量PCR检测:〔Hot Start Fluorescent PCR Core Reagent Kits(SYBR Green I),BBI〕。仪器型号:ABI 7300 Real-Time PCR System,美国ABI公司。PCR热循环参数:96℃ 4 min,然后三步反应:94℃ 30 s,58℃ 30 s,72℃ 30 s,进行 40 个循环,于每个循环的第三步即:72℃ 30 s收集荧光信号。扩增完毕后,进入结果分析界面,以GAPDH为内参照基因,与对照组相比,得到目的基因表达的相对定量值(RQ值),将RQ值用于统计分析。
各基因引物序列:NF-κB:扩增片段长度:121 bp,上游引物:5'TACGGCTTCCCACACTATGG3';下游引物 5'TCACAACATCCAGGGTCAGT3';MMP-9:扩增片段长度:71 bp,上游引物:5'CAGCGAAAGACTCTACACCCA3',下游引物 5'CCTGGAAGATGAACGGAAACTC3';GAPDH:扩增片段长度:92 bp,上游引物:5'CAAGAAGGTGGTGAAGCAGG3',下游引物5'CACTGTTGAAGTCGCAGGAG3'。
1.2.7 BMSCs形态变化的观察 取诱导培养4 w BMSCs,取生长旺盛的细胞经消化、离心成团块(小米粒大小),2.5%戊二醛固定2 h,1%饿酸固定1 h,梯度乙醇脱水,812树脂包埋,Leica UCT超薄切片机切片,日立H-7500透射电镜超微结构观察。
1.3 统计学处理 采用SPSS13.0统计软件包进行统计学处理。计量资料以s表示。多组资料之间的比较采用单因素方差分析,多组间均数对比采用q检验。
2 结果
2.1 BMSCs形态观察 通过Percoll密度梯度离心,大部分细胞于12 h贴壁,可获得BMSCs。72 h可见贴壁生长以分散、克隆集落方式增殖,少量细胞拉长呈纺锤形紧贴培养瓶底部生长繁殖,其中悬浮不贴壁生长的圆形细胞为幼稚血细胞,在培养过程中通过全量换液绝大部分被弃除。5~7 d后细胞开始快速增殖,集落逐渐增大。11~14 d细胞集落间出现相互融合,细胞铺满单层,呈旋涡状排列。大部分呈长梭形,少数三角形、多角形。密集处中心的细胞由多边形转变为梭形。胞核较大,多为卵圆形,也有圆形、不规则形,其中可见处于分裂期的核仁,胞体肥大,胞质丰富,大多数细胞有伪足。诱导后细胞的透射电镜观察:诱导后的细胞中可见到兼有BMSCs和肌细胞特点的过渡类型的细胞其电镜特点为:胞核不规则,核膜有皱褶,海绵状核仁大且明显,位于胞核中央。细胞器比较丰富,除线粒体及粗面内质网外,还可见到肌丝团样结构和Z线物质,构成类似原始的肌小节样结构。荧光显微镜下观察DAPI标记的BMSCs:经DAPI标记2 h后,在荧光显微镜下可观察到DAPI标记的BMSCs。细胞移植28 d后,处死家兔后,取梗死周边区域组织,经冰冻切片机切片后,在荧光显微镜下可观察到的经DAPI标记的移植BMSCs。见图1。
2.2 家兔AMI后心力衰竭模型的建立 一般状况:34只新西兰白兔完成了手术,处死前有24只成活。其中对照组8只全部存活;AMI后心衰模型组存活8只,死亡4只;BMSCs组存活8只,死亡6只。共10只动物死亡,4只于结扎冠状动脉LAD后诱发室颤死亡,2只于心梗模型制作成功后呼吸骤停死亡,另外4只于二次开胸细胞移植后24 h内死亡。
心电图改变:结扎冠状动脉LAD后,心电图的胸导联出现T波高尖、ST段抬高,Ⅱ、Ⅲ导联出现T波倒置、ST段压低。随着梗死时间的延长ST段逐渐升高,2 h时ST段抬高的幅度为(0.23 ±0.14)mv。
心脏超声检查结果:①通过心脏超声检查发现术前家兔心脏各项指标均正常。与对照组相比,术后7 d AMI后心衰模型组及BMSCs组,家兔前壁室壁运动减弱,个别动物前壁室壁无运动。②术前各组的EDD、EF、FS均无显著性差异。AMI后心衰模型制作后7 d:AMI后心衰模型组、BMSCs组的EF值比对照组降低(P<0.05);AMI后心衰模型组、BMSCs组的组间EF值差异无统计学意义。③细胞移植后28天,正常对照组、BMSCs组EDD均明显低于AMI后心衰模型组(P<0.05),EF及FS均明显高于AMI后心衰模型组(P<0.05)。见表1。
2.3 血清MMP-9浓度检测结果 对照组与AMI后心衰模型组、BMSCs组的血清MMP-9浓度在手术前无显著差异(P>0.05);手术后7 d,与正常对照组相比AMI后心衰模型组、BMSCs组的血清MMP-9的浓度均显著增加(P<0.05);细胞移植后28 d,BMSCs组的血清MMP-9的浓度比AMI后心衰模型组显著降低(P<0.05),正常对照组略低于BMSCs组,但无显著性差异。见表2。
2.4 心肌组织MMP-9及NF-κB的RT-PCR检测结果 细胞移植后28 d,与正常组相比,AMI后心衰模型组、BMSCs组的MI边缘区的MMP-9及NF-κB的表达均显著增加(P<0.05);BMSCs组MMP-9及NF-κB比AMI后心衰模型组表达显著降低(P<0.05)。见表3。
表1 各组兔心功能测定(n=8,s)

表1 各组兔心功能测定(n=8,s)
与对照组比较:1)P<0.05;与模型组比较:2)P<0.05,下表同
组别 EF(%)术前 AMI后7 d 移植后28 d 8 34.5±3.1 13.5±1.0 14.0±1.4 13.9±1.0 AMI后心衰模型组 71.4±4.1 51.6±4.51)57.1±5.51) 33.6±3.5 23.5±3.71)23.5±4.81)2)13.2±1.0 17.0±1.31)16.7±1.11)BMSCs组 72.4±5.4 52.6±4.01)2)67.0±5.81)2)34.9±3.9 25.5±4.41)31.0±5.91)2)13.5±1.1 17.6±1.41)2)14.7±1.41)2)28 d对照组 73.8±3.4 68.3±1.4 70.5±3.6 36.1±2.9 34.1±2.FS(%)术前 AMI后7 d 移植后28 d EDD(mm)术前 AMI后7 d 移植后
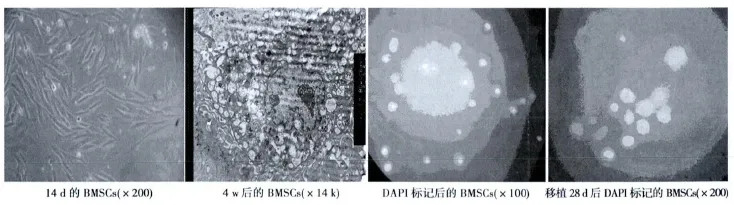
图1 BMSCs形态观察
表2 各组兔血清MMP-9测定结果(n=8,s)
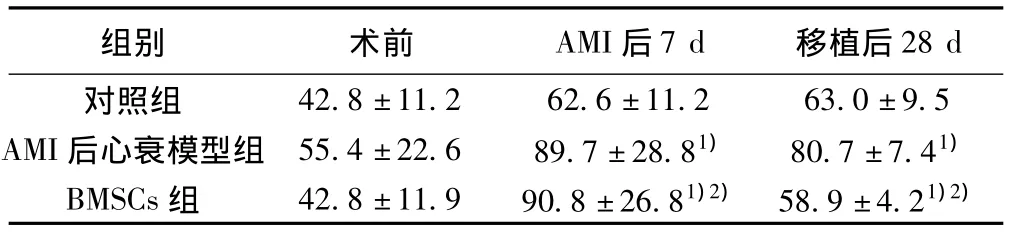
表2 各组兔血清MMP-9测定结果(n=8,s)
42.8±11.2 62.6±11.2 63.0±9.5 AMI后心衰模型组 55.4±22.6 89.7±28.81) 80.7±7.41)BMSCs组 42.8±11.9 90.8±26.81)2) 58.9±4.21)2)28 d对照组组别 术前 AMI后7 d 移植后
表3 移植后28 d兔心肌组织MMP-9及NF-κB 水平( s,n=8)

表3 移植后28 d兔心肌组织MMP-9及NF-κB 水平( s,n=8)
组别 MMP-9 NF-κB 1.648±0.676 0.092±0.066 AMI后心衰模型组 5.538±2.3371) 1.331±0.5201)BMSCs组 2.479±1.7871)2) 0.593±0.4751)2)对照组
2.5 心功能与心肌组织MMP-9、NF-κB的相关性 细胞移植后28 d时,EF与血清 MMP-9呈负相关(r=-0.501,P=0.013),与心肌组织MMP-9呈负相关(r=-0.822,P<0.001),与心肌组织NF-κB呈负相关(r= -0.866,P<0.001)。
3 讨论
心室重塑是AMI后发生慢性心力衰竭的主要病理基础,是MI后心力衰竭及死亡的最主要原因,通过减缓或抑制不利的心室重塑过程可以改善MI后心脏的功能〔6〕。研究表明,AMI后MMPs的表达在梗死愈合、基质降解、细胞移行以及心室重塑方面起重要作用〔1,2,7〕。研究表明骨髓干细胞移植后可以改变AMI后心室重塑过程中MMPs的活性,从而减轻左室重构,明显改善整个左心室几何形状,使AMI后的左室射血分数提高〔8,9〕,但其机制目前尚不完全清楚。
本研究说明移植的BMSCs一定时间内在梗死边缘区的存活对改善心功能起者一定作用。AMI时,心肌坏死引起剧烈的炎症反应。梗死区炎症细胞浸润,释放大量炎症因子(包括TNF-α),刺激梗死区单核巨噬细胞和成纤维细胞释放MMPs,心肌坏死为不可逆过程,梗死区的修复主要靠瘢痕的形成,如早期MMPs分泌过多,不利于瘢痕修复,梗死区心肌软化,AMI时心室舒张末期压力升高,这就使梗死区与非梗死区的矛盾运动更明显,加剧了梗死后的心室重塑。BMSCs本身可分泌多种细胞因子〔8,10〕,这些因子中,有的具有抗心肌细胞凋亡作用,这就使TNF-α等炎症因子减少,炎症细胞如单核巨噬细胞和成纤维细胞减少,其释放的MMPs也会减少,从而阻止胶原蛋白网被降解,相对增加胶原沉积和纤维化,改变基质重构,有利于心功能改善。TNF-α可影响MMP表达。Wang等〔11〕研究了充血性心衰患者血浆TNF-α水平与心肌MMP-2,3,9表达相关性。TNF-α增加了人心房成纤维细胞增殖和 MMP-9分泌。Xie等〔12〕研究了MMP-2和MMP-9的表达调控以及成体大鼠心脏成纤维细胞的激活与IL-1β的相关性,发现ERK1/2和JNKs的激活对MMP-9的表达和激活起重要作用;NF-κB的激活刺激了MMP-2和MMP-9的表达。前期研究也发现BMSCs移植可以减轻 MI后的炎症反应〔8〕。
细胞外基质(ECM)的重塑在左心室重塑过程中发挥着重要作用。ECM的减少、降解和成分的变化加重了左心室扩张和破裂。MMPs是心室重塑过程中心脏基质降解的主要因素,其活性升高可引起纤维胶原降解增加、细胞外基质重构和心室扩张,其对心室重塑发生起着决定性作用〔13〕。MMP-9是 MMPs中重要的一种,具有高度保守的依赖于锌离子的内切蛋白水解酶,可降解基底膜和细胞外基质的大多数蛋白质。Rohde等〔14〕证明经广谱MMPs抑制剂处理的猪MI模型与对照组相比,舒张末期容积和收缩末期容积均减小。表明在梗死后重构的调节过程中非胶原因素起决定性的作用。应用选择性MMPs抑制剂缓解左室扩张,减轻MI后心室重塑,可能将成为今后AMI治疗的新途径。Li等〔15〕也发现同样BMSCs移植减少宿主心肌间质Ⅰ型和Ⅲ胶原表达。这提示在梗死后心肌组织中,通过MMPs的上调及TIMPs的下调调节了胶原为主的细胞外基质成分的变化,影响了梗死后心室重塑的病理过程;而骨髓干细胞移植的移植则抑制或逆转了这种变化,表现为MMPs的下调及TIMPs的上调,继发引起胶原量的减少,从而阻止或逆转了心室重塑的发展。
本研究发现:在梗死周围区域BMSCs移植组的MMP-9的mRNA水平较AMI后心衰模型组明显降低,通过心脏超声检查我们也发现BMSCs移植组心功能较AMI后心衰模型组明显改善,提示MI后在心肌组织中,通过MMP-9的上调,调节了以胶原为主的细胞外基质成分的变化,影响了梗死后心室重塑的病理过程;而BMSCs的移植则抑制或逆转了这种变化,表现为MMP-9的下调,继发引起胶原量的减少,从而阻止或逆转了心室重塑的发展。本实验还说明BMSCs移植也同样减轻了血液中MMP-9的浓度,与上述结论一致。综上表明BMSCs移植可以减轻MI后MMP-9的表达,BMSCs通过减轻MMPs的表达也可能是BMSCs移植治疗MI后心衰的重要机制之一。
NF作为信号转导途径中的一环,负责细胞内的信息交流及综合,作用于胶原基因的调控,在组织器官纤维化形成中有意义。NF-κB是最重要核转录因子之一,其作为信号转导途径中的枢纽,与多种生理、病理作用有关,分泌白细胞介素、肿瘤坏死因子、细胞黏附分子、干扰素等炎性介质,产生急性炎症反应。NF-κB是静息状态下以失活状态存在于细胞质中,在外界因素刺激下,NF-κB得以激活并移位进入细胞核,启动基因转录〔16〕,激活基质金属蛋白酶基因的转录。
有研究证明,在心脏重构中起中心作用的MMP-9,其转录直接由 NF-κB 调控〔17,18〕,在梗死后重构过程中,通过抑制 NF-κB,直接或通过抑制炎症反应间接导致MMP-9表达的减少,对细胞外间质重构起有益的作用〔2〕。本文发现:BMSCs移植后可抑制了梗死周围区NF-κB的表达,BMSCs心肌移植后,可能通过抑制NF-κB由细胞核外移至核内的激活及减轻炎症反应,从而抑制MMPs的表达,导致胶原等细胞外基质的变化,抑制了胶原的合成及沉积,从而阻止了梗死后的心室重塑。
1 Jugdutt BI.Ventricular remodeling after infarction and the extracellular collagen matrix:when is enough enough〔J〕?Circulation,2003;108(11):1395-403.
2 Trescher K,Bernecker O,Fellner B,et al.Inflammation and postinfarct remodeling:overexpression of IκB prevents ventricular dilation via increasing TIMP levels〔J〕.Cardiovasc Res,2006;69(3):746-54.
3 Jiang B,Chen J,Xu L,et al.Salvianolic acid B functioned as a competitive inhibitor of matrix metalloproteinase-9 and efficiently prevented cardiac remodeling〔J〕.BMC Pharmacol,2010;10:10.
4 Okada M,Yamawaki H,Hara Y.Angiotensin II enhances interleukin-1 beta-induced MMP-9 secretion in adult rat cardiac fibroblasts〔J〕.J Vet Med Sci,2010;72(6):735-9.
5 张 瑶,李永俐,李丽丽,等.骨髓间质干细胞移植对心力衰竭大鼠心室重构影响的实验研究〔J〕.中华心血管病杂志2009;37(4):347-51.
6 Brower GI,Gardner JD,Forman MF,et al.The relationship between myocardial extracellular matrix remodeling and ventricular function〔J〕.Eur J Cardio-thoracic Surg,2006;30(4):604-10.
7 Peterson JT,Li H,Dillon L,et al.Evolution of matrix metalloprotease and tissue inhibitor expression during heart failure progression in the infarcted rat〔J〕.Cardiovasc Res,2000;46(2):307-15.
8 李树仁,齐晓勇,胡福莉,等.两种骨髓间充质干细胞移植改善猪心室重构机制的研究〔J〕.中华医学杂志(英文版),2008;121(23):2403-9.
9 Rossini R,Senni M,Musumeci G,et al.Prevention of left ventricular remodeling after acute myocardial infarction:an update〔J〕.Recent Pat Cardiovasc Drug Discov,2010;5(3):196-207.
10 李树仁,齐晓勇,张建青,等.不同类型的骨髓间质干细胞移植改善心梗的心室重构〔J〕.中国组织工程与临床康复,2008;12(47):9371-7.
11 王先梅,杨丽霞,祝善俊.肿瘤坏死因子α和基质金属蛋白酶家族与左室重构的关系〔J〕.中华内科杂志,2004;43(11):823-31.
12 Xie Z,Singh M,Singh K.Differential regulation of matrix metalloproteinase-2 and-9 expression and activity in adult rat cardiac fibroblasts in response to interleukin-1beta〔J〕.J Biol Chem,2004;279(38):39513-9.
13 Creemers E,Cleutjens J,Smits J,et al.Matrix metalloproteinase inhibition after myocardial infarction:a new approach to prevent heart failure〔J〕?Circ Res,2001;89:201-10.
14 Rohde LE,Ducharme A,Arroyo LH,et al.Matrix metalloproteinase inhibition attenuates early left ventricular enlargement after experimental myocardial infarction in mice〔J〕.Circulation,1999;99(23):3063-70.
15 Li L,Zhang Y,Li Y.Mesenchymal stem cell transplantation attenuates cardiac fibrosis associated with isoproterenol-induced global heart failure〔J〕.Transpl Int,2008;21(12):1181-9.
16 Jones WK,Brown M,Ren X,et al.NF-κB as an integrator of diverse signaling pathways:the heart of myocardial signaling〔J〕.Cardiovasc Toxico1,2003;3(3):229-54.
17 Nakashima H,Aoki M,Miyake T,et al.Inhibition of experimental abdominal aortic aneurysm in the rat by use of decoy oligodeoxynucleotides suppressing activity of nuclear factor kappaB and ets transcription factors〔J〕.Circulation,2004;109(1):132-8.
18 Bond M,Chase AJ,Baker AH,et al.Inhibition of transcription factor NF-kappaB reduces matrix metalloproteinase-1,-3 and-9 production by vascular smooth muscle cells〔J〕.Cardiovasc Res,2001;50(3):556-65.

