hPEDF基因修饰对巨噬细胞条件培养基诱导RPE细胞增殖的影响
刘 姝 王霁雪 王莹雪 吴雅臻 李亚萍 (吉林大学第二医院眼科,吉林 长春 130041)
巨噬细胞和视网膜色素上皮(RPE)细胞是增殖性玻璃体视网膜病变(PVR)中的重要细胞组成成分。巨噬细胞广泛存在于视网膜增殖膜中,在炎症早期和伤口愈合过程中起重要的调控作用,能通过炎症及免疫反应启动和促进眼内细胞增殖。而RPE细胞是视网膜前细胞性膜形成中的主要效应细胞,其增殖常能导致牵拉性视网膜脱离,引发PVR形成。研究发现,巨噬细胞可促进RPE细胞增殖、移行〔1〕。本实验观察巨噬细胞条件培养基诱导RPE细胞及重组人色素上皮衍生因子(hPEDF)基因修饰的RPE细胞的增殖作用,对PEDF在PVR中的作用进行初步的体外研究。
1 材料与方法
1.1 材料 本实验室已构建成功的含有hPEDF基因的真核表达载体pcDNA3-PEDF〔2〕。DMEM培养基、胎牛血清、G418为GIBCO公司产品。脂质体(Lipofectamine 2000)为Invitrogen公司产品。人RPE细胞株(D407)来自广州中山细胞库。抗hPEDF单克隆抗体为R&D公司产品。通用型RT-PCR试剂盒为鼎国生物技术公司产品。淋巴细胞分离液为北京化学试剂公司产品;二甲基亚砜(DMSO)为Sigma公司产品;噻唑蓝(MTT)为Sigma公司产品,用磷酸盐缓冲液(PBS)配成5 g/L的溶液,过滤除菌备用。
1.2 方法
1.2.1 RPE细胞的培养和传代 细胞冻存和复苏:细胞约106,消化离心后弃上清液,加入冻存液(50%培养基+40%胎牛血清+10%DMSO)1 ml,放置于4℃ 2~3 h后改置于-80℃24 h,然后放入液氮中保存。复苏时,将细胞自液氮中取出,37℃水浴迅速摇动溶解,培养瓶中预先加入37℃的培养液,将细胞悬液逐滴加入培养瓶中,摇匀充分混合,静置5%CO2的37℃培养箱培养过夜。用含10%胎牛血清的DMEM培养人RPE细胞株,2~3 d传代1次,于37℃ 5%CO2及饱和湿度环境中培养和传代。
1.2.2 RPE细胞的G418最小致死剂量测定 24孔板接种适量的RPE细胞。细胞长至板底面积50% ~60% 时,加入含有不同浓度 G418(浓度分别为0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1 g/L)培养液。2~3 d换液1 次,10 d左右根据细胞死亡情况确定G418对于RPE细胞的最小致死剂量。
1.2.3 细胞转染和筛选 (1)细胞准备:选取复苏后第2代的RPE细胞进行转染实验。取旺盛生长期的RPE细胞以2×105个细胞/孔,接种六孔培养板,37℃ 5%CO2饱和湿度培养24 h,待其细胞密度(面积百分比)达到90%。(2)细胞转染:无血清、无抗生素的细胞培养基加入转染前的细胞,洗2次;A、B混合液(A液:10 μg PEDF质粒DNA+50 μl无血清培养液;B液:2 μl Lipofectamine 2000+50 μl无血清培养液;合并 A、B 液,置于室温15 min)中加入0.8 ml无血清培养液,混匀后加入培养的细胞,在5%CO2的37℃培养箱放置6 h后弃转染液,加入10%胎牛血清的DMEM继续培养。(3)稳定表达PEDF基因的细胞克隆筛选:72 h后传代,对照组和转染PEDF的细胞以1∶10传代,接种在60 mm的培养皿,加入含G418的选择培养基,14 d后有明显克隆形成,用胰酶消化法转移细胞克隆,分别扩增培养。
1.2.4 转染细胞PEDF的鉴定 选取RPE细胞(复苏后第2代)和转染后的RPE细胞,采用RT-PCR(引物:5'-ATG TCG GAC CCT AAG GCT GT-3';5'-CCC ATC CTC GTT CCA CTC AA-3')及免疫细胞化学染色检测有无PEDF表达。
1.2.5 巨噬细胞条件培养基的制备 收集肝硬化腹水患者腹腔穿刺液2 L,离心后倾去上清后加入6 ml D-Hank液混匀,然后加于3 ml淋巴细胞分离液之上,2 000 r/min密度梯度离心。回收第2层白色膜状层,D-Hank液洗涤3次,加入10%胎牛血清DMEM培养液,制成细胞悬液,置于75 ml培养瓶中,37℃ 5%CO2孵箱内孵育30 min,去除未贴壁细胞,加入含0.1%利多卡因的DMEM培养液孵育30 min,解除巨噬细胞贴壁,1 000 r/min离心5 min,DMEM洗涤2次,获得高纯度的巨噬细胞。经细胞计数后以1×106/ml接种于24孔培养板内,加DMEM(不含血清)至 1 000 μl,37℃ 5%CO2孵箱内孵育培养24 h,取上清,1 000 r/min离心5 min,-20℃保存备用。
1.2.6 MTT比色法 取培养的RPE细胞及重组hPEDF基因修饰的RPE细胞,以5×103个细胞/孔接种于96孔板内,37℃5%CO2培养箱中孵育48 h,细胞近融合时,吸出孔内液体,加入等量不含血清的DMEM 24 h,细胞生长同步化后,进行分组实验。设立正常对照组和实验组。实验组分别加入巨噬细胞条件培养基,浓度分别为12.5%、25.0%、50.0%的体积分数。液体总量200 μl/孔,分别培养24、48、72 h,作用时间完成后,每孔加入MTT溶液20 μl,37℃ 5%CO2继续孵育4 h,终止培养。吸出孔内全部液体,每孔加入150 μl DMSO,室温下摇晃震荡30 min,使结晶完全溶解,于酶标仪上570 nm波长处以空白孔调零,测各孔OD值。每一浓度设8个平行孔。
1.3 统计学方法 采用SPSS13.0统计软件进行分析,数据以s表示,采用方差分析、q检验。
2 结果
2.1 RPE细胞对G418的耐受试验 加入G418后第4天,高浓度(0.7~1.1 g/L)孔内出现细胞死亡脱落现象;第12天,0.3 g/L浓度孔内可见少数细胞存活生长,0.4 g/L及以上浓度孔内均无细胞生长。因此,0.4 g/L G418可作为RPE细胞neo基因的筛选浓度。
2.2 转染细胞的筛选 转染后的RPE细胞加入含0.4 g/L G418的选择培养基,14 d后有明显克隆形成,用胰酶消化法转移细胞克隆扩增培养。
2.3 转染前后RPE细胞形态观察 稳定表达PEDF的RPE细胞株表现出类似原代RPE细胞的形态,细胞排列致密,大量色素分布于细胞质内,围绕细胞核。而未转染的PRE细胞呈均一透明的梭形。见图1。
2.4 转染细胞PEDF表达的RT-PCR检测结果 提取的RPE细胞总RNA,OD260/OD280为1.8~2.0,说明提取的RNA纯度较高;1.5%琼脂糖凝胶电泳可见清晰的28 S和18 S亚基泳带(图2),表明所提取的RNA完整,可用于进一步实验。在没有转染的细胞中,未检测到PEDF mRNA特异性的表达条带,pcDNA3-PEDF质粒转染后的RPE细胞内检测到PEDF mRNA的表达,RT-PCR产物凝胶电泳,可见PEDF mRNA特异条带出现。见图3。
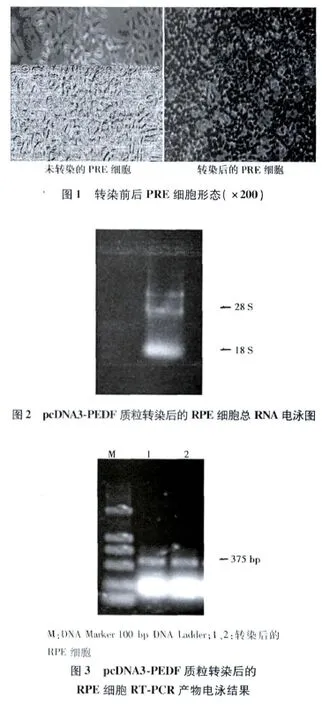
2.5 免疫细胞化学染色结果 pcDNA3-PEDF转染的RPE细胞经G418筛选后,在盖玻片上培养24 h,采用免疫细胞化学染色鉴定表达PEDF的转染RPE细胞,结果显示RPE细胞内有PEDF阳性表达。见图4。
2.6 MTT分析结果 巨噬细胞条件培养基可诱导RPE细胞增殖,作用24、48、72 h后,各个浓度的实验组OD值较之相应时间的对照组均不同程度增加(P<0.01);巨噬细胞条件培养基亦对重组hPEDF基因修饰的RPE细胞的增殖有诱导作用,除巨噬细胞(12.5%)24 h组外,其余各个浓度的实验组较之相应时间的对照组均不同程度地引起OD值增加(P<0.01或P<0.05)。重组hPEDF基因修饰的RPE细胞及未转染的RPE细胞在无巨噬细胞条件培养基诱导的情况下,仅于培养72 h两组间OD值差异有显著性(P<0.05)。应用不同浓度的巨噬细胞条件培养基诱导重组hPEDF基因修饰的RPE细胞及未转染的RPE细胞相应时间的实验组之间比较,OD值有显著性差异(P <0.01)。见表1,表2。
图4 免疫细胞化学染色结果(×200)
表1 不同浓度巨噬细胞条件培养基下RPE细胞的OD值变化(s)
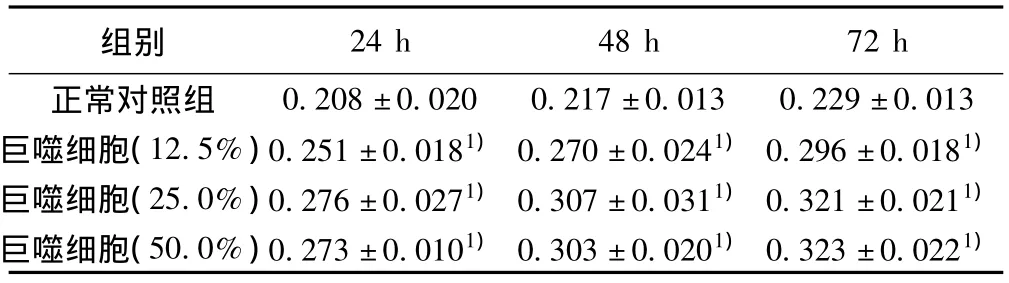
表1 不同浓度巨噬细胞条件培养基下RPE细胞的OD值变化(s)
与正常对照组比较:1)P<0.01
0.208±0.020 0.217±0.013 0.229±0.013巨噬细胞(12.5%)0.251±0.0181)0.270±0.0241)0.296±0.0181)巨噬细胞(25.0%)0.276±0.0271)0.307±0.0311)0.321±0.0211)巨噬细胞(50.0%)0.273±0.0101)0.303±0.0201)0.323±0.0221)24 h 48 h 72 h正常对照组组别
表2 不同浓度巨噬细胞条件下培养基下重组hPEDF基因修饰的RPE细胞的OD值变化(s)
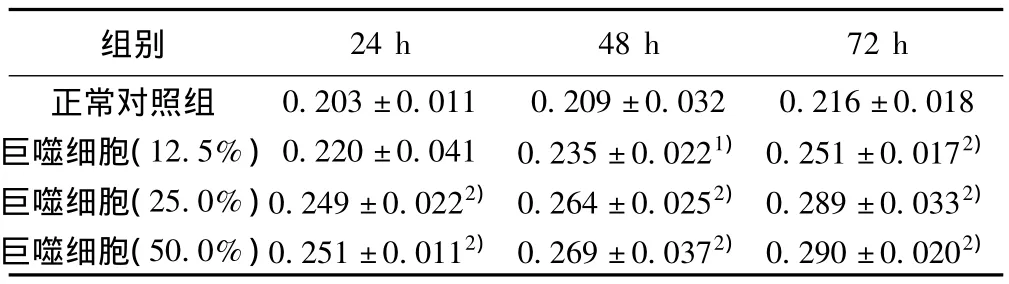
表2 不同浓度巨噬细胞条件下培养基下重组hPEDF基因修饰的RPE细胞的OD值变化(s)
与正常对照组比较:1)P<0.05,2)P<0.01
0.203±0.011 0.209±0.032 0.216±0.018巨噬细胞(12.5%)0.220±0.041 0.235±0.0221)0.251±0.0172)巨噬细胞(25.0%)0.249±0.0222)0.264±0.0252)0.289±0.0332)巨噬细胞(50.0%)0.251±0.0112)0.269±0.0372)0.290±0.0202)24 h 48 h 72 h正常对照组组别
3 讨论
巨噬细胞是PVR形成过程中的细胞因素之一,主要来源于血液、RPE细胞及玻璃体细胞等,在PVR的发病中有着重要作用。首先巨噬细胞是普通炎症反应中较早出现的炎细胞,主要负责吞噬细胞的碎片;其次巨噬细胞还可以产生许多炎前性因子,如:肿瘤坏死因子(TNF)-α,白细胞介素(IL)-1β,IL-6和IL-8等〔3〕,这些细胞因子释放到玻璃体视网膜面,促使细胞外基质产生和沉着,组成可收缩的视网膜前膜成分。
目前认为PVR是眼组织损伤后的一种超常炎症和修复反应。巨噬细胞在损伤修复过程中是必需的,它分泌多种细胞因子和生物活性物质,刺激炎症反应,调控组织修复。在PVR眼的玻璃体液和视网膜下液内检测到多种细胞因子和生长因子,在PVR膜上也检测到许多因子的受体,其中许多因子都是由巨噬细胞分泌的〔4,5〕。体外实验证实,巨噬细胞分泌的物质有促进纤维增生和血管再生的功能,巨噬细胞条件培养液有类似于表皮生长因子(EGF)、血管内皮生长因子(VEGF)、血小板源性生长因子(PDGF)、碱性成纤维细胞生长因子(bFGF)、胰岛素样生长因子(IGF)-I等几种细胞因子促进RPE细胞增生〔6〕的作用。动物实验发现,玻璃体注入巨噬细胞可导致牵引性视网膜脱离,加快PVR形成,巨噬细胞参与了炎症、免疫和损伤修复等病理过程。因而,巨噬细胞介导的炎症反应被认为是PVR中细胞增生的必要条件。
RPE细胞增殖并形成膜是PVR形成的原因,RPE细胞是PVR视网膜前膜最重要的细胞成分。在正常生理状态下,RPE细胞处于静止状态(G0期)不发生增殖;在PVR形成过程中,RPE细胞从原位静止的状态进入细胞周期并开始增殖,发生了一系列改变:RPE细胞迁移、增生、形态变化、产生并表达多种蛋白、合成细胞外基质、纤维瘢痕化等。使RPE细胞重新进入细胞周期的刺激信号还不清楚,可能与细胞间的相互作用产生了诱发细胞增生的分子信号及自分泌,以及对生长因子反应增强等因素有关。因此,以细胞周期阻滞为着眼点,将RPE细胞阻滞在G0期,阻止其重新进入细胞周期,从而抑制细胞增殖的发生,可能是抑制PVR形成的有效途径。
研究表明PEDF是依赖年龄以及细胞周期特异性转录的细胞因子〔7〕,PEDF的表达与细胞增殖密切相关。在G0期细胞中PEDF mRNA的表达和蛋白质的分泌明显高于快速增殖的细胞,PEDF可以抑制细胞进入DNA合成期(S期),使细胞停滞在G0期,从而阻断有丝分裂、细胞增生,诱导分化发生〔8〕。
本研究结果表明,巨噬细胞条件培养基可诱导RPE细胞的增殖,而重组hPEDF基因修饰则可以抑制巨噬细胞条件培养基诱导的RPE细胞的增殖作用。提示PEDF可能在PVR形成过程中起到一定的抑制作用,但其具体机制还有待于进一步的研究。
1 Kirchhof B,Kirchhof E,Ryan SJ,et al.Macrophage modulation of retinal pigment epithelial cell migration and proliferation〔J〕.Graefes Arch Clin Exp Ophthalmol,1989;227(1):60-6.
2 刘 姝,吴雅臻.人色素上皮源性因子基因真核表达载体的构建及在大鼠眼内的表达〔J〕.中国老年学杂志,2007;27(5):415-6.
3 Hui Y,Shi Y,Zhang X,et al.Proinflammatory cytokines in macrophages induced proliferative vitreoretinopathy model of rabbit〔J〕.Chin J Ophthalmol,1999;35(2):140-3.
4 Kenarova B,Voinov L,Apostolov C,et al.Levels of some cytokines in subretinal fluid in proliferative vitreoretinopathy and rhegmatogenous retinal detachment〔J〕.Eur J Ophthalmol,1997;7(1):64-7.
5 Duchek P,Somogyi K,Jekely G,et al.Guidance of cell migration by the Drosophila PDGF/VEGF receptor〔J〕.Cell,2001;107(1):17-26.
6 Takagi H,Yoshimara N,Tanihara H,et al.Insulin-like growth factor-related genes receptors,and binding proteins in cultured human retinal pigment epithelial cells〔J〕.Invest Ophthalmol Vis Sci,1994;35(3):916-23.
7 Kojima T,Nakahama K,Yamamoto K,et al.Age-and cell cycle-dependent changes in EPC-1/PEDF promoter activity in human diploid fibroblast-like(HDF)cells〔J〕.Mol Cell Biochem,2006;293(1-2):63-9.
8 Pignolo RJ,Rotenberg MO,Cristofalo VJ.Analysis of EPC-1 growth statedependent expression,specificity,and conservation of related sequences〔J〕.J Cell Physiol,1995;162(1):110-8.

