血管紧张素Ⅱ和缬沙坦对血管平滑肌细胞增殖和基质金属蛋白酶9表达的影响
周 珂 于弋水
血管平滑肌细胞(vascular smooth muscle cells,VSMC)的增殖和迁移是血管重构的直接原因[1]。细胞外基质(Extra—lularmatrix,ECM)的降解 与VSMC的 增 殖 和 迁 移 密 切 相 关[2],MMP-9 是降解ECM 的关键酶。血管紧张素Ⅱ(AngⅡ)是一种多功能的血管活性肽,研究证实AngⅡ是诱导VSMC增殖的重要因素,且此作用由血管紧张素Ⅱ1型受体(AT1R)介导[3],但AngⅡ在刺激VSMC增殖的同时是否影响MMP-9 的表达,AT1R 拮抗
剂是否影响此作用尚不清楚。本研究以体外培养的VSMC为观察对象,研究了AngⅡ和对VSMC 增殖和MMP-9 表达的作用及AT1R 拮抗剂-缬沙坦(Valsartan)对AngⅡ作用的影响。
1 材料与方法
1.1 材料 血管紧张素Ⅱ、兔抗鼠基质金属蛋白酶-9(MMP-9)抗体购自北京博奥森(BIOS)公司;胎牛血清购自杭州四季青生物工程材料有限公司;抗大鼠α平滑肌肌动蛋白单克隆抗体购自福建迈新生物技术司;SP免疫组化试剂盒购自武汉谷歌公司;Access RT-PCR 试 剂盒 购 自 美 国Promega 公 司;RNA 提取试剂Trizol、高糖的DMEM 培养基、胰蛋白酶购自美国Gibco公司,引物由Gibco公司合成。
1.2 VSMC 的分离培养与鉴定 体质量150~180 g的雄体SD 大鼠购自武汉大学动物中心,断颈法处死大鼠,无菌条件下迅速分离主动脉,组织贴壁法进行原代培养,选用第5~6代细胞进行实验。当细胞生长至80%汇合时,按1×106个/ml接种到六孔培养板以及培养瓶中,待细胞长满后用特异性人抗鼠α平滑肌肌动蛋白单克隆抗体的免疫组化法对VSMC进行鉴定拍片。
1.3 分组 将纯化的VSMC 用0.125%胰蛋白酶消化下来后接种于96孔培养板中无血清培养基饥饿培养孵育24 h,接种密度为2×105/孔,每孔200 μl,空白组只加200μl培养液。待细胞生长融合后,按以下方法分组:AngⅡ组(A 组):直接加入1×10-7mol/L的AngⅡ;AngⅡ+Valsartan组(A+V 组):1×10-6mol/L Valsartan作用0.5 h后再加入1×10-7mol/L AngⅡ;Valsartan组(V 组):直接加入1×10-6mol/L Valsartan;对照组:不加AngⅡ和Valsartan;各组分别作用24 h。
1.4 MTT 法检测VSMC 的增殖率 分别收集各组的细胞和培养基,以单纯的只有培养基者作空白对照,每孔加入0.5 mg/mL 的MTT20 ul反应4 h,加入二甲基亚砜200μl,在波长570 nm 处测定平均吸光度(A),每组重复6孔取其平均A 值。根据平均吸光度A 值计算VSMC 相对增殖率,相对增殖率=(实验组A 值-空白对照A 值)/(对照组A 值-空白对照A 值)×100%
1.5 免疫细胞化学法检测MMP-9 蛋白的表达水平 按以上方法分组,作用24小时后分别收集各组的细胞,按照SP试剂盒说明书所示步骤进行操作。同时设阴性对照,磷酸缓冲液代替一抗。采用Image-Pro Plus system6.01专业图像分析软件进行图像扫描,表达强度用平均吸光度(A)表示。
1.6 RT-PCR 法检测VSMC 中MMP-9mRNA 的表达水平 (1)提取细胞总mRNA 并逆转录为cDNA:按以上方法分组,分别作用24小时后弃去培养基,每107个细胞加入1ml Trizol裂解核蛋白体提取总mRNA,按逆转录试剂盒操作步骤进行逆转录得到cDNA;(2)PCR 引物及扩增条件:MMP9 片段长 度 537bp;上 游 引 物 5’TCCACCAACTGAAGTCTCGCCT 3’,下 游 引 物 5’GCACAATCGCCATAATTATCC3’,内参β-actin,片段长度350bp,上游引物5’GTGGGCCGCTCTAGGCACCAA3’,下游引物为5’CTCTTTGATGTCACGACGATTTC3’,扩增条件:48℃逆转录45 min,94℃放置2 min。循环条件为:94℃变性30 s,60℃退火2 min,68℃延伸2 min,共循环40次,最后一个循环68℃延伸7 min;(3)PCR 扩增产物的测定:扩增的PCR 产物在2%琼脂糖凝胶中100mV下电泳15min,UVP 生物成像系统将凝胶成像,用Gelwork图像分析软件进行扫描和灰度值分析,以β-actin作为内参照,记录并计算MMP-9 条带与βactin的吸光度值的比值。
1.7 统计学处理 采用SPSS13.0统计软件,所有数据均以均数±标准差(±s)表示,多组间数据比较采用单因素方差分析。
2 结 果
2.1 细胞培养的观察和鉴定 原代培养4~10 d均可见有细胞从不同的组织块边缘游出。倒置显微镜下VSMC胞核多为卵圆形,有胞浆丰富,一个或多个核仁,少数细胞有双核或三核。用SP 法免疫细胞化学染色,随机抽取10 个视野(0.04 mm2/视野),计数平滑肌肌动蛋白抗原阳性细胞数和血管平滑肌细胞的纯度。
2.2 AngⅡ和Valsartan对VSMC 增殖的影响AngⅡ组与对照组比较,VSMC 的增殖率升高;AngⅡ+Valsartan组与AngⅡ组比较,VSMC 的增殖率降低,差异均明显(P<0.05)。V 组与对照组比较,VSMC的增殖率差异不明显(P>0.05)(表1)。
2.3 AngⅡ和Valsartan对MMP-9蛋白表达的影响AngⅡ组(0.12±0.009)与对照组(0.05±0.002)比较,MMP-9蛋白表达升高;AngⅡ+Valsartan组(0.06±0.002)与AngⅡ组(0.12±0.009)比较,MMP-9蛋白表达降低,差异均明显(P<0.05)(表1)。
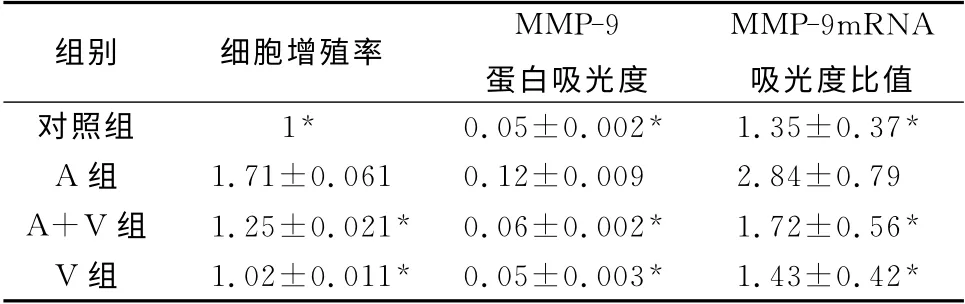
表1 各组VSMC的增殖率和MMP-9表达水平的比较
2.4 AngⅡ和Valsartan对MMP-9mRNA 表达的影响 AngⅡ组与对照组比较,MMP-9mRNA 表达升高;AngⅡ+Valsartan 组与AngⅡ组比较,MMP-9mRNA 表达降低,差异均显著(P<0.05)(表1,图1)。
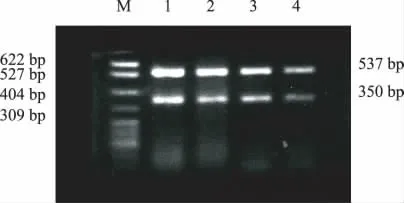
图1 MMP-9mRNA 的表达水平 M 为Marker;1为对照组;2为AngⅡ组;3为AngⅡ+Valsartan组;4为Valsartan组
3 讨 论
血管重构是引起心脑血管病等高血压病并发症的病理基础,研究表明高血压病小动脉的重构特点是以VSMC的增殖和迁移为主[1]。细胞外基质的降解与VSMC的增殖和迁移密切相关,其含量组成的变化也是高血压病、动脉粥样硬化等血管重构的重要机制[2]。
AngⅡ是血管病理生理学的重要介质,VSMC的异常增殖及细胞外基质合成均与AngⅡ有关。AngⅡ对VSMC功能的调节是多方面的,它可直接作用于VSMC,引发细胞收缩或增殖;还可通过诱导VSMC表达、释放多种生物活性物质,产生一系列继发效应;还可通过激活基质金属蛋白酶导致细胞外基质重构。
ECM 异常积聚和降解引起血管重构是AS及血管损伤再狭窄等血管病变的重要原因[2],基质金属蛋白酶系(matrix metalloproteinases,MMPs)是介导此过程最重要的酶类,其中MMP-9是降解细胞外基质尤其是降解阻碍VSMC迁移的基膜成分的关键蛋白酶[4]。Mason等研究发现,MMP-9过度表达可以促进VSMC 迁移至血管内膜,减少内 膜 基 质 含 量[5]。为 了 探 讨MMP-9 对VSMC 增殖和迁移的作用,Asahi M 等利用MMP-9 基因缺失的小鼠实施血管剥脱术后发现,VSMC 迁移和增殖明显减少,MMP-9 活性在正常小鼠动脉检测不到,然而损伤4 h后其活性明显增加,在24 h达到最 高 峰,持 续 高 表 达 至7、14 d后 活 性 消 失[6]。VSMC在损伤6 d后迁移至内膜,与MMP-9 升高时间一致。说明MMP-9 参与调节VSMC 迁移与增殖,其中MMP-9在损伤早期表达对VSMC增殖并迁移的作用至关重要。Cho等利用MMP-9 裸鼠进行实验也发现MMP-9 基因缺失不但有抗VSMCs迁移的作用,而且还能抗细胞增殖,从而抑制内膜增生[7]。
有研究表明MMP-9 的抑制剂BipS 可明显抑制AngⅡ诱导的VSMC迁移[8],提示我们AngⅡ促进VSMC迁移与MMP-9 有关。本实验以大鼠胸主动脉的VSMC为研究对象,观察0.1μmol/LAngⅡ对细胞增殖和MMP-9mRNA 和蛋白表达的影响,结果发现一定浓度的AngⅡ可以诱导动脉的VSMC 增 殖 和MMP-9mRNA 和 蛋 白 表 达 增 高,AngⅡ对血管重构的作用可能与其诱导VSMC 的MMP-9 的表达增加有关,其机制可能与活化一系列信号分子并使核转录因子(NF-KB)磷酸化激活有关,NF-KB是调控MMP-9基因的关键因子。
AngⅡ是通过其受体结合发挥作用的,研究表明AngⅡ导致的血管收缩、细胞增殖等促进重构作用都是通过AT1R 发生的[3]。缬沙坦是AT1R 的高度选择性受体拮抗剂,有研究表明缬沙坦具有剂量依赖性地逆转高血压心室重构的作用,我们以前的研究证实缬沙坦可通过拮抗AngⅡ的局部作用逆转或阻止脑血管重构而发挥脑保护作用[9]。本实验用缬沙坦阻断AT1R 后,发现与AngⅡ组相比,AngⅡ诱导VSMC的增殖和MMP-9的表达增高均受到部分阻断,由此推测AT1R 介导了AngⅡ诱导的VSMC增殖和MMP-9的表达增高,AT1R 拮抗剂可抑制这种作用,减少VSMC 增殖和MMP-9的表达,这为高血压病和动脉粥样硬化等血管增殖性疾病的防治提供了理论依据。
1 William T,Gerthoffer S.Mechanisms of vascular smooth muscle cells proliferation and migration.Exp Physiol,2010,21(1):61-73.
2 ChandrasekarB,Mummidi S,Mahimainathan L.Interleukin-18-induced human coronary artery smooth muscle cell migration is dependent on NF-kappaB and AP-1-mediated matrix metallo proteinase-9 expression and is inhibited by at orvastatin.J Biol Chem,2006,281(22):15099-15109.
3 Brasier AR,Reeinos A,Eledrisi MS.Vascular inflammation and the renin angiotensin system.Arteroscler Thromb Vasc Biol,2002,22(3):l257-l266.
4 Jochen Kunz.Matrix metalloproteinases and atherogenesis in dependence of age.Gerontology,2007,53(2):63–73.
5 Mason DP,Kenagy RD,Hasensta BD,et al.Matrix mctalloprotei-nase-9 overexpression enhances vascular smooth muscle cell migration and alters remodeling in the injured rat carotid artery.Circ Res,1999,85(12):l179-1185.
6 Asahi M,Asahi K,Jung JC.Role for Matrix Metalloproteinase 9 After Focal Cerebral Ischemia:?Effects of Gene Knockout and Enzyme Inhibition With BB-94.Journal of Cerebral Blood Flow& Metabolism,2000,20(12):681–1689.
7 Cho A,Reidy MA.Matrix metalloproteinase-9 is necessary for the regulation of smooth muscle cell replication and migration after arterial injury.Circ Res,2010,91(9):845-851.
8 Saito S,Frank GD,Motley ED,et al.Metalloproteinase inhibitor blocks angiotensinⅡ-induced migration through inhibition of epidermal growth factor receptor transactivation.Biochem Biophys Res Commun,2002,294(5):1023-1029.
9 周 珂,余绍祖,李庚山.缬沙坦对卒中易感型自发性高血压大鼠脑血管结构的影响.临床心血管病杂志,2003,19(4):291-293.

