多重连接依赖的探针扩增(MLPA)技术在自然流产样本检测中的应用
刘敏娟 段程颖 王 玮 阚慧娟 孙 健 王 挺 李 红 陈 瑛
(南京医科大学附属苏州医院生殖与遗传中心 苏州 215002)
自然流产是产科的常见病之一,导致自然流产的原因很多,国内外文献均有报道,自然流产中胚胎染色体异常占50%左右[1]。
目前检测染色体异常的技术有常规的染色体核型分析、荧光原位杂交(fluorescence in situ hybridization,FISH)技术和多重连接依赖的探针扩增(multiplex ligation-dependent probe amplification,MLPA)技术。核型分析是检测染色体异常的常规方法,但其操作过程较长,组织或细胞要经过培养,若培养失败、细胞过少或染色体形态较差时,尤其是流产的绒毛组织存在组织坏死、污染的风险较大,常常影响实验报告的准时发放。另外核型分析难以分辨染色体的微小缺失或重复。FISH较核型分析而言大大缩短了实验周期,并且分辨率提高至1 kb,但其一次实验只能检测较少的位点。
近年发展起来的MLPA具有通量高、分辨率高的特点。MLPA技术由Sehouten等[2]于2002年提出。它利用简单的杂交、连接及PCR扩增反应,于单一反应管内可同时检测40个不同的核苷酸序列的拷贝数变化。到目前为止广泛应用于基因检测及基因诊断等多个领域。由于13、18、21、X、Y染色体非整倍体发生率约占所有染色体非整倍体发生率的65%[3],本实验采用MLPA非整倍体筛查试剂盒,探讨MLPA技术在染色体重复、缺失以及易位时的检出能力,以评价其在自然流产组织遗传分析中的可行性和优越性。
资料和方法
实验材料 在患者或家属知情同意的前提下,收集南京医科大学附属苏州医院生殖与遗传中心经超声检查发现胚胎停止发育后行清宫术的绒毛组织12份。
实验方法
核型分析 用常规绒毛细胞培养和染色体核型分析。
绒毛DNA的提取 挑取流产绒毛约15 mg,采用Qiagen试剂盒提取DNA。用ND-1000测定DNA浓度和D260/D280比值,并将DNA稀释至25 ng/μL。
MLPA反应 本实验采用MLPA SALSA P290-B1试剂盒,其探针混合物包含13条染色体上的51个探针:除21号染色体6个探针,13号、18号、X染色体各4个探针,Y染色体2个探针之外,还包括17号染色体8个探针,15号染色体6个探针,22号染色体5个探针,1号、7号染色体各3个探针,4号、5号、8号染色体各2个探针,依照试剂盒操作说明操作,产物用ABI3130基因分析仪进行毛细管电泳。
数据分析 用Genemarker软件分析MLPA产物的毛细管电泳结果,并与细胞遗传学分析结果比对。
结 果
核型分析 运用常规染色体核型分析12例流产绒毛样本,其中1例因培养失败未能得到核型,故只得到11例核型结果(表1)。样本9核型分析结果为结构异常:46,XX,22q+(图1A),增加的片段来源不明确,怀疑为8号染色体部分片段。样本2核型分析结果为:46,XY,-9,+15?(图2A),缺失一条9号染色体,增加的部分怀疑为15号染色体的部分片段。
MLPA反应 运用MLPA技术成功分析了12例流产绒毛DNA,核型分析未成功的1例样本经MLPA分析未见异常。结合核型分析结果,在这12例样本中共发现7例非整倍体和1例结构异常(表1)。
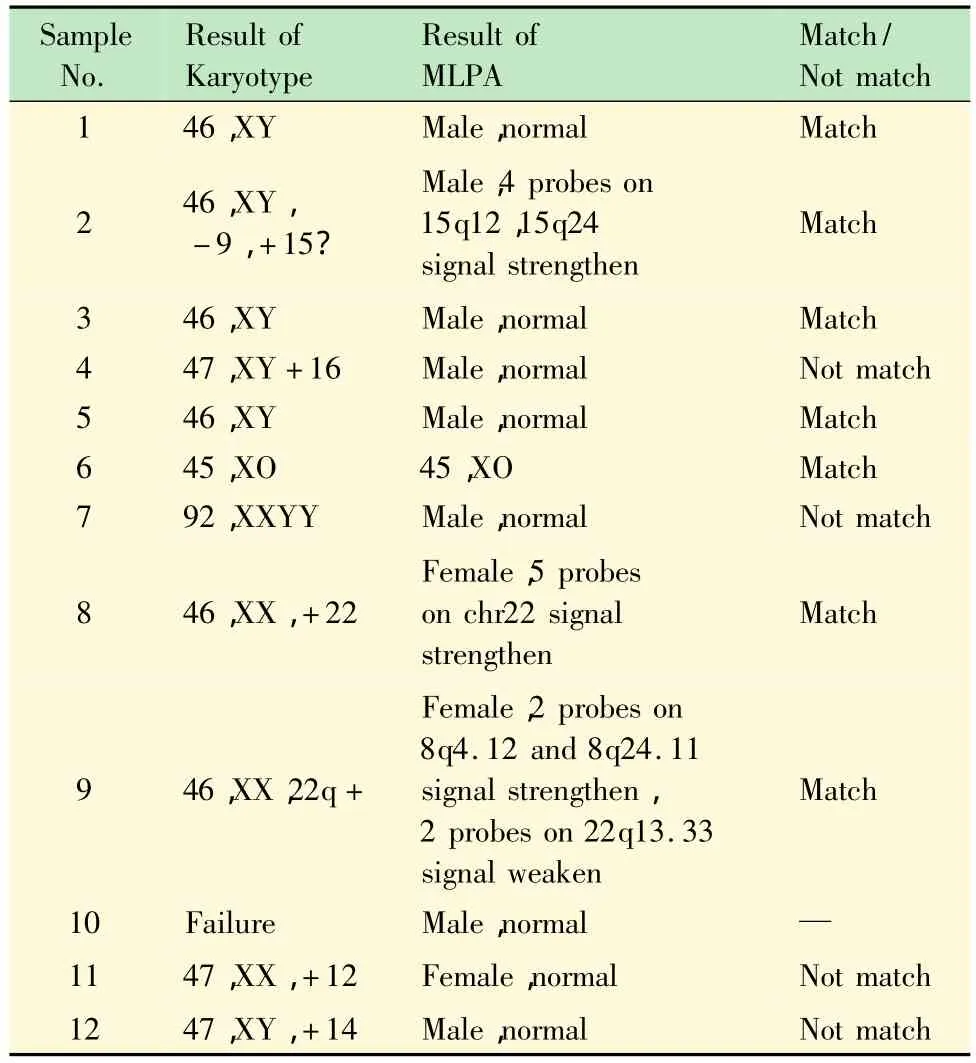
表1 细胞遗传学分析与MLPA技术在流产绒毛染色体检测中的比较Tab 1 The comparison of Karyotype and MLPA in chromosome detection of miscarriage villus
样本9的MLPA检测结果为:女性,8号染色体8q4.12,8q24.11 上2 个探针信号增强,2 个 22q13.33探针信号降低(图1B、C)。提示:22号染色体增加的片段来源于8号染色体,并且22号染色体上22q13.33区段缺失。
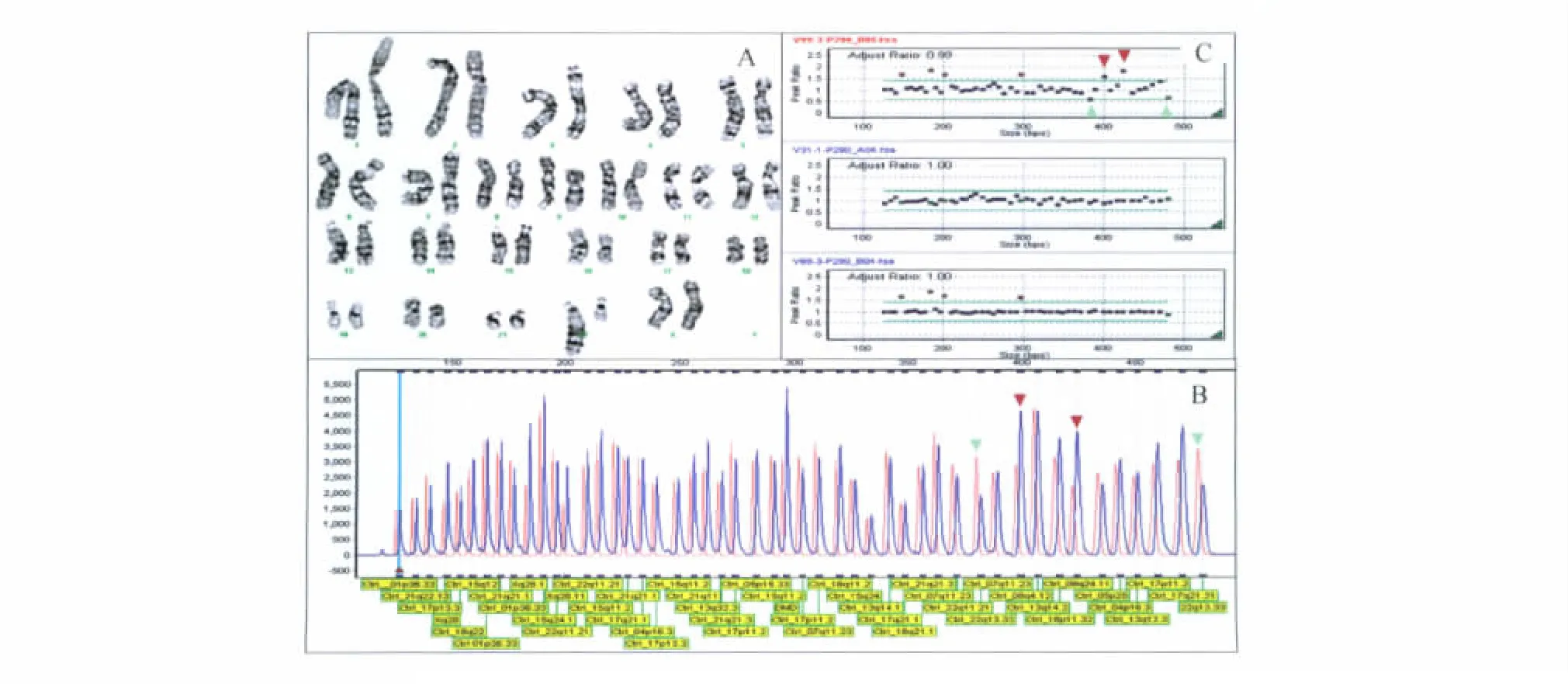
图1 样本9核型分析及MLPA结果图Fig 1 Result of Karyotype and MLPA of subject sample No.9
7例非整倍体样本中,样本2的MLPA检测结果显示:男性,15q11、15q24上4个探针信号增加,确定增加的染色体来源于15号染色体(图2B、C),由于MLPA非整倍体试剂盒不包括9号染色体探针,故该样本9号染色体缺失未检出。
图2 样本2核型分析及MLPA结果图Fig 2 Result of Karyotype and MLPA of subject sample No.2
另有3例核型分析显示12、14、16号染色体上的非整倍体,由于MLPA非整倍体试剂盒中亦不包含12、14、16号染色体上的探针,因此未检出异常。再者,MLPA试剂盒不适用于多倍体的检测,故1例核型分析为四倍体的样本MLPA检测未见异常。
讨 论
孕早期胚胎染色体异常是自然流产的重要原因。有研究表明,自然流产中胚胎染色体异常占50%左右[1]。自然流产胚胎的细胞遗传学研究发现,由于染色体数目异常所致的胚胎发育不良而造成的妊娠中断,是自然流产最常见的原因之一[4]。受精卵细胞的正常分裂是胚胎发育过程中的关键环节,其中染色体分离异常,不仅可导致胚胎的染色体数目异常,而且可影响胚胎细胞的生长周期,引起细胞周期的延迟、细胞分裂的停止,甚至胚胎死亡。
在本实验的流产绒毛染色体分析中,有66.7%(8/12)出现染色体异常,其中结构异常1例,占异常核型的12.5%;数目异常7例,占异常核型的87.5%。细胞染色体数目异常在群体中发生率约3%,在前3个月的自然流产胚胎中发生率可高达50%~60%,这种染色体数目异常的改变主要有常染色体三体、X单体和多倍体等[5]。染色体数目畸变的主要发生源自双亲之一的配子形成时或妊娠初期受精卵卵裂时出现了某号染色体不分离,则导致该染色体增多或减少一条,亦即导致三体性或单体性。21-三体在活产儿中最常见,13-三体、18-三体也偶尔可见,而其他常染色体的三体性大多导致流产,本实验所用的MLPA P290试剂盒主要用于检测13、18及21号染色体的微缺失或微重复。性染色体的三体性在活产女婴中有见,性染色体的单体性不仅见于流产儿,也见于儿童或成人。多倍体在流产儿中也十分常见,本文为1例,占全部样本的8.3%。这种染色体的数目异常可源自新的突变,或源自双亲之一配子形成中的异常有丝分裂或源自精母细胞或卵母细胞减数分裂中的异常,也可源自双受精等。
目前,检测染色体的非整倍性改变的基本方法为染色体核型分析,但是它在检测羊水细胞、绒毛或其他胎儿细胞时,需要进行体外细胞培养,若培养失败、细胞过少或染色体形态较差时,常常影响实验结果。应用MLPA检测这类标本时,不需要体外培养,少量标本即可进行检测,针对易发生非整倍性改变的染色体上的几个热点基因设计特异性探针,根据特定基因拷贝数的改变,即可确定染色体数目的异常。
MLPA具有高度特异性,如果靶序列与探针序列不完全互补,即使只有一个碱基的差别,也会导致杂交不完全,使连接反应无法进行。只有当连接反应完成,才能进行随后的PCR扩增并收集到相应探针的扩增峰,如果检测的靶序列发生点突变或缺失、扩增突变,则相应探针的扩增峰便会缺失、降低或增加,因此,根据扩增峰的改变就可判断靶序列是否有拷贝数的异常或点突变存在。
由于MLPA技术具有方便快捷、特异性高的特点,国内外均有研究将该技术作为核型分析的补充手段,用于胎儿、新生儿及流产组织的非整倍体检测[6-8],这些研究多采用端粒试剂盒(P036、P069 或P070),在核型分析的基础上大大增加了染色体异常的检出率。考虑到流产绒毛染色体的异常多发于13、18、21、X 和 Y 染色体[8],还包括了其他染色体的数目异常[9]和微缺失[10-11]等,为尽可能覆盖与已知流产密切相关的染色体畸变,本实验选择了组合型试剂盒SALSA P290-B1,除能检查常见的13、18、21、X和Y 5条常见染色体非整倍体情况,同时还可对常见14种染色体微缺失/微重复情况进行检测。因为其高度的特异性,本实验中1例结构异常样本,细胞遗传学分析仅能判断出22号染色体上有一段增加的染色体片段,怀疑来源于8号染色体,但无法判断其确切来源,且无法分析微缺失或微重复。MLPA则准确检测出此段染色体来源于8号染色体,并检测出22q13.33有微缺失,可能由于22q13.33区段位于22号染色体长臂末端,在8号染色体片段易位其上时丢失。另外,由于常规的染色体核型分析通过镜下观察,染色体片段较小时判读困难,本实验中1例非整倍体样本细胞遗传学分析结果为:46,XY,-9,+15?,怀疑增加的那条染色体来源于15号染色体,MLPA检测结果为:男性,15q11、15q24上4个探针信号增加,证实增加的那条染色体来源于15号染色体,对核型分析结果起到了补充校正作用。
然而MLPA也有其不足之处,它仅能检测出实验所用探针所指示的位点,也就是说无法检测未知位点的缺失、重复或突变。本实验所用的 MLPA P290-B1试剂盒不包含12号、14号、16号等其他10条染色体信息,故本实验中4例发生在9、12、14、16号染色体上的数目异常未能检出。若能针对相应染色体的热点基因设计特定探针便可解决这一问题。另外,由于MLPA技术是依据基因拷贝数比较来判读结果,不适用于多倍体的检出,故本实验中1例92,XXYY未能检出。
总之,作为一种新的技术,MLPA技术基于其高效、特异、快速、简便的特点,已被运用于18-三体、21-三体、假肥大性肌营养不良、脊髓性肌萎缩症、Dandy-Walker综合征等多种临床疾病的基因检测。但同时仍存有一些不足,如需要精确测量DNA浓度,不适合检测未知突变位点、平衡易位及多倍体。在流产样本的染色体分析中,它能弥补传统细胞遗传学分析的不足,检测微小缺失、重复或突变,且与FISH、微阵列基因组杂交等方法比较,除了具有操作简单快捷的优点外,其经济成本也较低,可广泛应用于临床,作为核型分析的重要补充,以提高染色体异常的检出率。
[1] 李凡,温庆荣,郑胤强,等.79例自然流产绒毛的染色体分析[J].赣南医学院学报,2009,2(3):376 -377.
[2] Schouten JP,McElgunn CJ,WaaijerR,etal.Relative quantification of 40 nucleic acid sequences by multiplex ligation-dependent probe amplification[J].Nucleic Acids Res,2002,30(12):57.
[3] 李晓娟,龚护民,符生苗,等.荧光原位杂交技术在诊断胎儿非整倍体疾病中的应用[J].分子诊断与治疗杂志,2010,2(5):302 -306.
[4] 施琼,王箭,袁泰先,等.染色体数目异常自然流产胚胎有丝分裂关卡蛋白基因的研究[J].解剖学报,2008,39(2):197-201.
[5] Mantel C,GuoY,LeeMR,et al.Checkpoint-apoptosis uncoupling in human and mouse embryonic stem cells:a source of karyotpic instability[J].Blood,2007,109(10):45l8-4527.
[6] 雷琼,王琼,周灿权,等.MLPA联合FISH检测自然流产绒毛组织中染色体嵌合现象[J].中国优生与遗传杂志,2008,16(10):49 -51.
[7] Diego AD,Rodriguez de AM,Cardero MR,et al.MLPA as a screening method of aneuploidy and unbalanced chromosomal rearrangements in spontaneous miscarriages[J].Prenat Diagn,2007,27(8):765 -71.
[8] McClelland LS,Allen SK,Larkins SA,et al.Implementation and experience of an alternative QF-PCR and MLPA diagnostic strategy to detect chromosomal abnormalities in fetal and neonatal pathology samples[J].Pediatr Dev Pathol,2011,14(6):460 -468.
[9] Nagaishi M,Yamamoto T,Iinuma K,et al.Chromosome abnormalities identified in 347 spontaneous abortions collected in Japan[J].J Obstet Gynaecol Res,2004,30(3):237-241.
[10] Pina-Aguilar RE,Martinez-Garza SG,Kohls G,et al.Y chromosome microdeletions in Mexican males of couples with idiopathic recurrent pregnancy loss[J].J Obstet Gynaecol Res,2012,38(6):912 -917.
[11] Dewan S,Puscheck EE,Coulam CB,et al.Y-chromosome microdeletions and recurrent pregnancy loss[J].Fertil Steril,2006,85(2):441 -445.

