microRNA在结直肠癌转移中作用机制的研究进展
蔡彦韬(综述) 陈宗祐(审校)
(复旦大学附属华山医院普外科 上海 200040)
结直肠癌(colorectal carcinoma,CRC)是最常见的消化道肿瘤之一,死亡率位居恶性肿瘤第2位,超过50%的CRC患者最终死于肿瘤远处转移相关的并发症。CRC的转移是一个复杂的多步骤综合的生物学过程,包括有肿瘤细胞抗凋亡、上皮细胞间质化(epithelial-mesenchymal transition,EMT)、增殖侵袭及血管生成等,多种因子交杂成信号网络参与调控。对于转移相关调控因子的探索研究将为今后CRC的早期诊断及综合治疗提供理论依据和进一步科研方向。
microRNA(miRNA)是一组长度19到22核苷酸的非编码序列RNA,参与细胞分化、细胞周期调节、应激以及凋亡等诸多重要细胞程序过程中的基因表达调控,多达30%的人类基因受到miRNA的调控[1]。随着微阵列技术及RT-PCR的发展,关于miRNA与肿瘤发生发展的研究正成为科研热点,以乳腺癌为代表的肿瘤学研究已证明miRNA参与多种肿瘤转移过程中某些关键步骤的调节[2]。而目前类似的研究在CRC中相对较少,由于miRNA表达具有高度组织特异性,所以尽管近年在分子生物学、组织学等方面取得了一定进展,其在CRC转移过程中的作用及机制仍需要更多的研究结果加以支持。本文通过miRNA在凋亡、上皮细胞间质化、血管生成及细胞内信号转导等方面进行阐述,对近年miRNA在CRC转移各通路中的作用与机制的研究进展进行综述。
miRNA合成流程 miRNA在基因组DNA上有各自对应的区域。这些DNA在RNA聚合酶II的作用下得到转录产物,称为初级miRNA分子(primary miRNA,pri-miRNA)。pri-miRNA被核酸内切酶III-Dorsha及其辅助因子DGCR8加工为前体miRNA(precursorpre-miRNA,pre-miRNA),premiRNA具有茎环结构,长度约为40个核苷酸,通过输出蛋白5(exportin-5)的协作,从细胞核被运输至胞质。胞质内的RNA酶III(Dicer)将pre-miRNA的茎环结构切开,使之成为miRNA双链体结构,随后双链结构迅速降解为单链结构的miRNA,即成熟的miRNA。成熟的miRNA结合到RNA诱导沉默复合体(RNA-induced silencing complex,RISC)发挥其生物效应。RISC通过碱基不完全配对结合至靶mRNA的 3'非翻译区(3'untranslated region,3'UTR),抑制靶mRNA翻译过程或介导靶mRNA的降解[3]。
miRNA通过碱基不完全配对可与多种靶mRNA结合。现已发现的1 000种左右miRNA参与超过5 300种人类基因的调控,占到人类基因的 30%[4]。
miRNA受多种方式的调节,包括miRNA基因区域的过甲基化,组蛋白修饰以及SNP调节,以上调节方式在肿瘤相关miRNA的调控中发挥重要作用。
miRNA与CRC细胞凋亡 肿瘤细胞凋亡通过外源性及内源性途径完成。外源性途径依靠细胞膜上凋亡受体(FASL,TRAIL,TNFR)与配体结合,激活下游caspase8,引发“瀑布反应”导致凋亡。内源性途径以线粒体作为调控核心,在上游BCL-2家族蛋白的调解下释放线粒体蛋白,包括参与caspase9构成的细胞色素C(cytochrome C,cyt C),从而激活下游caspase的“瀑布反应”。
P53作为促使肿瘤细胞凋亡的重要蛋白,参与多种miRNA的调控。这种调控自转录及转录后阶段影响许多mRNA的翻译,与这些靶mRNA匹配的miRNA也随之受到调控[5]。相反,P53亦受一些miRNA的调节,如 miR29家族,包括 miR29a,miR29b,miR29c,通过作用于CDC42及p85a对P53起到正向调节作用,促P53水平升高起到促进对于恶变细胞的凋亡诱导[6]。
miR34家族是 TP53的直接下游靶基因[7]。Tazawa等[8]报道CRC细胞受miR34a转染后诱导细胞进入衰老凋亡状态,细胞内p53表达升高,促癌因子E2F下调,且这种调控在p53缺失的肿瘤细胞中无效,证明TP53也是miR34a发挥抑癌效应的可能作用靶位。由此可以推测p53与miR34a间存在正向调节的环路,两者相互促进发挥促癌细胞凋亡效应[9]。另有研究通过翻译寡核苷酸转染法去除miR34a功能的小鼠胚胎干细胞,证明凋亡通路中的BCL-2蛋白家族直接受miR34a的负向调节[10]。miR34基因的丢失导致肿瘤细胞的抗凋亡,在临床上显示为对促凋亡化疗药物的敏感性下降[11]。同样作用于BCL-2其促凋亡效果的的还有 miR195[12]。
巨噬细胞迁徙抑制因子(macrophage migration inhibitory factor,MIF)是一种在细胞免疫、炎症反应中的重要因子,在结直肠癌的发生发展以及缺氧诱发的凋亡过程中发挥重要作用,且已被证明具有抑制p53活性的效应[13-14]。MIF是miR451的潜在靶点,Bandrés等[15]通过活检标本的检测,观察到消化道肿瘤中过表达的miR451同时抑制MIF的mRNA及蛋白表达,具有抑制肿瘤生长的效果。
miRNA与CRC细胞的EMT EMT是体内将具有极性且活动性弱的上皮细胞转变为失极性而活动性强的间质细胞的一种细胞程序,是肿瘤细胞适应微环境改变的途径,致其脱离瘤体,进入脉管系统发生转移及播散。
肿瘤细胞生长过程中合成释放的转化生长因子β(transforming growth factor β,TGFβ)是 EMT 中最主要的促进因子,能够强烈增加促锌指结合蛋白(zincfinger-enhancer binding protein,ZEB)的表达水平,下调E钙黏蛋白而上调波形蛋白(vimentin)水平,使肿瘤细胞发生失极性,黏附力下降以及活动能力提高,促进细胞自瘤体脱落进入循环[16-17]。
EMT与miRNA有相当密切的关系,miR200家族在其中的地位尤其重要。发生EMT的CRC细胞内存在miR200水平的下降。进一步实验证实低水平miR200环境下,胞内促进胞间紧密连接的E钙黏蛋白水平降低,促进EMT发生的波形蛋白水平则升高,肿瘤细胞呈EMT趋势;相反,高水平miR200转染肿瘤细胞,则可观察到E钙黏蛋白水平升高及细胞上皮化(enchymal-epithelial tranition,MET)趋势。ZEB蛋白被认为是miR200抑制EMT效应的靶位,同时具有抑制miR200效应,两者构成互相抑制的环路,使 miR200 在 EMT 中更显重要[18-19]。
除miR200家族外,miR21也参与肿瘤细胞EMT的过程。CRC细胞中 miR21所在基因区域的拷贝增加较常见,在CRC转移株中则更普遍。组织学研究证实CRC肝转移组织内miR21水平显著高于原位CRC组织[20]。TGFβ可能是miR21的上游因子,依据来自高水平TGFβ处理CRC后可观察到 miR21表达增加[21]。miR21在CRC中促进EMT的机制可能与抑制程序性细胞死亡因子4(programmed cell death 4,PDCD4)有关,Selcuklu等[22]在 miR21 基因区敲除后的肿瘤细胞中观察到PDCD4表达升高且侵袭性下降,这种反向关系在CRC组织中也得到了证实[23]。
miRNA与CRC血管生成 血管生成是肿瘤发生转移过程中的重要步骤。缺氧是诱发新生血管生成最主要的因素,血管内皮生长因子(vascular endothelial growth factor,VEGF)是其中最关键的细胞因子。当肿瘤组织出现缺氧时,缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)即刻高表达。HIF-1刺激VEGF-A mRNA高表达,随即VEGF-A组织水平升高,同时出现VEGF受体表达升高,以此介导新生血管形成以对抗缺氧,且为瘤细胞脱落迁徙提供途径[24]。
多种miRNA可能参与上述缺氧-HIF-VEGF通路的调控。Yamakuchi等[25]发现结肠癌组织中miR22水平低于正常组织,并证实CRC细胞内高水平的 miR22可抑制HIF1a的表达,下游VEGF的表达减少;相反,敲除内源性 miR22后则观察到HIF1a和VEFG水平的升高。故可以明确miR22作用于HIF1a,抑制CRC细胞内缺氧诱导的血管生成效应。
miR619作用于VEGF基因,上调VEGF蛋白合成促进肿瘤血管生成,且miR619本身受VEGF蛋白正向调控,两者构成正向反馈调节环路。而抗VEGF处理的 CRC细胞,其 miR619水平亦发生下调[26]。
抑癌基因TP53对于肿瘤血管生成存在抑制效应,促肿瘤细胞进入凋亡程序。miR107定位于染色体10q23.31区,在11%的CRC患者中存在该区域的缺失[27]。TP53可促进下游的miR107表达增加,后者结合mRNA抑制HIF-1的翻译以抑制肿瘤血管生成[28]。缺氧处理的CRC细胞中,高miR107水平组其VEGF显著低于低miR107水平组。动物试验也证实高miR107导致VEGF低表达,低血管密度以及低肿瘤大小的特点。
miRNA与CRC细胞内信号传导 肿瘤细胞通过多条胞内信号传导通路传递以获得增殖、侵袭及迁徙能力,KRAS途径是其中最重要的一条通路。Let-7家族是最早被发现的miRNA之一,其作用位点在KRAS上,抑制KRAS的表达起到抑癌作用。Akao等[29]报道let-7miRNA在CRC组织中多呈低表达。let-7转染CRC细胞后,在翻译水平下调胞内KRAS以及促肿瘤血管生成的c-myc蛋白水平,阻止新生血管形成。
miRNA143定位于染色体5q32,CRC标本中5q24-32区常发生丢失,miR143于肿瘤组织内低表达[21,30]。miRNA143前体转染入CRC细胞导致KRAS通路下游因子ERK5蛋白水平的下降,尽管具体作用靶点尚不清楚,其抑制RAS通路发挥抑制肿瘤发展的作用是可以肯定的[20,31]。
miR17/92受c-myc蛋白正调控,对CRC细胞使用miR17/92转染以及基因区敲除实验,证明其直接下调抑癌因子,即抗血管生成蛋白1(antiangiogenic thrombospondin-1,Tsp1)和结缔组织生长因子(connective tissue growth factor,CTGF)的合成,促进CRC侵袭与转移[32]。
酪氨酸激酶受体激活通过PI3K-AKT途径激发肿瘤细胞内抗凋亡反应,也是肿瘤细胞生存、转移所依赖的重要细胞通路。Schimanski等[33]通过miR196转染CRC细胞观察到AKT磷酸化的增高,说明miR196作用下PI3K-AKT途径受到促进。此外miR196在CRC转移组织中的水平高于原位组织,都说明其促进CRC转移的作用。
总结与展望 本文总结了miRNA在CRC转移中各通路中的作用机制与靶位(表1)。
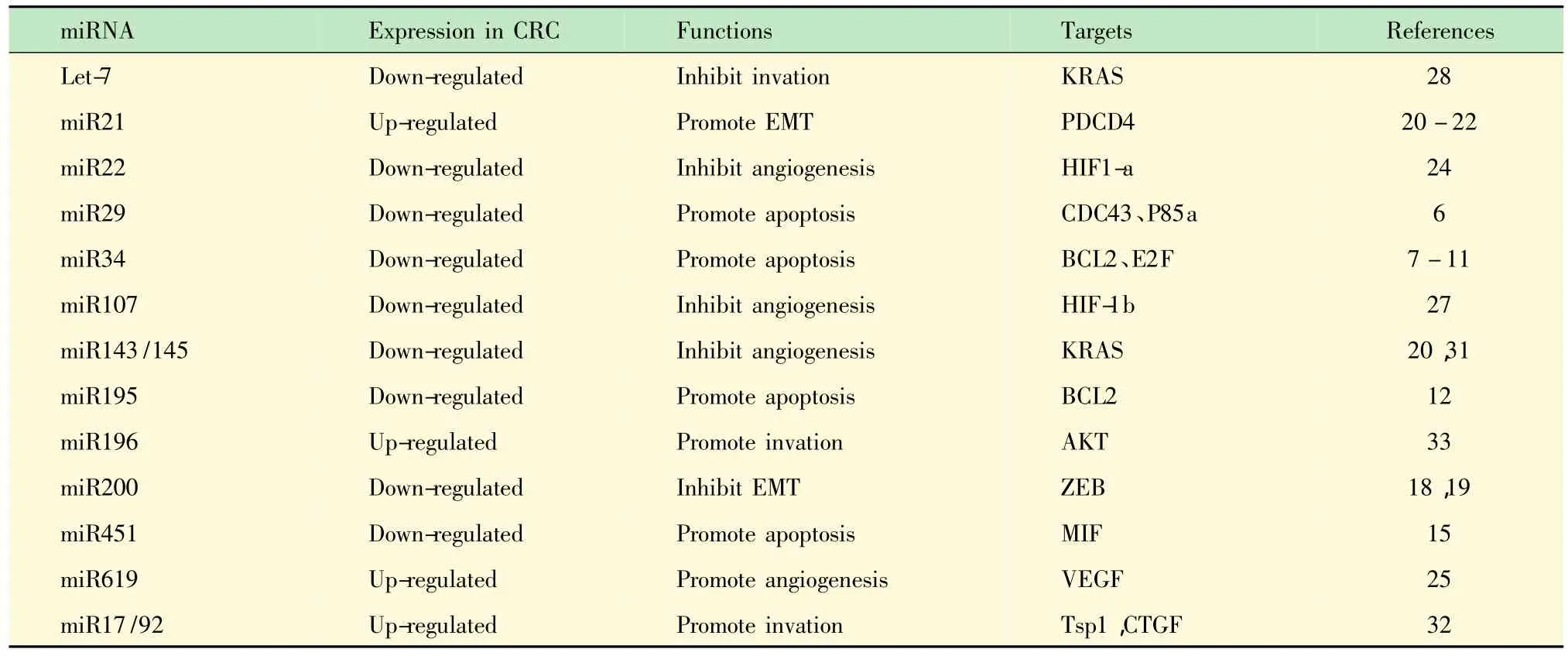
表1 CRC转移相关miRNA在CRC中的表达、作用机制及靶点Tab 1 miRNA involved in metastasis of CRC-functions and targets
有关miRNA与CRC转移的研究在逐渐揭示CRC发生远处转移的机制同时,也为将来CRC的早期诊断、预后评估及靶向治疗等领域照亮了前路。随着微阵列技术与qRT-PCR的发展与普及,miRNA可作为肿瘤标志物对肿瘤发生以及肿瘤转移进行早期诊断,针对特定miRNA的干预有望提高化疗药物对于CRC原发灶及转移灶的治疗敏感性,靶向干预miRNA也可作为新理念用以开发新型化疗药物。随着越来越多实验及临床证据的积累,miRNA在CRC转移过程中的机制逐渐被揭示,也为CRC转移的临床诊断及治疗提供了美好的发展前景。
[1] Rajewsky N.microRNA target predictions in animals[J].Nat Genet,2006,38:S8 - S13.
[2] Nicoloso MS,Spizzo R,Shimizu M,et al.MicroRNAs—the micro steering wheel of tumour metastases[J].Nature Rev Cancer,2009,9(4):293 -302.
[3] Bartel DP.MicroRNAs,genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281 - 297.
[4] Lewis BP,Burge CB,Bartel DP.Conserved seed pairing,often flanked by adenosines,indicates that thousands of human genes are microRNA targets[J].Cell,2005,120(1):15-20.
[5] Xi Y,Shalgi R,Fodstad O,et al.Differentially regulated micro-RNAsand actively translated messenger RNA transcripts by tumor suppressor p53 in colon cancer[J].Clin Cancer Res,2006,12:2014 -2024.
[6] Park SY,Lee JH,Ha M,et al.miR-29 miRNAs activate p53 by targeting p85 alpha and CDC42[J].Nat Struct Mol Biol,2009,16(1):23 -29.
[7] Raver-Shapira N,Marciano E,Meiri E,et al.Transcriptional activation of miR-34a contributes to p53-mediated apoptosis[J].Mol Cell,2007,26(5):731 -743.
[8] Tazawa H,Tsuchiya N,Izumiya M,et al.Tumor-suppressive miR-34a induces senescence-like growth arrest through modulation of the E2F pathway in human colon cancer cells[J].Proc Natl Acad Sci USA,2007,104(39):15472-15477.
[9] Yamakuchi M,Ferlito M,Lowenstein CJ.miR-34a repression of SIRT1 regulates apoptosis[J].Proc Natl Acad Sci U S A,2008,105(36):13421 -13426.
[10] Bommer GT,Gerin I,Feng,Y,et al.p53-mediated activation of miRNA34 candidate tumor-suppressor genes[J].Curr Biol,2007,17(15):1298 -1307.
[11] Fujita Y,Kojima K,Hamada N,et al.Effects of miR-34a on cell growth and chemoresistance in prostate cancer PC3 cells[J].Biochem Biophys Res Commun,2008,377(1):114-119.
[12] Lin L,Chen L,Xu Y,microRNA-195 promotes apoptosis and suppresses tumorigenicity of human colorectal cancer cells[J].Biochem Biophys Res Commun,2010,400(2):236-240.
[13] Wilson JM,Coletta PL,Cuthbert RJ,et al.Macrophage migration inhibitory factor promotes intestinal tumorigenesis[J].Gastroenterology,2005,129(5):1485 -1503.
[14] Ohkawara T,Nishihira J,Takeda H,Pathophysiological roles of macrophage migration inhibitory factor in gastrointestinal,hepatic,and pancreatic disorders[J].Gastroenterol,2005,40(2):117-122.
[15] Bandrés E,Cubedo E,Agirre X,et al,Identification by realtime PCR of 13 mature microRNAs differentially expressed in colorectal cancer and non-tumoral tissues[J].Mol Cancer,2006,5:29.
[16] Zhang H,Li Y,Lai M.The microRNA network and tumor metastasis[J].Oncogene,2010,29(7):937 - 948.
[17] Hugo H, Ackland ML, Blick T, et al.Epithelialmesenchymaland mesenchymal-epithelialtransitionsin carcinoma progression[J].Cell Physiol,2007,213(2):374-383.
[18] Gregory PA,Bert AG,Paterson EL,et al,The miR-200 family and miR-205 regulate epithelial to mesenchymal transition by targeting ZEB1 and SIP1[J].Nature Cell Biol,2008,10(5):593 -601.
[19] Burk U,Schubert J,Wellner U,et al,A reciprocal repression between ZEB1 and members of the miR-200 family promotes EMT and invasion in cancer cells[J].EMBO Rep,2008,9(6):582-289.
[20] Kulda V,Pesta M,Topolcan O,et al.Relevance of miR-21 and miR-143 expression in tissue samples of colorectal carcinoma and its liver metastases[J].Cancer Genet Cytogenet,2010,200(2):154 -160.
[21] Michael MZ,van Holst Pellekaan NG,Young GP,et al.Reduced accumulation of specific microRNAs in colorectal neoplasia[J].Mol Cancer Res,2003,1(12):882 - 891.
[22] Selcuklu SD,Donoghue MT,Spillane C.miR 21 as a key regulator of oncogenic processes[J].Biochem Soc Trans,2009,37(4):918 -925.
[23] Chang KH,Miller N,Kheirelseid EA.MicroRNA-21 and PDCD4 expression in colorectal cancer[J].Eur J Surg Oncol,2011,37(7):597 -603.
[24] Shweiki D,Itin A,Soffer D,et al.Vascular endothelial growth factor induced by hypoxia may mediate hypoxiainitiated angiogenesis[J].Nature,1992,359:843 - 845.
[25] Yamakuchi M,Yagi S,Ito T,et al.MicroRNA-22 regulates hypoxia signaling in colon cancer cells[J].PLoS One,2011,6(5):202 -209.
[26] Dumoutier L,Leemans C,Lejeune D,et al.Cutting edge:STAT activation by IL-19,IL-20 and mda-7 through IL-20 receptor complexes of two types[J].Immunol,2001,167(7):3545-3549.
[27] De Angelis PM,Clausen OP,Schjolberg A,etal .Chromosomalgains and losses in primary colorectal carcinomas detected by CGH and their associations with tumour DNA ploidy,genotypes and phenotypes[J].Br J Cancer,1999,80(3 -4):526 -535.
[28] Yamakuchi M,Lotterman CD,Bao C,et al.P53-induced microRNA-107 inhibits HIF-1 and tumor angiogenesis[J].Proc Natl Acad Sci USA,2010,107(14):6334 -6339.
[29] Akao Y,Nakagawa Y,Naoe T.let-7 microRNA functions as a potential growth suppressor in human colon cancer cells[J].Biol Pharm Bull,2006,29(5):903 -906.
[30] De Angelis PM,Clausen OP, Schjolberg A, et al.Chromosomalgains and losses in primary colorectal carcinomas deteted by CGH and their associations with tumour DNA ploidy,genotypes and phenotypes[J].Br J Cancer,1999,80(3 -4):526 -535.
[31] Akao Y,Nakagawa Y,Naoe T.MicroRNAs 143 and 145 are possible common oncomicroRNAs in human cancers[J].Oncol Rep,2006,16(4):845 -850.
[32] Zhao HY,Ooyama A,Yamamoto M,et al.Down regulation of c-Myc and induction of an angiogenesis inhibitor,thrombospondin-1,by 5-FU in human colon cancer KM12C cells[J].Cancer Lett,2008,270(1):156 - 163.
[33] Schimanski CC,Frerichs K,Rahman F,et al.High miR-196a levels promote the oncogenic phenotype of colorectal cancer cells[J].World J Gastroenterol,2009,15(17):2089-2096.

