氮杂环丙烷与丙二酸二甲酯的串联反应
汤从国,田露,苏莉,张万轩
(湖北大学化学化工学院,湖北 武汉 430062)
0 引言
氮杂环丙烷作为三元小环化合物,有着较大的张力,易接受不同种类的亲核试剂发生开环反应生成胺类化合物,因此其广泛被用于有机合成反应.氮杂环丙烷的开环反应通常经过氮负离子中间体,如果反应体系中存在亲电试剂,则可以捕捉该中间体,发生串联反应,得到结构多样性的化合物[1-5].利用这种串联反应可以合成五元杂环化合物.例如,Ungureanu等在-78 ℃的低温下,捕捉到氮杂环丙烷开环生成的1,3-偶极子,它与烯烃发生[3+2]的环化生成吡咯环[6];Wu等用Sc(OTf)3催化氮杂环丙烷和腈开环反应后再发生分子内亲核加成,生成咪唑啉衍生物[7];侯雪龙等利用端位炔与氮杂环反应得到开环产物,此产物经分离后,在I2和AgAc催化下,氮原子与碳碳三键发生分子内加成反应,合成了具有二氢吡咯结构的化合物[8];特别是Manas[9]利用Cu(OTf)2催化活泼亚甲基对氮杂环的开环反应,合成了内酰胺化合物,为合成内酰胺类化合物提供了一个新的合成方法.利用此类方法合成具有多样性的吡咯烷酮类衍生物是一个很值得研究的课题.
吡咯烷酮衍生物是重要的有机合成中间体,且广泛存在于生物碱[10]和药物分子中[11],在有机合成中有着重要的作用.我们发现环己烷骈联的氮杂环丙烷与丙二酸二甲酯反应时,采用适当的溶剂,在较高的温度下反应,氮杂环丙烷与丙二酸二甲酯开环反应后得到的中间体,可以在原位进一步发生分子内亲核加成-消除反应,生成吡咯烷酮衍生物,而不仅仅停留在开环产物阶段[4],且产率较高(45%~99%).此方法原料易得,条件简单(图1),为合成吡咯烷酮类物质提供了简洁的新方法.

图1 吡咯烷酮衍生物的合成
1 实验部分
1.1 仪器与试剂的处理
1.1.1 仪器 熔点测试仪:WRS-1B数字熔点测试仪;红外光谱仪:PE-Spectrum One型红外光谱仪,KBr压片;核磁共振仪:INOVA (600 MHz)核磁共振仪,以CDCl3为溶剂,TMS(0.05%)为内标;元素分析数据由德国Vario Micro型元素分析仪测定.
1.1.2 试剂处理 四氢呋喃:AR,钠丝回流;1,4-二氧六环:AR,钠丝回流;甲苯:AR,钠丝回流;丙二酸二甲酯:AR,减压蒸馏;丙二酸二乙酯:AR,减压蒸馏;各种氮杂环丙烷为自制.
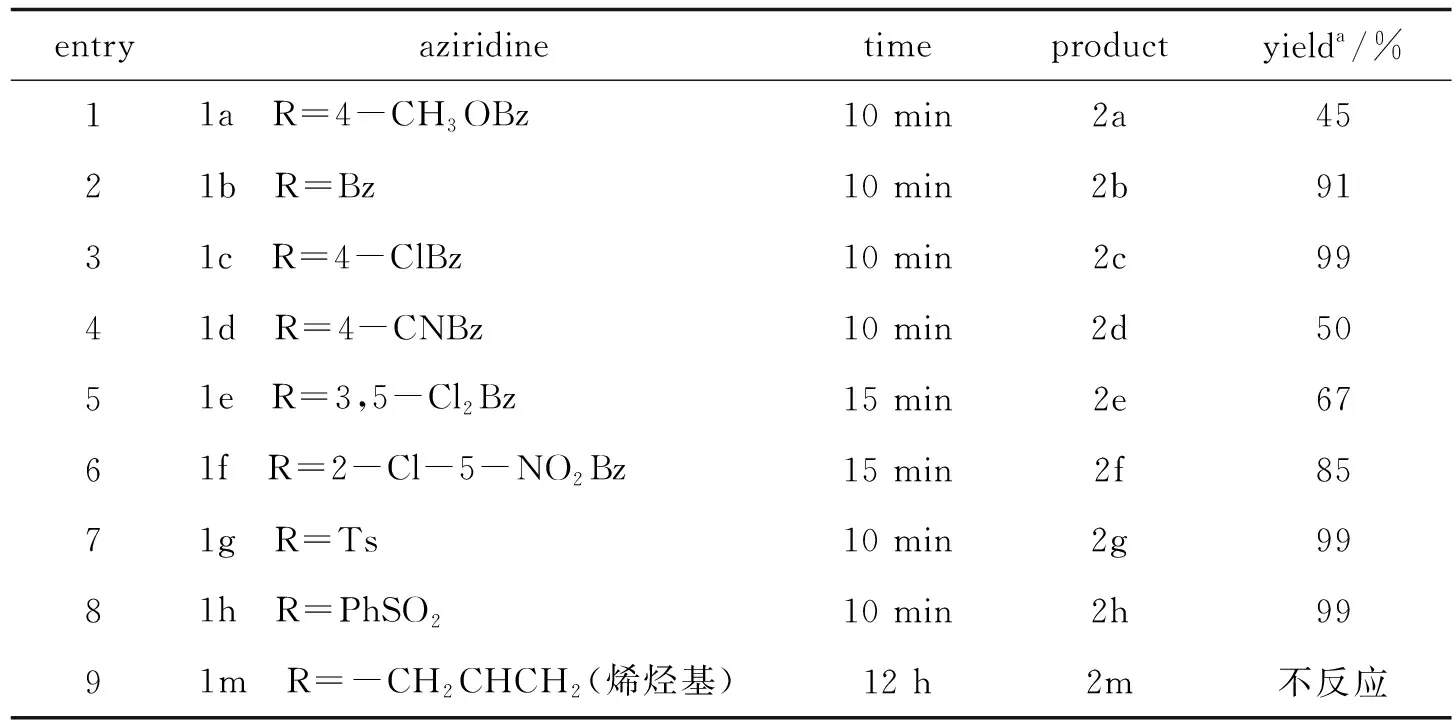
表1 吡咯烷酮衍生物的合成
a分离后的产率
1.2实验步骤氮杂环丙烷(1 mmol)、1,4-二氧六环(3 mL)、氢化钠(未处理,60%的含量3 mmol)、丙二酸二甲酯2 mmol置于微量反应管中,回流搅拌至原料点消失(TLC检测反应) ,柱层析(乙酸乙酯/石油醚) 分离得到产物(表1).
1.3 产物表征
2a 白色粉末. mp: 156.8~157.3 °C.1H NMR (600 MHz, CDCl3)δ: 1.25~1.52 (m, 4H, —CH2—), 1.86~2.36 (m, 4H, —CH2—), 2.59 (dd,J=12.0, 2.4 Hz, 1H, —CH—), 3.20 (d,J=12.6 Hz, 1H, —CH—), 3.55~3.59 (m, 1H, —CH—), 3.81 (s, 3H, —OCH3), 3.86 (s, 3H, —OCH3), 6.91 (d,J=8.4 Hz, 2H, Ar—H), 7.74 (d,J=9.6 Hz, 2H, Ar—H).13C NMR (150 MHz, CDCl3)δ: 24.1, 25.3,27.6, 29.1, 44.1, 52.6, 54.7, 55.3, 61.5, 113.2, 125.9, 132.4, 163.5, 168.8, 169.8, 170.5. IR (KBr)v: 2 946, 2 859, 1 752, 1 743, 1 673, 1 440, 1 434, 1 276, 1 166 cm-1. MS (ESI)m/z: 332.1(M+1). Anal. calcd for C18H21NO5: C 65.21, H 6.28, N 4.22; found C 65.24, H 6.39, N 4.23.
2b 白色粉末. mp: 129.0~129.8 °C.1H NMR (600 MHz, CDCl3)δ: 1.27~1.52 (m, 4H, —CH2—), 1.87~2.37 (m, 4H, —CH2—), 2.65(dd,J=12.0, 2.4 Hz, 1H, —CH—), 3.20 (d,J=13.2 Hz, 1H, —CH—), 3.55~3.59 (m, 1H, —CH—), 3.80 (s, 3H, —OCH3), 7.42(t,J=7.8 Hz, 2H, Ar—H), 7.55 (t,J=7.2 Hz, 1H, Ar—H), 7.72 (d,J=7.2 Hz, 2H, Ar—H).13C NMR (150 MHz, CDCl3)δ: 24.2, 25.3, 27.8, 29.3, 44.3, 52.6, 54.8, 61.9,127.9, 129.8 ,132.8, 133.9, 168.6, 170.5, 170.9. IR (KBr)v: 2 946, 2 859, 1 752, 1 743, 1 673, 1 440, 1 276, 1 166, 1 097 cm-1. MS (ESI)m/z: 302.1 (M+1). Anal. calcd for C17H19NO4: C 67.91, H 6.29, N 4.62; found C 67.76, H 6.36, N 4.65.
2c 白色粉末. mp: 129.9~131.6 ℃.1H NMR (600 MHz, CDCl3)δ: 1.25~1.52 (m, 4H, —CH2—) , 1.87~2.36 (m, 4H, —CH2—), 2.63 (dd,J=12.0, 2.4 Hz, 1H, —CH—), 3.20 (d,J=12.6 Hz, 1H, —CH—), 3.55~3.58 (m, 1H, —CH—), 3.80 (s, 3H, —OCH3), 7.40 (d,J=8.4 Hz, 2H, Ar—H), 7.65 (d,J=7.8 Hz, 2H, Ar—H).13C NMR (150 MHz, CDCl3)δ: 24.2, 25.3, 27.7, 29.2, 44.2, 52.7, 54.7, 61.9, 128.3, 131.2, 132.2, 139.3, 168.6, 169.8, 170.7. IR (KBr)v: 2 960, 2 921, 2 859, 1 727, 1 687, 1 592 cm-1. MS (ESI)m/z: 336.0(M+1). Anal. calcd for C17H18ClNO4: C 61.18, H 5.42, N 4.15; found C 60.81, H 5.40, N 4.17.
2d 白色粉末. mp: 131.0~132.1 ℃.1H NMR (600 MHz, CDCl3)δ: 1.26~1.53 (m, 4H, —CH2—), 1.88~2.37 (m, 4H, —CH2—), 2.69 (dd,J=12, 2.4 Hz, 1H, —CH—), 3.21 (d,J=13.2 Hz, 1H, —CH—), 3.55~3.59 (m, 1H, —CH—), 3.81 (s, 3H, —OCH3), 7.72 (d,J=7.8 Hz, 2H, Ar—H), 7.76 (d,J=8.4 Hz, 2H, Ar—H).13C NMR (150 MHz, CDCl3)δ: 24.2, 25.2, 27.7, 29.2, 44.3, 52.7, 54.5, 61.8, 115.8, 117.8, 129.9, 131.7, 137.9, 168.3, 169.3, 170.8. IR (KBr)v: 2 960, 2 936, 2 866, 2 228, 1 760, 1 738, 1 679, 1 437, 1 279, 1 152 cm-1. MS (ESI)m/z: 327.1(M+1). Anal. calcd for C18H18N2O4: C 66.85, H 5.61, N 8.59; found C 66.25, H 5.56, N 8.58.
2e 白色粉末. mp: 138.1~139.8 ℃1H NMR (600 MHz, CDCl3)δ: 1.25~1.54(m, 4H, —CH2—) , 1.88~2.36 (m, 4H, —CH2—), 2.64 (dd,J=9.6, 1.8 Hz, 1H, —CH—), 3.20 (d,J=12.6 Hz, 1H, —CH—), 3.53~3.56 (m, 1H, —CH—), 3.82 (s, 3H, —OCH3), 7.51(s, 1H, Ar—H), 7.52(s, 2H, Ar—H).13C NMR (150 MHz, CDCl3)δ: 24.2, 25.3, 27.7, 29.1, 44.1, 52.8, 54.5, 61.7, 127.8, 132.3, 134.8, 136.7, 168.2, 168.4, 170.9. IR (KBr)v: 3 080, 2 936, 2 857, 1 759, 1 782, 1 668, 1 567, 1 438, 1 281, 1 169 cm-1. MS (ESI)m/z: 370.0 (M+1). Anal. calcd for C17H17Cl2NO4: C 55.06, H 4.65, N 3.72; found C 55.15, H 4.63, N 3.78.
2f 白色粉末. mp: 193.0~193.2 ℃.1H NMR (600 MHz, CDCl3)δ: 1.25~1.54 (m, 4H, —CH2—), 1.88~2.38 (m, 4H, —CH2—), 2.97 (dd,J=9.6, 1.8 Hz, 1H, —CH—), 3.24 (d,J=13.2 Hz, 1H, —CH—)), 3.59~3.62 (m, 1H, —CH—), 3.77 (s, 3H, —OCH3), 7.56 (d,J=8.4 Hz, 1H, Ar—H), 8.20~8.24 (m, 2H, Ar—H).13C NMR (150 MHz, CDCl3)δ: 24.4, 25.2, 27.7, 29.5, 44.4, 52.8, 54.2, 62.3, 123.8, 125.6. 130.7, 136.8, 137.6, 146.3, 165.6, 167.7, 170.6. IR (KBr)v: 3 103, 2 994, 2 944, 2 859, 1 758, 1 732, 1 697, 1 525, 1 439, 1 325, 1 169 cm-1. MS (ESI)m/z: 381.0 (M+1). Anal. calcd for C17H17ClN2O6: C 53.69, H 4.53, N 7.32; found C 53.62, H 4.50, N 7.36.
2g 白色粉末,mp: 124.1~125.6 ℃.1H NMR (600 MHz, CDCl3)δ: 1.24~1.57 (m, 4H, —CH2—), 1.79~2.23 (m, 4H, —CH2—), 2.44 (s, 3H, —CH3), 2.89 (dd,J=12.6, 3 Hz, 1H, —CH—), 3.07 (d,J=13.2 Hz, 1H, —CH—), 3.47~3.52 (m, 1H, —CH—), 3.76 (s, 1H, —OCH3), 7.33(d,J=7.8 Hz, 2H, Ar—H), 7.88 (d,J=8.4 Hz, 2H, Ar—H).13C NMR (150 MHz, CDCl3)δ: 21.6, 24.3, 25.0, 27.6, 31.1, 45.2, 52.7, 54.2, 64.3,127.9, 129.6, 135.5, 145.1, 167.7, 169.5. IR (KBr)v: 2 988, 2 942, 2 863, 1 752, 1 736, 1 597, 1 441, 1 364, 1 262, 1 168 cm-1. MS (ESI)m/z: 352.1 (M+1). Anal. calcd for C17H21NO5S: C 58.55, H 6.05, N 3.97; found C 58.10, H 6.02, N 3.99.
2h 无色油状液体.1H NMR (600 MHz, CDCl3)δ: 1.25~1.57 (m, 4H, —CH2—),δ: 1.80~2.24 (m, 4H, —CH2—), 2.89 (dd,J=12.0, 1.8 Hz, 1H, —CH—), 3.10 (d,J=13.2 Hz, 1H, —CH—), 3.49~3.54 (m, 1H, —CH—), 3.76 (s, 1H, —OCH3), 7.55 (t,J=7.2 Hz, 2H, Ar—H) , 7.66 (t,J=7.8 Hz, 1H, Ar—H), 8.01 (d,J=7.8 Hz, 2H, Ar—H).13C NMR (150 MHz, CDCl3)δ: 24.3, 25.1, 27.7, 31.2, 45.2, 52.7, 54.3, 64.6, 127.8, 129.0, 133.9, 138.7, 167.7, 169.5. IR (KBr)v: 2 939, 2 863, 1 754, 1 449, 1 367, 1 170, 1 088 cm-1. MS (ESI)m/z: 338.1 (M+1). Anal. calcd for C16H19NO5S: C 56.92, H 5.62, N 4.15; found C 56.96, H 5.68, N 4.15.
2 结果与讨论
以氮杂环1b(图1, R=Bz)与丙二酸二甲酯的反应为例对反应条件进行了讨论,实验结果列于表2.1b在室温下与丙二酸二甲酯反应,以99%的产率得到开环产物2b(表2,反应1),没有检测到关环产物,这与Frans Compernolle小组[4]的实验结果一致.当升高反应温度(在THF中回流)时,则以57%的产率得到关环产物3b,开环产物只有40%(表2,反应2).在甲苯中回流(反应温度110 ℃),产物2b的收率与在THF中回流反应时相近(表2,反应3);但在1,4-二氧六环中回流时,以91% 的产率得到关环产物3b(表2,反应4).这些结果表明在醚类溶剂中、在较高的温度下反应,对生成环状的吡咯烷酮类物质最为有利.若用丙二酸二乙酯代替丙二酸二甲酯在1,4-二氧六环中回流反应,则目标产物2b的产率明显降低(表2,反应5),这可能是因为乙酯的反应活性比甲酯的低.

表2 反应条件的优化
a反应1~4的原料是1b (1 mmol),丙二酸二甲酯(2 mmol), 氢化钠(3 mmol); 在反应5中,用等量的丙二酸二乙酯代替丙二酸二甲酯.b分离产率:括号内分别是2b/3b的分离产率.

图2 1n、1i的化学结构式
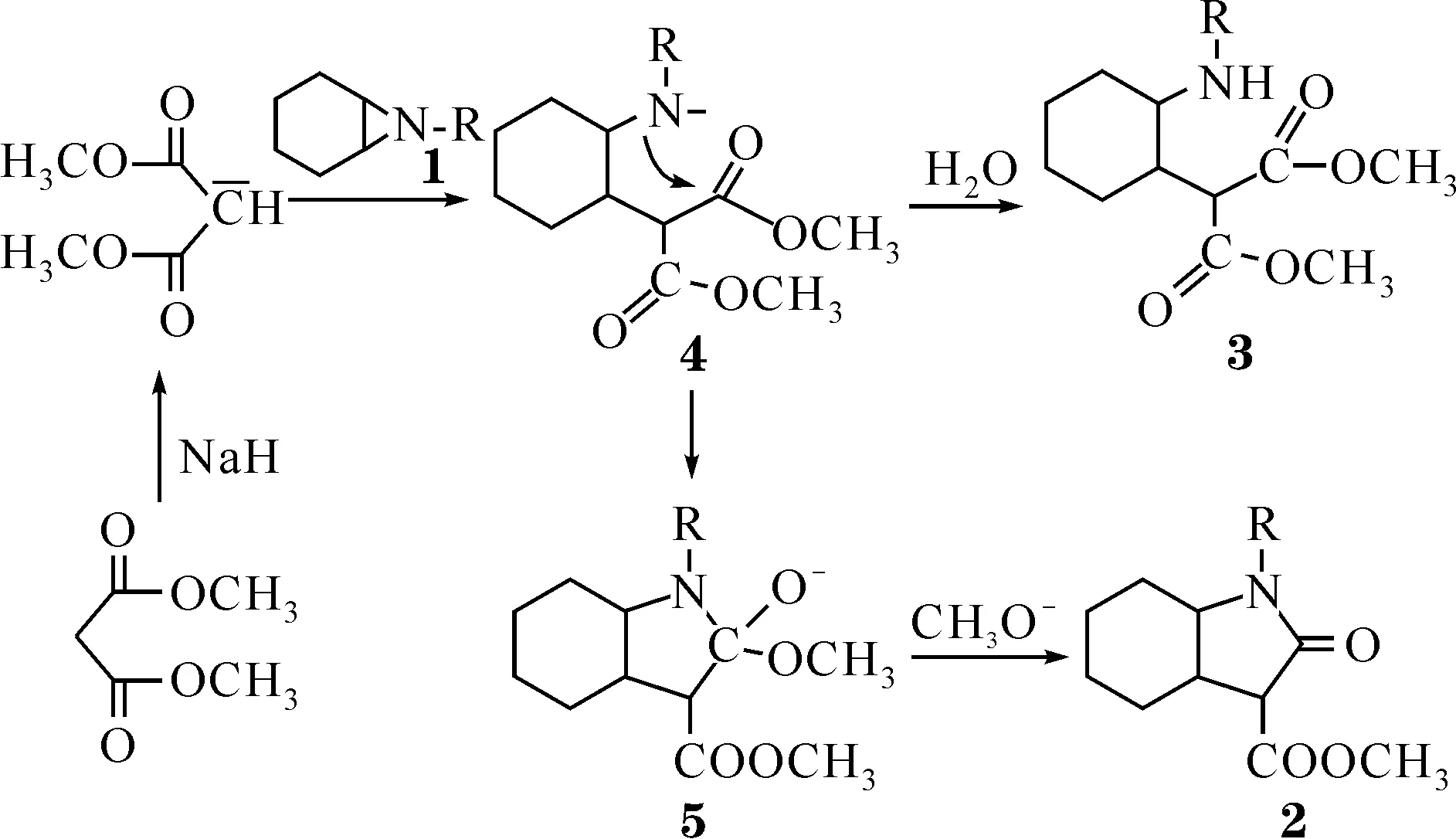
图3 反应机理示意图
为了进一步研究该反应的适用性,我们选用不同的氮杂环与丙二酸二乙酯/NaH在1,4-二氧六环中回流反应.从表1可以看出,对于与环己烷骈联的氮杂环,当其氮原子上联有较强吸电子基时(1a~1h),该反应能够顺利进行,产物2的产率可以达到45%~99%(表1,反应1~8);氮原子上取代基R的吸电子能力越强,则反应产率越高(表1,反应1~3);而联有烯丙基的1m第一步开环反应就不能发生(表1,反应9).这是由于烯丙基吸电子能力弱,导致1m反应活性低.苯环上联有两个吸电子基的苯甲酰基氮杂环1f和1e只给出中等产率,可能是受位阻的影响.对氰基苯甲酰基虽然具有强吸电子能力,但相应的氮杂环1d反应时,生成了一个结构未知的副产物,使得吡咯烷酮衍生物2d的产率异常偏低.
除以上与环己烷骈联的氮杂环外,我们还研究了与环戊烷骈联的氮杂环1n和结构不对称的氮杂环1i(图2)的反应性,发现1n的开环反应不能发生;1i虽然可以顺利反应,但产物有多种立体异体,难以分离提纯,用于合成价值不大.
根据以上结果,推测该反应按如下机理进行(图3).首先是丙二酸二甲酯在氢化钠的作用生成丙二酸二甲酯碳负离子,该离子进攻氮杂环1,生成含有氮负离子的中间体4.在较高的温度下,中间体4能够进攻分子内的一个羰基形成中间体5,再失去甲氧基负离子形成关环的吡咯烷酮衍生物2.如果在较低的温度下反应,中间体4与分子内的羰基不能反应,但能够在反应后处理阶段,从水中得到一个质子,生成开环产物3.
3 结论
环己烷骈联的氮杂环丙烷与丙二酸二甲酯/氢化钠在室温下反应,只生成开环产物环己胺衍生物;若在二氧六环中回流,则进一步发生串联反应,以高产率得到吡咯烷酮衍生物(产率45%~99%).该法为合成吡咯烷酮衍生物提供了一个简便的新方法.
[1] 陈冬冬, 丁昌华, 侯雪龙. 肟醚碳负离子对氮杂环丙烷的开环反应[J]. 高等学校化学学报, 2011, 32:694-699.
[2] Hu X E. Nucleophilic ring opening of aziridines[J]. Tetrahedron, 2004, 60: 2701-2743.
[3] 马琳鸽, 许家喜. 非对称氮杂环丙烷的亲核开环反应及其区域选择性[J]. 化学进展, 2004, 16:200-235.
[4] Mao H, Joly G J, Peeters K, et al. Synthesis of 1-deoxymannojirimycin analogues using N-tosyl and N-nosyl activated aziridines derived from 1-amino-1-deoxyglucitol[J]. Tetrahedron, 2001, 57: 6955-6967.
[5] Hayashi Y, Kumamoto T, Kawahata M. Ring-opening reaction of unactivated 3-arylaziridine-2-carboxylates with nitrile reagents[J]. Tetrahedron, 2010, 66:3836-3841.
[6] Ungureanu I, Klotz P, Mann A. Phenylaziridine as a masked 1,3- dipole in reactions with nonactivated alkenes[J]. Angew Chem Int Ed, 2000, 39:4615-4617.
[7] Wu J, Sun X Y, Xia H G. Sc(OTf)3-Catalyzed [3+2]-cycloaddition of aziridines with nitriles under solvent-free conditions[J]. Tetrahedron Lett, 2006, 47:1509-1512.
[8] Ding C H, Dai L X, Hou X L. A convenient and efficient ring-opening reaction of aziridines with acetylenes and synthesis of dihydropyrroles[J]. Tetrahedron, 2005, 61:9586-9593.
[9] Ghorai M K, Tiwari D P. Lewis acid catalyzed highly stereoselective domino-ring-opening cyclization of activated aziridines with enolates: synthesis of functionalized chiral γ-lactams[J]. J Org Chem, 2010, 75:6173-6181.
[10] Weintraub P M, Sabol J S, Kane J M. Recent advances in the synthesis of piperidones and piperidines[J]. Tetrahedron, 2003, 59: 2953-2989.
[11] LaRoche S M, Helmers S L. Safety of newer antiepileptic drugs[J]. JAMA, 2004, 291:2074.

