T140体外阻断SDF-1/CXCR4信号通路对人关节软骨细胞分泌MMP-3、MMP-9和MMP-13水平的影响
马珂 李晓林 李彦林 朱晓松 王国梁 赵沣凯
1 昆明医科大学第一附属医院骨科(昆明650031)
2 楚雄州人民医院骨三科
3 昆明医科大学第一附属医院运动医学科
骨性关节炎(osteoarthritis,OA)是以关节软骨退行性变和关节周围骨质增生为病理性特征的慢性进行性骨关节病[1,2]。 OA与软骨细胞凋亡(apoptosis)密切相关。研究表明,基质细胞衍生因子1(stromal cell derived factor 1,SDF-1)在OA患者软骨退变的病理进程中起关键作用[3,4],SDF-1若与软骨细胞表面的趋化因子受体4(chemokine receptor 4,CXCR4)结合,就能激活细胞外信号调节酶 (Extracellular signalregulated kinase,ERK)及相关激酶的信号通路[4],诱导软骨细胞释放金属基质蛋白酶(Matrix metalloproteinases,MMP)-3、MMP-9和MMP-13,这些因子均诱导破坏关节软骨。因此,SDF-1/CXCR4信号通路可能成为阻止关节软骨退变的靶点。本研究通过体外培养(培养液含SDF-1)正常成人及OA膝关节软骨块,采用CXCR4反向拮抗剂T140阻断SDF-1/CXCR4信号通路,了解T140对软骨细胞分泌MMP-3、MMP-9、MMP-13及其mRNA表达的影响。
1 材料与方法
本实验在昆明医科大学第一附属医院完成。
1.1 主要试剂、仪器
SDF-1、T140(Sigma公司,美国);抗人SDF-1抗体(anti-human SDF-1 antibody,MAB310,R&D公司,美 国 ),hMMP-3、MMP-9、MMP-13 ELISA 试 剂 盒(R&D公司,美国)。低温超高速离心机(Heraeus公司,美国);酶标板自动读数仪(Bio-Rad公司,美国)。
1.2 培养液的制备
先以高糖DMEM培养液450 ml,胎牛血清50 ml,青霉素10万单位,链霉素10万单位配置DMEM液[5],调整pH值至7.3~7.4,0.22 μm微孔过滤器过滤除菌并分装,4℃冰箱中保存。使用前温箱内复温后取100 ml,加入10 μg SDF-1,使浓度为100 ng/ml。 配制3种培养液:培养液A含有浓度为1000 nmol/L的T140,培养液B含有浓度为1000 nmol/L的MAB310,培养液C仅含有浓度为1000 nmol/L的SDF-1。各培养液的药物浓度根据前期预实验确定。
1.3 软骨组织获取及分组
取12例因骨性关节炎(符合Altman等[6]的OA诊断标准)行膝关节置换患者的软骨组织块(Mankin评分为0或1);排除肝肾疾病、结缔组织病、内分泌疾病、严重的心血管疾病及肿瘤患者。另取12例因创伤性截肢患者正常膝关节的软骨组织块 (Mankin评分为0或1)。患者均知情同意,实验符合《医疗机构管理条例》相关要求。无菌条件下将软骨组织块修剪为3 mm×3 mm×1 mm大小,每例取12块,放入-80℃深低温冰箱保存。
将低温保存的OA软骨和正常软骨块置入12孔培养板中,每孔3块。OA软骨块为OA软骨组,正常软骨块为正常软骨组,每组再根据加入培养液不同分为A、B、C三个亚组。 OA软骨组A1、B1和C1组分别加入培养液A、B和C,正常软骨组A2、B2和C2组分别加入培养液A、B和C。 然后置入37℃、5%CO2培养箱培养,培养液以覆盖软骨表面为准约2 ml。于培养2、4天收集软骨组织进行相关检测。
1.4 检测指标
1.4.1 ELISA检测
收集实验中所有培养过软骨的培养液,采用双抗体夹心ELISA法测定培养液MMP-3、MMP-9、MMP-13含量,样本量为12。
1.4.2 RT-PCR 检 测 MMP-3、MMP-9、MMP-13 mRNA表达
从培养的每组软骨中取1块软骨组织提取总RNA、纯化并反转录。参照GeneBank数据库设计并合成各基因引物,引物序列及扩增的DNA片段长度(内参基因是β-actin,上游引物5’-ATGCCATCCTGCGTCTG-3’,下游引物5’-ACTCCTGCTTGCTGATCCACAT-3’);MMP-3,上游引物5’-ATTCCATGGAGCCAGGCTTTC-3’,下游引物5’-CATTTGGGTCAAACTCCAACTGTG-3’,DNA片段138 bp;MMP-9上游引物5’-ACGCACGACGTCTTCCAGTA-3’, 下游引物5’-CCACCTGGTTCAACTCACTCC-3’,DNA片段94 bp;MMP-13上游引物5’-TTGATGATGATGAAACCTGGACAAG-3’,下游引物5’-TTGCCGGTGTAGGTGTAGATAGGAA-3’,DNA片段145 bp。RT-PCR检测过程:加 入 250 ng/μl cDNA 模 板 2 μl、SYBPremix Ex TaqTMII 10 μl,上下游引物各0.5 μl,双蒸馏水7 μl,每个反应体系20 μl,PCR条件:95℃、30秒,95℃、5秒,60℃、30~34秒,共40个循坏。72℃时采集荧光信号。溶解曲线,程序如下:95℃、0秒,65℃、15秒,95℃、0秒。步进0.5℃/s。图像及数据分析:扩增产物经1%琼脂糖凝胶电泳鉴定。将荧光定量RT-PCR所得值用2-△△CT法相对定量,分析MMP-3、MMP-9、MMP-13 mRNA表达;样本量为12。
1.5 统计学分析
采用SPSS17.0统计软件包分析。数据以均数±标准差表示,组间比较采用方差分析,两两比较采用LSD检验;检验水准α=0.05。
2 结果
2.1 ELISA检测结果
同一软骨组相同时间点,A组MMP-3、MMP-9、MMP-13含量均显著低于B组和C组,差异有统计学意义 (P<0.05)。相同时间点,OA软骨组同一亚组MMP-3、MMP-9、MMP-13含量均显著高于正常软骨组,差异有统计学意义(P<0.05)。见表1。
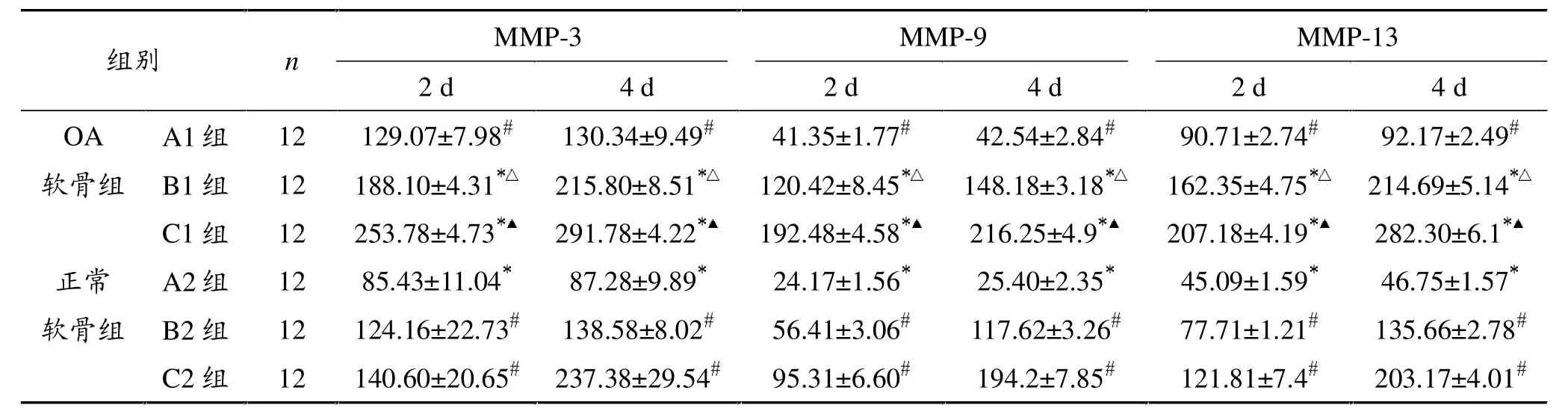
表1 各组MMP-3、9、13含量比较(ng/ml)
2.2 RT-PCR检测结果
利用MMP-3、MMP-9、MMP-13和内参基因引物所扩增的基因片段经比照扩增曲线和溶解曲线,显示了扩增的一致性和单一性。相同软骨组相同时间点,A组MMP-3、MMP-9、MMP-13 mRNA含量均显著低于B组和C组,差异有统计学意义(P<0.05),相同时间点,OA软骨组同一亚组MMP-3、MMP-9、MMP-13 mRNA含量均显著高于正常软骨组,差异有统计学意义(P<0.05)。 见表2。
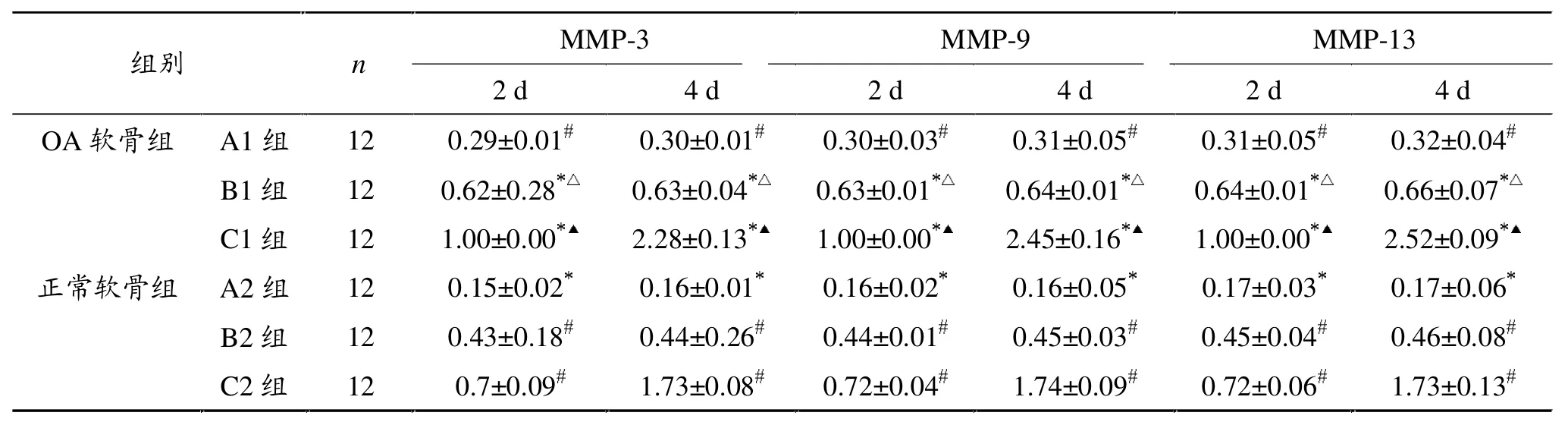
表2 各组MMP-3、MMP-9、MMP-13 mRNA含量比较
3 讨论
3.1 关节软骨退变中MMP-3、MMP-9、MMP-13所起的作用及SDF-1/CXCR4信号通路在关节软骨退变中的作用机制
基质细胞衍生因子 (Stromal Cell Derived Factor-1,SDF-1)又称趋化因子,是小分子的细胞因子,属于趋化因子蛋白家族。SDF-1的受体是趋化因子受体4(CXCR4)。免疫组化研究表明,OA患者关节软骨表层及深层皆存在CXCR4[7]。SDF-1若与软骨组织表面CXCR4受体结合,就能激活细胞外信号调节酶(Erk)及相关激酶(p38 MAP kinase)的信号通路,从而诱导软骨组织释放间质金属蛋白酶MMP-3、MMP-9及MMP-13,增加II型胶原和聚集蛋白聚糖的剪切和降解,破坏关节软骨[8-10]。
本实验中,各软骨组同一时间点B、C组MMP-3、MMP-9、MMP-13含量和mRNA表达均高于A组,说明SDF-1/CXCR4信号通路激活后,软骨细胞分泌MMP-3、MMP-9、MMP-13增加,SDF-1/CXCR4信号通路在关节软骨退变中起重要作用。
3.2 T140对MMP-3、MMP-9和MMP-13水平的影响
之前我们对于SDF-1/CXCR4信号通路部分拮抗剂AMD3100的研究证实[11],阻断SDF-1/CXCR4信号通路有助于降低人关节软骨细胞分泌MMP-3、MMP-9和MMP-13。这促使我们探索更有效的SDF-1/CXCR4信号通路拮抗剂。T140是CXCR4受体的反向拮抗剂,是目前发现的最强的CXCR4受体拮抗剂,其阻止SDF-1与CXCR4结合,阻断SDF-1/CXCR4信号通路,进而抑制该信号通路介导的相关致病因子如MMP-3、MMP-9及MMP-13释放,从而治疗该信号通路介导的相关疾病,如艾滋病,白血病,肿瘤等[12-15]。
本实验发现,相同软骨组同一时间点A组MMP-3、MMP-9、MMP-13含量和mRNA表达均低于B、C组,说明T140通过阻断SDF-1/CXCR4信号通路能控制3因子在软骨细胞内的过度表达;而MAB310虽也能降低MMP-3、MMP-9、MMP-13含量和mRNA表达,但仍高于A组。这可能因为MAB310是SDF-1的非特异性抗体[16],只能对抗未与CXCR4受体结合的游离SDF-1,故对SDF-1/CXCR4信号通路的阻断效果较差。相同时间点,OA软骨组同一亚组MMP-3、MMP-9、MMP-13含量及mRNA表达均高于正常软骨组,说明T140在体外能有效阻断SDF-1/CXCR4信号通路,抑制MMP-3、MMP-9、MMP-13 mRNA表达, 减少MMP-3、MMP-9、MMP-13释放,但不能使OA软骨分泌MMP-3、MMP-9、MMP-13恢复至正常水平。
综上所述,CXCR4反向拮抗剂T140可阻断SDF-1/CXCR4信号通路,降低软骨细胞MMP-3、MMP-9、MMP-13分泌量,进一步说明SDF-1/CXCR4信号通路可成为阻止关节软骨退变的靶点,这将为OA的靶向治疗提供依据。
[1]Elsaid KA,Machan JT,Waller K,et al.The impact of anterior cruciate ligament injury on lubricin metabolism and the effect of inhibiting tumor necrosis factor alpha on chondroprotection in an animal model.Arthritis Rheum,2009,60:2997-3006.
[2]Hendren L,Beeson P.A review of the differences between normal and osteoarthritis articular cartilage in human knee and ankle joints.Foot(Edinb),2009,19(3):171-176.
[3]Wei L,Sun X,Kanbe K,et al.Chondrocyte death induced by pathological concentration of chemokine Stromal cellderived factor-1.J Rheumatol,2006,33(9):1818-1826.
[4]Lisgnoli G,Toneguzzi S,Piacentini A,et al.CXCL12(SDF-1)and CXCL13 (BCA-1)chemokines significantly induce proliferation and collagen type I expression in osteoblasts from osteoarthritis patients.J Cell Physiol,2006,206 (1):78-85.
[5]Ross JM,Sherwin AF,Poole CA.In vitro culture of enzymatieally isolated ehondron:a possible model for the initiation of osteoarthritis.J Anat,2006,209:793-806.
[6]Altman RD.The classification of osteoarthritis.J Rheumatol Suppl,1995,(43):42-43.
[7]Kanbe K,Takagishi K,Chen Q.Stimulation of matrix metalloprotease 3 release from human chondrocytes by the interaction of stromal cell-derived factor 1 and CXC chemokine receptor4.Arthritis Rheum,2002,46(1):130-137.
[8]D’APuzzo M,Rolink A,Loetscher M,et al.The chemokine SDF-l,stromal cell-derivcd factor-1,attracts early stage B cell precursors via the chemokine receptor CXCR4.Eur J Immunol,1997,27(7):1788-1793.
[9]Santiago B,Baleux F,Palao G,et al.CXCL12 is displayed by rheumatoid endothelial cells through its basic aminoterminal motif on heparan sulfate proteoglycans.Arthritis Res Ther,2006,8(2):R43.
[10]Chiu YC,Yang RS,Hsieh KH,et al.Stromal cell-derived factor-1 induces matrix metalloprotease-13 expression in human chondrocytes.Mol Pharmacol,2007,72 (3):695-703.
[11]李彦林,王国梁,曹斌,等.AMD3100体外阻断基质细胞衍生因子1/趋化因子受体4信号通路对人关节软骨细胞分泌基质金属蛋白酶3、9、13水平的影响.中国修复重建外科杂志,2012,26(6):652-656.
[12]Lapidot A,Peled A,Berchanski A,et al.NeoR6 inhibitsHIV-1-CXCR4 interaction without affecting CXCL12 chemotaxis activity.Biochim Biophys Acta,2008,1780(6):914-920.
[13]Maeda Y,Yusa K,Harada S,et al.Altered sensitivity of an R5X4 HIV-1 strain 89.6 to coreceptor inhibitors by a single amino acid substitution in the V3 region of gp120.Antiviral Res,2008,77(2):R9.
[14]Jacobson O,Weiss ID,Kiesewetter DO,et al.PET of tumor CXCR4 expression with 4-18F-T140.J Nucl Med,2010,51(11):1796-1804.
[15]Tamamura H,Tsutsumi H,Masuno H,et al.Development of low molecular weight CXCR4 antagonists by exploratory structural tuning of cyclic tetra-and pentapeptidescaffolds towards the treatment of HIV infection,cancer metastasis and rheumatoid arthritis.Curr Med Chem,2007,14(1):93-102.
[16]Tamamura H,Tsutsumi H,Masuno H,et al.Development of low molecular weight CXCR4 antagonists by exploratory structural tuning of cyclic tetra and pentapeptide-scaffolds towards the treatment of HIV infection,cancer metastasis and rheumatoid arthritis.Curr Med Chem,2007,14 (1):93-102.

