5周亚低温状态游泳运动改善NAFLD大鼠的实验研究
秦 智,罗和生,肖国强
(1.武汉体育学院 健康科学学院,武汉 430079;2.武汉大学 人民医院消化内科,武汉 430060;3.华南师范大学 体育科学学院,广州 510006)
全球非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)的平均发病率大约在20%左右[1]。临床医学上,针对NAFLD 仍缺乏特效的治疗药物[2]。近年来,研究表明:低温具有抗炎、镇痛及提高机体免疫力等综合生物学效应。低温亦如双刃剑,长时间低温会给机体造成伤害。由此,亚低温研究随之诞生与兴起。亚低温状态特指:动物直肠温度维持在33℃左右,而常温动物直肠温度维持在37℃左右,两者间直肠温度平均相差3-4℃[3-4]。研究表明,寒冷可以诱导机体生成热休克蛋白(heat shock proteins,HSPs),亦称应激蛋白(stress proteins,SP)[5]。本研究采用在SD 大鼠NAFLD 模型建造过程中,对其实施亚低温状态5周游泳运动联合干预,通过比对研究各组别鼠肝组织病理切片、血清脂肪代谢指标、鼠肝组织氧化应激指标和HSP70mRNA 表达量及其HSP70生成量的变化,旨在探讨研究延缓NAFLD 的机制,为最终实现人类探寻预防与改善NAFLD 有效措施研究提供新思路。
1 材料与方法
1.1 NAFLD 动物模型的建造
借鉴美国Charles等[6]研究和预实验结果,本实验采用高脂液体饲料喂养SD 大鼠(供给能量分别为脂肪71%,碳水化合物11%,蛋白18%),5 周后取材制备肝组织切片HE染色,送检执业病理医师诊断,完成NAFLD 动物造模[7]。
1.2 实验动物与分组
实验动物:3月龄SPF级雄性Sprague-Dawley(SD)大鼠,体重200±20g,由广州中医药大学实验动物中心提供,许可证号:SCXK(粤)2008-0002粤监证字2008D007。饲养条件:分笼饲养(4-5 只/笼),室温20±2℃,湿度在55%左右。随机分为6组:对照组(control group,C,n=10)、高脂组(fat group,F,n=10)、常温游泳高脂组(temperature swimming fat,TS,n=10)、常温浸泡高脂组(temperature immersion fat,TI,n=10)、亚低温游泳高脂组(hypothermia swim fat,HS,n=10)、亚低温浸泡高脂组(hypothermia immersion fat,HI,n=10)。
1.3 实验方案
在4只内壁光滑的大水桶内进行无负重游泳,每桶5只大鼠。水桶高为70cm,直径60cm,水深55cm,每只大鼠的游泳面积均大于500cm2。通过兑加热水将常温水温度控制在33±1℃,亚低温状态水温度则通过添加预制冰块控制在28±1 ℃——维持动物直肠温度在33 ℃左右。
TS和HS组大鼠每天进行无负重游泳训练15min,在1周内逐渐增加至每天60 min无负重游泳运动,每周6 天,维持此运动量,共5 周。训练过程中,TS 和HS 组各有1只大鼠溺水死亡,故实验结束时,TS和HS组的样本量均为9只。
1.4 取材
5周末24h后,宰杀大鼠取材,取材前动物禁食12h。所有取材器械均经高压灭菌并高温(200℃)烘烤6h处理。腹腔注射10%水合氯醛(0.4 ml/100g weight),麻醉成功后,沿腹正中线打开腹腔,充分暴露腹主动脉采血8-10 ml,置于不抗凝采血管中室温静置30 min,4 ℃离心(3 500rpm)15min,取血清,-80 ℃保存,待测血清生化指标。切取肝中叶同一部位1cm×1cm×1cm 组织置于10%甲醛溶液中固定保存24-48h,用于制备组织病理学切片。另将肝中叶切块分装于冻存管,放置于-196℃液氮罐中备用,待测HSP70和HSP70mRNA。
1.5 肝组织病理切片制作
HE染色,光镜下观测肝组织学变化。
将组织块选取同一部位进行切块并修块、脱水、冲水透明后,浸蜡、包埋、切片、捞片、摊片,在60 ℃干燥箱中过夜后,进行HE染色。
1.6 血清脂肪代谢指标测定
甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)均采用比色法,在全自动生化仪上按照试剂盒说明测试;血清FFA 采用比色法,在722分光光度计上按照试剂盒说明测试。
1.7 鼠肝氧化应激指标测定
丙二醛(MDA)采用硫代巴比妥酸法测试,其测试原理:过氧化脂质降解产物中的丙二醛可与硫代巴比妥酸(TBA)缩合,形成红色产物,在532nm 处有最大吸收峰,用分光光度计测定吸光度值,通过公式可计算出组织中MDA 的含量。
超氧化物歧化酶(SOD)采用黄嘌呤氧化酶法测试,其测试原理:通过黄嚓吟及黄嗓吟氧化酶反应体系产生超氧阴离子自由基,后者氧化轻胺形成亚硝酸盐,在显色剂作用下呈紫红色,用可见光分光光度计测其吸光度。当被测样本中含SOD 时,则对超氧阴离子自由基有专一性的抑制作用,使形成的亚硝酸盐减少,比色时测定管的吸光度值低于对照管的吸光度值,通过公式可求出被测样本中的SOD 活力。
谷胱甘肽过氧化物酶(GSH)采用比色法测试,其测试原理:GSH 和二硫代二硝基苯甲酸与巯基化合物反应时能作用生成5一硫代二硝基苯甲酸阴离子,呈现较稳定的黄色,在420nm 处测定其吸光度即可计算出GSH 的量。
1.8 肝组织HSP70含量测定
采用固相夹心法酶联免疫吸附实验(ELISA)测试,试剂盒购自南京凯基生物科技发展有限公司。具体步骤严格按照说明书操作后立即测定结果:在450nm 波长处测定各孔的OD 值;以吸光度OD 值为纵坐标(Y),相应的HSP70标准品浓度为横坐标(X),做得相应的曲线,样品的HSP70含量可根据其OD 值由标准曲线换算出相应的浓度。
1.9 肝组织HSP70,mRNA Real-Time PCR 相对定量分析的测定
在PCR 反应体系中添加荧光物质,利用荧光物质和PCR 扩增产物的结合,实时检测荧光信号。实验操作步骤:首先进行RNA 抽提,接着进行反转录,然后进行Real-Time PCR 进行相对定量分析。HSP70及内参基因GAPDH信息见表1。

表1 HSP70及GAPDH 基因信息
1.10 统计学分析
实验数据采用均数±标准差(M±SD)表示,组间比较采用t检验,各均值用多个Independent-Samples T Test;关联度高的反映同功能的生理指标则采用Paired-Samples T Test处理,显著性水平为P<0.05,非常显著性水平为P<0.01。
2 结果
2.1 肝组织病理学变化
肝组织病理学切片HE染色,亚低温游泳组相比常温游泳组SD 大鼠NAFLD 动物模型光镜下:肝小叶结构更清晰,脂滴空泡视野数目显著性减少。

图1 C组HE染色(40×10)
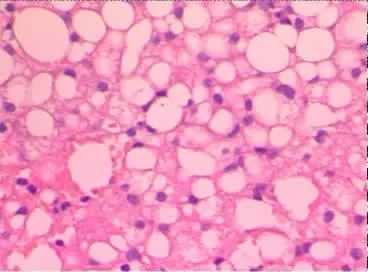
图2 F组HE染色(40×10)
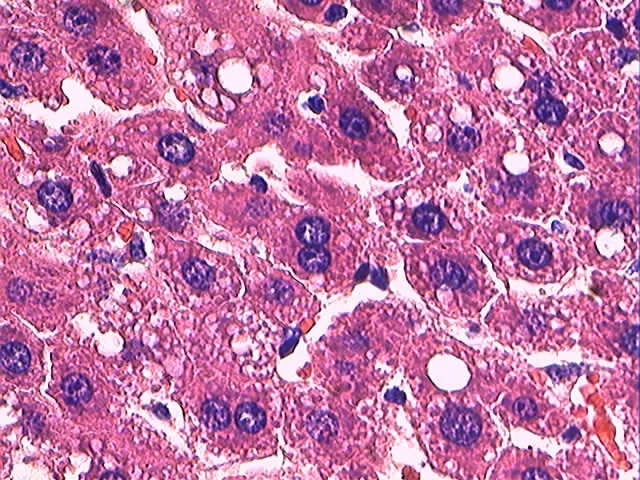
图3 HS组HE染色(40×10)
2.2 血清脂肪代谢指标的变化
结果显示,F 组血清学脂肪代谢指标表现为升高的变化,其中TG、TC、FFA 同C 组比较,均呈非常显著性差异(P<0.01);LDL 同C 组比较,呈显著性差异(P<0.05);HDL同C组比较,无显著性差异(P>0.05)。HS组血清学脂肪代谢指标表现为降低的变化,其中TG、TC、FFA 同F组比较,均呈非常显著性差异(P<0.01);LDL同F 组比较,呈显著性差异(P<0.05);HDL 同F 组比较,无显著性差异。TS组血清学脂肪代谢指标表现为降低的变化,其中TG、TC、FFA 同F 组比较,呈显著性差异(P<0.05);LDL、HDL同F组比较,无显著性差异(P>0.05)。HI、TI组血清学脂肪代谢指标:TG、TC、FFA、LDL、HDL同F组比较,表现为降低的变化,但无显著性差异(P>0.05)。

图4 TS组HE染色(40×10)
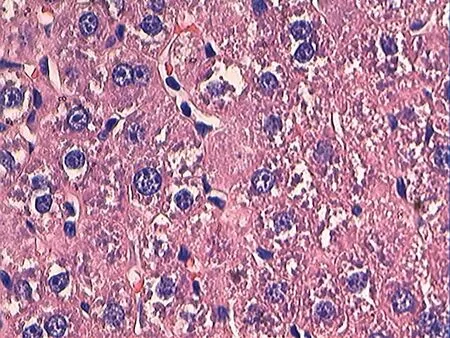
图5 HI组HE染色(40×10)

图6 TI组HE染色(40×10)

表2 血清学脂肪代谢指标的比较
2.3 肝组织氧化应激指标的变化
结果显示,F 组肝组织MDA 同C 组比较,呈升高变化,有非常显著性差异(P<0.01);F 组肝组织GSH、SOD同C组比较,呈降低变化,均有非常显著性差异(P<0.01)。HS组肝组织MDA 同F组比较,呈降低变化,有非常显著性差异(P<0.01);HS 组肝组织GSH、SOD 同F组比较,呈升高变化,有非常显著性差异(P<0.01)。TS组肝组织MDA 同F 组比较,呈降低变化,有显著性差异(P<0.05);TS组肝组织GSH、SOD 同F 组比较,呈升高变化,有显著性差异(P<0.05)。HI、TI组肝组织MDA同F组比较,呈降低变化,但均无显著性差异(P>0.05);HI、TI组肝组织GSH、SOD 同F组比较,呈升高变化,但均无显著性差异(P>0.05)。

表3 肝组织氧化应激指标的比较
2.4 肝组织HSP70的变化
结果显示,F组的肝组织HSP70同对照组C 比较呈升高变化,但是无显著性差异(P>0.05)。HS 组的肝组织HSP70同对照组C、F组比较呈升高变化,有非常显著性差异(P<0.01)。HI组、TS组、TI组肝组织HSP70同对照组C、F组比较呈升高变化,但无显著性差异(P>0.05)。

表4 肝组织HSP70的比较
2.5 肝组织HSP70mRNA Real-Time PCR相对定量分析的变化
结果显示,F 组的肝组织HSP70 mRNA Real-Time PCR 表达量同C组比较,呈升高变化,无显著性差异(P>0.05)。HS组的肝组织HSP70mRNA Real-Time PCR 表达量同对照组C、F组比较,均呈升高变化,有非常显著性差异(P<0.01)。HI组、TS组、TI组的肝组织HSP70mRNA Real-Time PCR表达量同对照组C、F 组比较,均呈升高变化,但是均无显著性差异(P>0.05)。

表5 肝组织HSP70mRNA Real-Time PCR表达量差异的比较
3 讨论
本实验结果显示,HS组(图1-3)肝组织病理切片光镜下:肝小叶结构尚可见。肝细胞以中央静脉为中心呈放射状排列,形成肝细胞索,但是结构有些紊乱。肝细胞内、核周可见少量(>30%视野)脂肪小空泡,散布于胞浆中,即小泡性脂肪变性。伴有融合性大空泡出现。F 组(图1-2)肝组织病理切片光镜下:肝小叶与肝细胞索消失。肝细胞内、核周可见大量(>90%视野)脂肪小空泡,散布于胞浆中,即小泡性脂肪变性。伴有融合性大空泡出现,将胞核挤压至细胞膜边侧,酷似脂肪细胞,并彼此融合成大小不一的脂囊。HS组同F组比较呈肝细胞脂肪变程度减轻,有非常显著性差异(P<0.01)。
不难看出,亚低温状态联合有氧运动干预组相比NAFLD 造模组肝组织病理切片光镜下:肝小叶结构尚清晰,肝索可见,核周脂肪小空泡数目明显减少,未见融合性大空泡和脂囊出现。依据中华医学会肝脏病学分会脂肪肝和酒精性肝病学组颁布的非酒精性脂肪肝病诊断标准[8]判定亚低温状态联合有氧运动干预延缓NAFLD 形成的效果。
1962年Ritossa首先发现当果蝇唾液腺暴露于热环境(热休克)后,其多丝染色体的膨松方式发生改变,显示某些基因的转录被激活[9];1974年Tissieres等采用聚丙烯酰胺凝胶电泳从遭受热休克的果蝇唾液腺中分离出一组新的蛋白质HSPs[10]。近年来国内外学者对之进行了广泛、深入研究发现:虽然早期研究观察到热刺激可诱导HSPs的产生,但后续许多研究表明,除热环境外,许多其它的物理、化学及生物应激原(如缺血、缺氧、寒冷、感染、炎症、、创伤、放射线、重金属、能量代谢抑制剂、乙醇及氧自由基等)都可诱导HSPs的产生。因此,HSPs又称为应激蛋白(stress proteins,SP)[5]。HSP广泛存在于从原核生物到哺乳动物的整个生物界,亦存在于高等生物机体的各种细胞,表明它是在长期进化过程中保存下来的具有重要和普遍生物学意义的蛋白 质组[11-13]。
本实验结果显示(表2),HS组血清学脂肪代谢指标表现为降低的变化,其中TG、TC、FFA 同F 组比较,均呈非常显著性差异(P<0.01);LDL 同F 组比较,呈显著性差异(P<0.05);HDL 同F组比较,无显著性差异。这表明,在SD 大鼠NAFLD 模型建造过程中,对其实施亚低温状态下联合有氧运动干预措施能非常明显地改善NAFLD 脂肪代谢、降低血清FFA 浓度,延缓NAFLD 的发生。本研究认为,可能是亚低温状态下联合有氧运动干预措施,刺激NAFLD 肝细胞生成的应激蛋白参与了脂质代谢,并加速了脂质代谢。
HSP对氧自由基引起细胞损害的保护作用的目标可能是膜的脂质过氧化、DNA 或线粒体。HSP70的高表达可以耐受过氧化物对细胞膜的损伤,减少Ca2+进入细胞,从而保护细胞免受由活性氧族(Reactive oxygen species,ROS)介导的Ca2+细胞内流所导致的细胞毒性和细胞死亡。线粒体 可能是HSP保护的 主要目标[14-15]。
本实验结果显示(表3),HS组肝组织MDA 同F组比较,呈降低变化,有非常显著性差异(P<0.01);HS组肝组织GSH、SOD 同F组比较,呈升高变化,有非常显著性差异(P<0.01)。这表明,在SD 大鼠NAFLD 模型建造过程中,对其实施亚低温状态下联合有氧运动干预措施,可以非常明显地增强NAFLD 肝细胞抗氧化应激能力。本研究认为,可能是HSP70参与了增强NAFLD 肝细胞抗氧化应激能力的环节。
本实验结果显示,HS组的肝组织HSP70同对照组C、F组比较呈升高变化(表4),有非常显著性差异(P<0.01)。HS组的肝组织HSP70mRNA Real-Time PCR 表达量同对照组C、F组比较,均呈升高变化(表5),有非常显著性差异(P<0.01)。本研究表明,在SD 大鼠NAFLD 模型建造过程中,对其实施亚低温状态下联合有氧运动干预措施,可以诱导NAFLD 肝细胞生成大量的应激蛋白。本研究认为,正是这些诱导生成的大量应激蛋白发挥其综合生物效应,才使得亚低温状态下联合有氧运动干预措施成为更有效延缓NAFLD 发生、发展的举措。
机体细胞内HSP70家族基因表达水平增加,可抑制应激酶激活及凋亡激活基因的表达,防止细胞凋亡[16-18]。HSP70具有分子伴侣生物学效应。分子伴侣是细胞内帮助新合成或解折叠蛋白正确折叠和成功组装,而自身不具功能的组成蛋白。HSP70作为主要的分子伴侣蛋白,参与到新生、未折叠、错折叠或聚集的蛋白质结合,使某些蛋白质解离,减少产生不溶性聚集物的危险性,并帮助需要折叠的蛋白正确折叠;维持某些肽链的伸展状态,以利于其跨膜转运,在线粒体、内质网等不同区域内发挥作用;同时还能促进某些变性蛋白的降解和清除,维持酶的动力学特征,以维护 细胞功能[19-21]。
HSP70具有抗炎症反应的生物学效应。有研究[22-23]发现:HSP70的表达能够抑制肝细胞中NOS2(Nitric Oxide Synthase2)基因的转录及合成,降低NOS2的活性,减轻LPS和促炎因子对组织细胞的损伤。通过热休克和亚砷酸钠处理诱导细胞表达HSP增加可抑制细胞因子诱导的IL 8和TNFα在mRNA 和蛋白水平的表达,细胞因子诱导IkBa的磷酸化及降解受抑,结果[24]提示HSP的抗炎作用可能与防止IkBa的激活,进而抑制NFkB的活化有关[25]。
4 小结
在SD 大鼠NAFLD 模型建造过程中,实施亚低温状态下联合有氧运动干预措施,可以诱导NAFLD 肝细胞生成大量的应激蛋白。HSP70 可能参与并加速脂质代谢、参与增强NAFLD 肝细胞抗氧化应激能力的环节、减少线粒体凋亡、内质网应激发生的通路和减少炎症因子的生成,通过这些途径延缓NAFLD 的发生与发展。
[1]Patrick L.Nonalcoholic fatty liver disease:relationship to insulin sensitivity and oxidative stress[J].Altern Med Rev,2002,7(4):276-291.
[2]窦艳玲,赵洪川.非酒精性脂肪肝病的新认识[J].中日友好医院学报,2005(19):367-368.
[3]王来栓,于立君,张旭东,等.亚低温对新生大鼠缺氧缺血脑损伤线粒体功能及凋亡的影响[J].复旦学报:医学科学版,2003,30(2):95-98.
[4]于立君.亚低温对新生鼠缺氧缺血脑损伤的能量代谢的作用[D].上海:复旦大学,2003.
[5]Hightower L E.Heat shock,stress proteins,chaperones,and proteotoxicity[J].Cell,1991,66(2):191-197.
[6]Lieber C S,Leo M A,Mak K M,et al.Model of nonalcoholic steatohepatitis[J].American Journal of Clinical Nutrition,2004,79(3):502-509.
[7]秦智.亚低温状态下游泳运动预防与改善SD 大鼠NAFLD 效果及机制实验研究[D].广州:华南师范大学,2010.
[8]中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪肝病诊断标准[J].中华肝脏病学杂志,2003,11(2):71.
[9]Ritossa F.A new puffing pattern induced by temperature shock and DNP in Drosoph-ila[J].Experimentia,1962(13):571-573.
[10]Tissières A,Mitchell H K,Tracy U M.Protein sysnthesis in salivary glands of Drosophila melanogaster:relation to chromosome puffs[J].J Mol Biol,1974(84):389-398.
[11]Macario A J,Conway de Macario E.Sick chaperones,cellular stress,and disease[J].N Engl J Med,2005,353(14):1489-1501.
[12]Macario A J,Lange M,Ahring B K,et al.Stress genes and proteins in the archaea[J].Microbiol Mol Biol Rev,1999,63(4):923-967.
[13]牛丕业.热休克蛋白70在紫外线致DNA 损伤与修复中的作用[D].武汉:华中科技大学,2006.
[14]Barrett M J,Alones V,Wang K X,et al.Mitochondriaderived oxidative stress induces a heat shock protein response[J].J Neuro sci,Res,2000,78(3):420-429.
[15]Carini R,Albano E.Recent insights on the mechanisms of liver preconditioning[J].Gastroenterology,2003,125(5):1480.
[16]Beere H M.Stressed to death:regulation of apoptotic signaling pathways by the heat shock proteins[J].Sci STKE.,2001(93):1.
[17]Garrido C,Gurbuxani S,RavagnanL,et al.Heat shock proteins:endogenous modulators of apoptotic cell death[J].Biochem Biophys Res Commun,2001,286(3):433.
[18]Li Z,Zhao X,Wei Y.Regulation of apoptotic signal transduction pathways by the heat shock proteins[J].Sci China C Life Sci,2004,47(2):107.
[19]Welch W J.Heat shock proteins functioning as molecular chaperones:their roles in normal and stressed cells[J].Philos Trans R Soc Lond B Biol Sci,1993,339(1289):327.
[20]Moseley P L.Heat shock proteins and heat adaptation of the whole organism[J].J Appl Physiol,1997,83(5):1414-1417.
[21]Ellis R J,Hemmingsen S M.Molecular chaperones:proteins essential for the biogenesis of some macromoleculular structures[J].Trends Biochem Sci,1989,14(8):339-342.
[22]Murphy P,Sharp A,Shin J,et al.Suppressive effects of ansamycins on inducible nitric oxidesynthase expression and the development of experimental autoimmune encephalomyelitis[J].J Neurosci Res,2002,67(4):461.
[23]De Vera M E,Kim Y M,Wong H R.Heat shock response inhibits cytokine-inducible nitric oxide synthase expression in rat hepatocytes[J].Hepatology,1996,24(5):1238.
[24]Petrof E O,Ciancio M J,Chang E B.Role and regulation of intestinal epithelial heat shock proteins in health and disease[J].Chin J Dig Dis,2004,5(2):45-50.
[25]金欢胜.HSP70介导肾脏缺血预适应保护作用的实验研究[D].重庆:第三军医大学,2005.

