常规超声对甲状腺滤泡肿瘤的鉴别诊断价值
赖兴建,张 波,姜玉新,朱庆莉,杨 萌,戴 晴,夏 宇,杨 筱,赵瑞娜
中国医学科学院 北京协和医学院 北京协和医院超声医学科,北京100730
甲状腺滤泡肿瘤包括较常见的良性腺瘤以及较少见的恶性滤泡癌[1-4]。腺瘤和滤泡癌的鉴别有助于减少不必要的手术[5-6],但目前尚无临床特征、影像学检查甚至细胞学检查可较准确地区分滤泡癌和腺瘤,因此怀疑滤泡肿瘤的结节通常需要手术[1,6]。随着超声仪器的进步、分辨率的提高,已有多位学者尝试寻找滤泡癌的超声特征,希望用于鉴别滤泡肿瘤,但结果却不尽相同[1,7-8]。为排除年龄和性别对超声图像的影响,本研究回顾性评估年龄和性别匹配的滤泡癌和腺瘤患者超声图像,探讨常规超声在甲状腺滤泡癌和腺瘤鉴别诊断中的价值。
对象和方法
对象 选取2000年1月至2012年11月在本院就诊并且病理证实为甲状腺滤泡癌、术前超声资料完整的患者36例,年龄14~68岁,平均 (43.22±16.57)岁,其中男性8例、女性28例;共37个结节,结节最大径0.9~8.5 cm,其中1例患者有2个滤泡癌结节。对照组为同时期内性别、年龄相匹配、病理证实为甲状腺腺瘤、术前超声资料完整的患者72例,年龄26~78岁,平均 (44.38±11.20)岁,其中男性16例、女性56例;共74个结节,结节最大径0.5~9.0 cm,其中2例患者各有2个腺瘤结节。
方法 患者术前均由超声医生对甲状腺进行常规超声检查,获得二维及彩色多普勒图像。采用的超声诊断仪包括GE Logic 7、GE Logic 9及Philips IU 22等,探头频率为8~15 MHz。2名经验丰富的超声医生根据术前超声图像回顾性评估结节的各种超声特征,具体为:形态:分为规则和不规则,规则是指椭圆形或圆形,不规则是指除圆形和椭圆形之外的其他形态,如大分叶状、小分叶状和多结节状等。边界:分为清和不清。晕:分为无晕、细晕和不规则晕,不规则晕包括粗大晕和不完整晕等。回声:分为极低回声、低回声、中等回声和高回声。均匀性:是指结节内部回声是否均匀,分为均匀、较均匀和不均。内部结构:是指结节内囊性成分的多少,分为实性、囊性成分1%~5%、囊性成分6%~50%以及囊性成分51%~100%。钙化:分为无钙化、微钙化和非微钙化,微钙化是指直径≤0.1 cm的钙化,非微钙化是指除了微钙化之外的其他钙化,包括弧形钙化、条状钙化和团状钙化等。血流:对于Philips IU 22获得的图像,采用Frates等[9]描述的方法,将血流分为0型,无血流;1型,少许内部血流且无周边环状血流;2型,周边环状血流但无或少许内部血流;3型,周边环状血流及中等内部血流;4型,丰富内部血流伴或不伴周边环状血流。此外评估颈部是否有异常淋巴结,甲状腺内是否同时并存其他滤泡肿瘤以及除了滤泡肿瘤之外的其他病变,如结节性甲状腺肿、桥本氏病以及乳头状癌等。
统计学处理 计量资料采用均值±标准差表示。滤泡癌和腺瘤的患者年龄及结节最大径比较采用t检验;两种肿瘤的各种声像图特征比较采用χ2检验。对于分类超过两项的声像图特征,将分类合并为两项后再次进行χ2检验。P<0.05为差异具有统计学意义。
结 果
临床特征 甲状腺滤泡癌和腺瘤的大小差异无统计学意义 (P=0.938)。有2例滤泡癌出现淋巴结转移及远处转移 (均为肺和骨转移),但由于出现转移的滤泡癌病例数太少,与腺瘤组相比差异无统计学意义 (P=0.109)。多发滤泡肿瘤的比例在两组间差异无统计学意义 (P=0.729),但滤泡癌组并存其他病变的比例 (56.8%)明显高于腺瘤组 (28.4%)(P=0.028)(表1)。
超声声像图特征 对Philips IU 22获得的31例滤泡癌图像和59例腺瘤图像比较了血流状况。GE Logic 7和GE Logic 9获得的滤泡癌图像和腺瘤图像由于例数太少未比较血流状况。滤泡癌的形态、晕、边界、钙化与腺瘤差异具有统计学意义 (P<0.05)(表2);滤泡癌的回声、内部结构与腺瘤差异亦具有统计学意义 (P<0.05)(表3)。形态不规则、无细晕 (包括无晕和不规则晕)、边界不清、回声低或极低、有微钙化、实性的结节在滤泡癌中更常见 (图1),形态规则、有细晕、边界清、回声中等或高回声、无钙化、囊实性的结节在腺瘤中更常见 (图2)。滤泡癌与腺瘤之间回声均匀性以及血流状况差异无统计学意义 (P>0.05)。

表1 甲状腺滤泡癌与腺瘤的临床特征比较Table 1 The clinical features of follicular carcinoma and adenoma
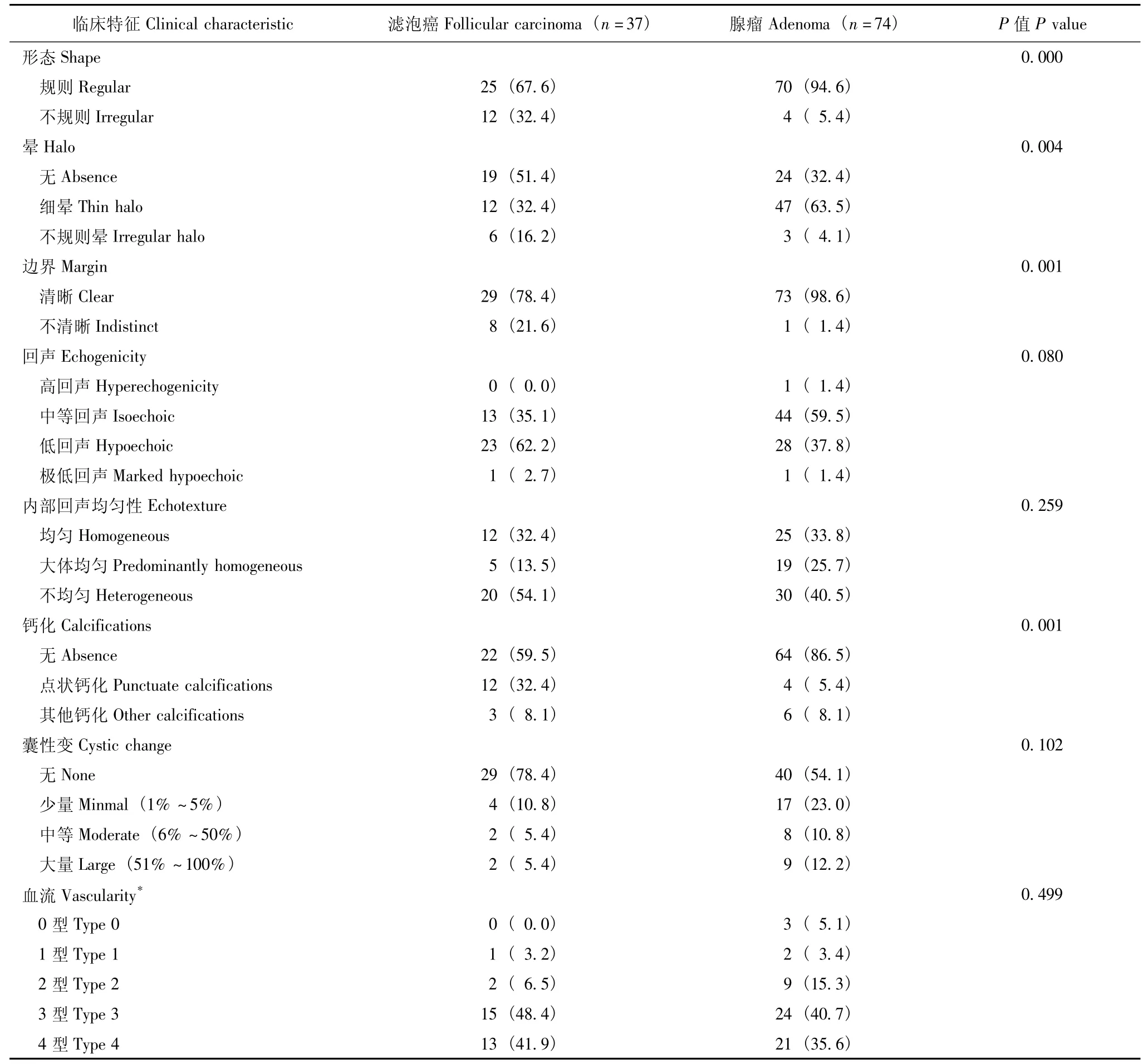
表2 甲状腺滤泡癌与腺瘤的超声声像图特征比较[n(%)]Table 2 The detailed sonographic variables for follicular carcinoma and adenoma[n(%)]

表3 甲状腺滤泡癌与腺瘤部分合并后的超声声像图特征比较[n(%)]Table 3 The combined sonographic features of follicular carcinoma and adenoma[n(%)]

图1 甲状腺滤泡癌超声声像图Fig 1 Sonogram of a follicular carcinoma

图2 甲状腺腺瘤超声声像图Fig 2 Sonogram of an adenoma
讨 论
超声声像图中,大多数滤泡肿瘤为椭圆形或圆形,这可能与肿瘤内部生长较一致以及外周有包膜有关。随着肿瘤的进一步生长,部分包膜可形成突起,出现不规则形,包括小分叶状、大分叶状甚至多结节状。不规则形在滤泡癌中更常见可能表明滤泡癌的局部生长加速[10]。
晕是指肿瘤周围的回声减低区,对应于切除标本中滤泡肿瘤周围的包膜以及周围被挤压的血管。边界清晰、完整的包膜是病理医生诊断腺瘤的重要条件。Sillery等[1]研究显示,结节周边可见晕在腺瘤中更常见,但作者未对晕进一步细分。本研究显示,细晕在腺瘤中更常见,而无晕和不规则晕则在滤泡癌中更常见。这可能是因为细晕表明包膜完整性较好,而无细晕可能提示包膜不完整。显微镜下显示,滤泡癌的包膜较厚且不规则[2]。
有研究显示低回声是滤泡癌的危险因素[1,7-8],本研究也证实了这一点。回声减低的原因可能是滤泡细胞快速、紊乱生长,失去正常甲状腺实质中滤泡的正常有序排列。一般而言,大多数滤泡肿瘤的内部回声相对于结节性甲状腺肿较均一,大体外观也是如此。滤泡肿瘤回声不均可能反映了肿瘤内基质和滤泡组织成分的不同。本研究和既往研究[1,7-8]均表明,内部回声是否均匀在滤泡癌和腺瘤中差异无统计学意义。
本研究滤泡癌合并钙化的比例 (40.5%)高于腺瘤 (13.5%),尤其是合并微钙化 (32%比7%),这可能与滤泡癌的生长特点有关。滤泡癌细胞生长更为迅速,更容易出现出血、坏死等,导致钙化形成。类似地,滤泡癌中囊性变更少见可能是由于癌细胞快速增殖,且未出现良性腺瘤中常见的自身溶解和退行性囊性变。
由于肿瘤内部的无序生长,内部血供通常较丰富,尤其是恶性肿瘤[11]。但是,通过彩色多普勒评价血供情况很难进行标准化,只能采取半定量方式,本研究采用的是 Frates等[9]提出的半定量方法。Iared等[10]指出,彩色多普勒评价滤泡肿瘤内血供丰富的阴性预测值达96%,阳性预测值却仅15%。笔者将Frates等[9]提出的0~2型合并为内部血流较少,将3~4型合并为内部血流较丰富后,发现尽管内部血流较丰富的结节在滤泡癌中更多见,但与腺瘤相比差异无统计学意义。
滤泡肿瘤通常是正常甲状腺中的一个孤立结节,但也可以多发,或合并其他甲状腺疾病,包括结节性甲状腺肿、桥本氏病以及乳头状癌等。本研究显示合并其他甲状腺疾病在滤泡癌中更常见,这与文献[2]报道相符。这些病例表明,在日常工作中遇到多个结节以及合并其他甲状腺疾病时,应警惕其中有滤泡癌的可能。
综上,滤泡癌和腺瘤的声像图有许多重叠之处,但有些特征有助于区分两者。对于超声检查或穿刺活检怀疑滤泡肿瘤的结节,如果形态不规则、无细晕、边界不清、回声低或极低、有微钙化、实性,该结节为滤泡癌的可能性较大,应鼓励患者接受手术切除。相反,如果该结节形态规则、有细晕、边界清、回声中等或高回声、无钙化、囊实性,该结节为腺瘤的可能性较大;此时如果患者不愿接受切除手术,可接受临床和超声随诊。
[1]Sillery JC,Reading CC,Charboneau JW,et al.Thyroid follicular carcinoma:sonographic features of 50 cases[J].AJR Am J Roentgenol,2010,194(1):44-54.
[2]McHenry CR,Phitayakorn R.Follicular adenoma and carcinoma of the thyroid gland [J].Oncologist,2011,16(5):585-593.
[3]Serra S,Asa SL.Controversies in thyroid pathology:the diagnosis of follicular neoplasms [J].Endocr Pathol,2008,19(3):156-165.
[4]Kato MA,Fahey TJ 3rd.Molecular markers in thyroid cancer diagnostics[J].Surg Clin North Am,2009,89(5):1139-1155.
[5]Castro MR,Gharib H.Continuing controversies in the management of thyroid nodules [J].Ann Intern Med,2005,142(11):926-931.
[6]Schlinkert RT,van Heerden JA,Goellner JR,et al.Factors that predict malignant thyroid lesions when fine-needle aspiration is“suspicious”for follicular neoplasm [J].Mayo Clin Proc,1997,72(10):913-916.
[7]Koike E,Noguchi S,Yamashita H,et al.Ultrasonographic characteristics of thyroid nodules:prediction of malignancy[J].Arch Surg,2001,136(3):334-337.
[8]Rago T,Di Coscio G,Basolo F,et al.Combined clinical,thyroid ultrasound and cytological features help to predict thyroid malignancy in follicular and Hürthle cell thyroid lesions:results from a series of 505 consecutive patients[J].Clin Endocrinol(Oxf),2007,66(1):13-20.
[9]Frates MC,Benson CB,Doubilet PM,et al.Can color Doppler sonography aid in the prediction of malignancy of thyroid nodules? [J].J Ultrasound Med,2003,22(2):127-131.
[10]Iared W,Shigueoka DC,Cristofoli JC,et al.Use of color Doppler ultrasonography for the prediction of malignancy in follicular thyroid neoplasms:systematic review and metaanalysis[J].J Ultrasound Med,2010,29(3):419-425.
[11]张波,姜玉新.甲状腺结节的超声诊断思维[J].中华超声影像学杂志,2011,20(8):726-728.

