心房钠尿肽及N末端B型利钠肽原水平与糖尿病发生的相关性研究
丽英,杨红云,王德超
糖尿病是由各种病因所导致的一种代谢性疾病,患者出现高血压、周围动脉疾病和心力衰竭等疾病的风险也显著增加,但其病理生理机制尚不明确。利钠肽类(NPs)是由心肌细胞分泌的一类多肽类激素,通常在心肌细胞受到牵拉时其分泌增加,参与调节血压及心肌重构[1]。研究表明,钠尿肽水平降低可导致肾素-血管紧张素-醛固酮系统(RAAS)的激活,胰岛素抵抗、高血压及肥胖风险升高[2-4]。最近,一项大型研究同样证实,低水平的中段心房钠尿肽(MR-ANP)和N末端B型利钠肽原(NT-proBNP)可预测糖尿病发生[5],但该注册研究中有大量糖尿病患者未经证实。因此,本研究旨在探讨低NPs水平(MR-ANP和NT-proBNP)与无糖尿病的健康人群空腹血糖水平及糖尿病进展的关系。
1 资料与方法
研究对象:本研究连续入选2009-01至2010-12到我中心参加体检的664例受试者,除外心功能不全、家族性糖尿病及1型糖尿病患者。其中417例受试者行空腹血糖或口服糖耐量试验(OGTT),是本研究观察的对象,其中64例患者在入选时空腹血糖≥6.1 mmol/L、既往诊断糖尿病或正服用降糖药物,因此诊断为基线糖尿病;剩余353例无糖尿病的受试者,男性138例,随访时间为2年,观察受试者是否在随访期新发糖尿病。
研究方法:记录所有受试者的基线资料,包括年龄、性别、身高、体重、入院心率、个人史、家族史。所有受试者经过系统的体格检查和实验室评估,入选时诊室测量血压≥ 140/90 mmHg(1 mmHg=0.133 kPa)或服用降压药物的患者诊断为高血压,计算所有受试者的体重指数。
所有受试者均于晨间空腹取腹静脉血5 ml,加入二乙胺四乙酸二钾 EDTA-K2抗凝管混匀,4℃ 3000 r/min离心10 min,将分离的血浆密封储存于-70℃冰箱存放待测。在中心实验室常规检测患者甘油三酯、高密度脂蛋白胆固醇、空腹血糖、口服75 g葡萄糖后2 h血糖及胰岛素水平。采用酶法测定糖化血红蛋白水平(试剂由美康生物工程股份有限公司提供);NT-proBNP浓度测定使用德国Siemens公司的Dimension RxL Max全自动分析仪及试剂盒进行分析。使用一种免疫发光夹心法检测所有受试者的血清MR-ANP浓度(试剂盒由德国BRAHMS AG公司提供)。使用葡萄糖氧化酶法测定空腹血糖及OGTT血糖(试剂由中生北控生物科技股份有限公司提供),操作过程严格按试剂盒说明进行,仪器为日立7060全自动生化分析仪。使用稳态模型评估法测定胰岛素抵抗(HOMA-IR)。所有患者根据NT-proBNP及MR-ANP四分位值各分4组。
对353例基线时无糖尿病的受试者进行随访,随访时间为2年,随访期结束时所有受试者再次取空腹静脉血检测空腹血糖。所有数据严格质量控制后汇总录入数据库内,进行统计分析。
终点事件定义:糖尿病的发生作为本研究的终点事件,其定义参照世界卫生组织对糖尿病的定义。空腹血糖≥ 7.0 mmol/L 或 OGTT 后 2 h 血糖≥ 11.1 mmol/L,既往明确诊断为糖尿病或基线检测血糖水平后开始服用降糖药物。
统计分析:正态分布的计量资料以均数±标准差表示,组间比较采用单因素方差分析;计数资料以率和构成比表示,采用Pearson卡方检验比较组间差异;根据MR-ANP及NT-proBNP水平四分位值将所有受试者分为四组,由低至高,分别列为第1组、第2组、第3组和第4组。将MR-ANP及NT-proBNP分别作为分类变量及对数转换后的连续变量,使用多变量Logistic回归分析其与基线糖尿病及新发糖尿病的关系,计算比值比及95%可信区间(95% CI),纳入多变量回归模型的危险因素包括:年龄、性别、入院心率、血压、甘油三酯、吸烟史、空腹血糖、体重指数。所有分析均使用SPSS 16.0软件包进行,P<0.05表示差异有统计学意义。
2 结果
基线特征所有受试者基线特征见表1。基线糖尿病患者平均年龄较大,男性患者、合并高血压患者以及胰岛素抵抗的患者比例较大,体重指数、血压、空腹血糖、甘油三酯水平较高(P<0.05),而无糖尿病受试者的MR-ANP及NT-proBNP水平较高(P<0.05)。
表1 417 例受试者的基线资料(±s)
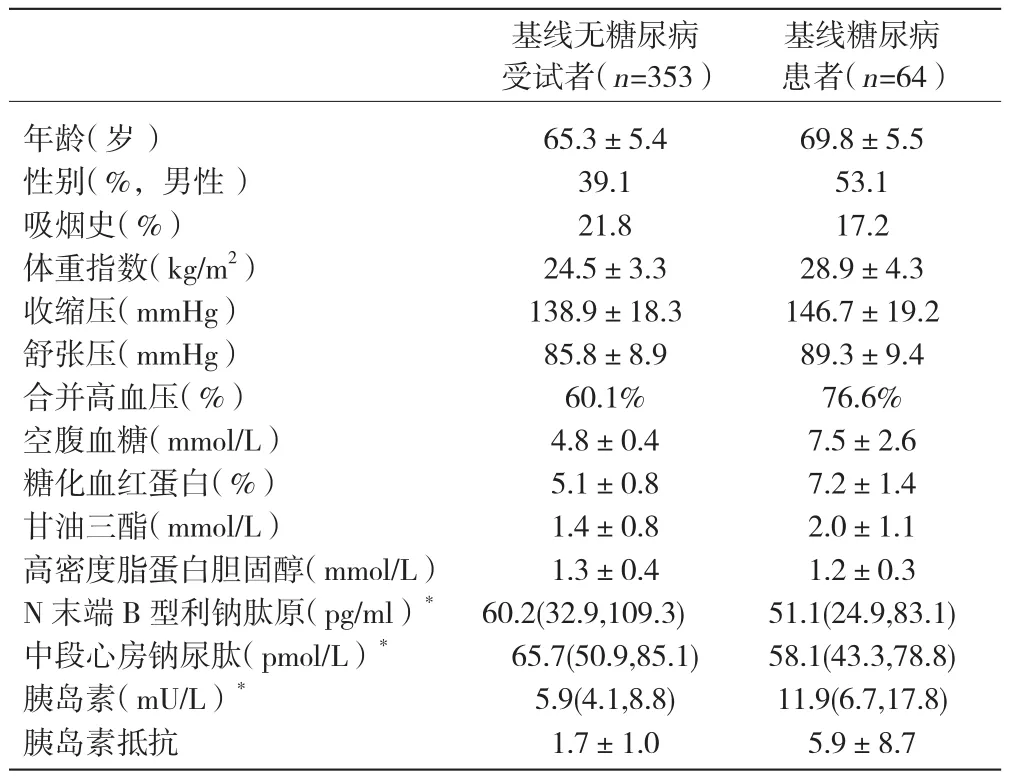
表1 417 例受试者的基线资料(±s)
注:*:为中位数(四分位数)
基线糖尿病患者(n=64)年龄(岁) 65.3±5.4 69.8±5.5性别(%,男性) 39.1 53.1吸烟史(%) 21.8 17.2体重指数(kg/m2) 24.5±3.3 28.9±4.3收缩压(mmHg) 138.9±18.3 146.7±19.2舒张压(mmHg) 85.8±8.9 89.3±9.4合并高血压(%) 60.1% 76.6%空腹血糖(mmol/L) 4.8±0.4 7.5±2.6糖化血红蛋白(%) 5.1±0.8 7.2±1.4甘油三酯(mmol/L) 1.4±0.8 2.0±1.1高密度脂蛋白胆固醇(mmol/L) 1.3±0.4 1.2±0.3 N末端B型利钠肽原(pg/ml)* 60.2(32.9,109.3) 51.1(24.9,83.1)中段心房钠尿肽(pmol/L)* 65.7(50.9,85.1) 58.1(43.3,78.8)胰岛素(mU/L)* 5.9(4.1,8.8) 11.9(6.7,17.8)胰岛素抵抗 1.7±1.0 5.9±8.7基线无糖尿病受试者(n=353)
NT-proBNP及MR-ANP与基线糖尿病患者的关系 根据对所有患者检测的MR-ANP值,第1组、第2组、第3组和第4组患者的MR-ANP水平分别为<48.6 pmol/L、48.7~63.9 pmol/L、64.0~83.6 pmol/L 和>83.6 pmol/L;所有患者 NT-pro BNP 水平分组:第 1组为 <30.7pg/ml;第 2 组为 30.8~58.6 pg/ml;第 3 组为58.7~103.5 pg/ml;第 4 组为 >103.5 pg/ml。对基线糖尿病患者及无糖尿病的受试者进行的分析显示,MRANP及NT-proBNP分组均与基线糖尿病发生相关。将MR-ANP及NT-proBNP水平作为连续变量进行Logistic回归分析显示,随着MR-ANP水平及NT-proBNP水平升高,基线糖尿病的发生风险降低。表2
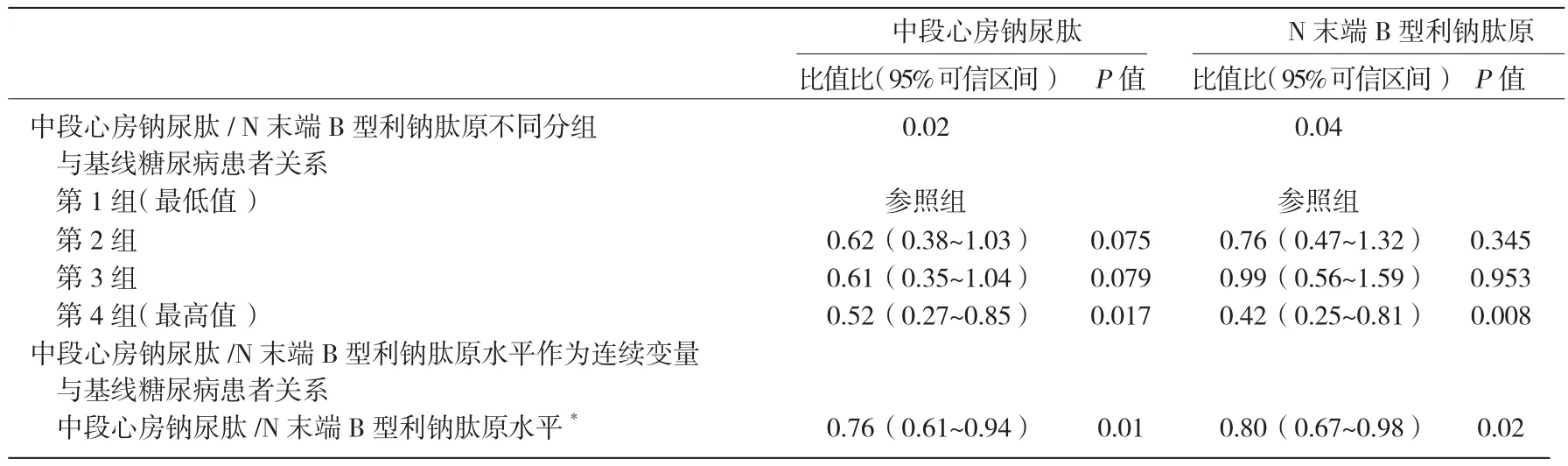
表2 中段心房钠尿肽及N末端B型利钠肽原水平与基线糖尿病患者的相关性分析
对基线空腹血糖水平与受试者不同分组关系进行分析表明,基线空腹血糖水平随MR-ANP水平升高而降低(P<0.05),而在不同NT-proBNP组中这种关系并不显著(P=0.121)。
MR-ANP及NT-proBNP水平与随访期新发糖尿病的关系 根据对353例基线时无糖尿病的患者检测的MR-ANP值,第1组、第2组、第3组和第4组患者的 MR-ANP 水平分别为 <50.9 pmol/L、51.0~65.7 pmol/L、65.8~85.1 pmol/L 和 >85.2 pmol/L;所有患者的NT-pro BNP水平分组:第1组为 <32.9 pg/ml;第2 组为33.0~60.2 pg/ml;第 3 组为 60.3~109.3 pg/ml;第 4 组为>109.3 pg/ml。对353例入选时无糖尿病的受试者随访2年,其中58例受试者出现新发糖尿病(16.4%)。多因素分析显示,MR-ANP及NT-proBNP分组与基线糖尿病发生不相关(表3)。将MR-ANP及NT-proBNP水平作为连续变量进行Logistic回归分析证实,随MRANP水平升高,新发糖尿病发生风险降低,但NT-proBNP水平与新发糖尿病发生风险不相关。表3
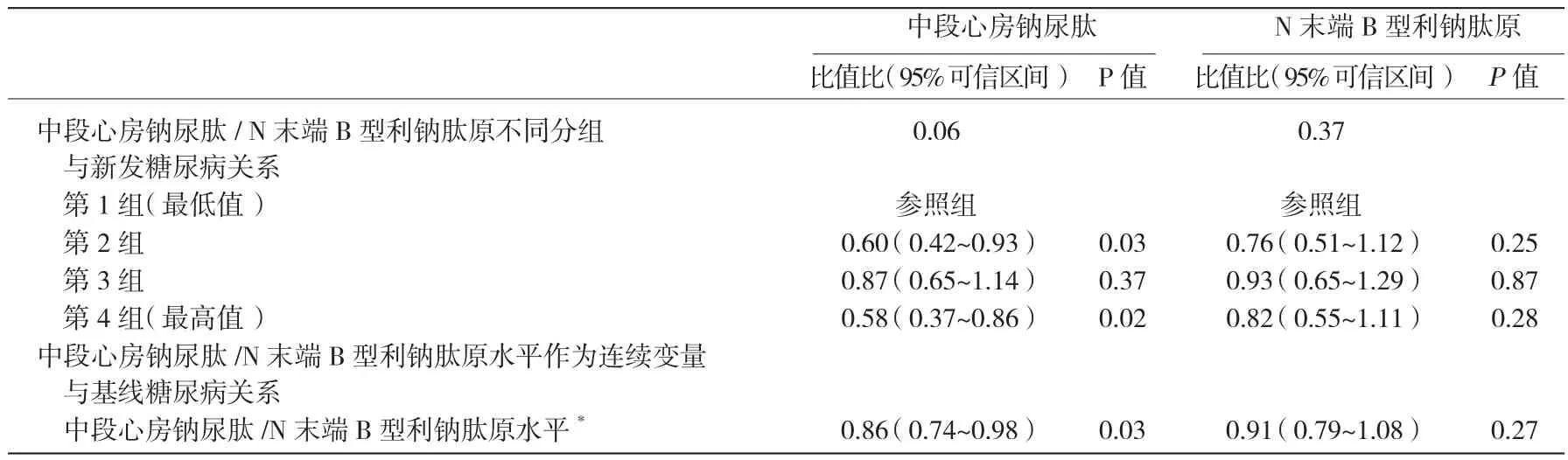
表3 基线中段心房钠尿肽及N末端B型利钠肽原水平与随访期新发糖尿病的关系
对入选时无糖尿病的353例受试者的MR-ANP及NT-proBNP水平与空腹血糖水平变化进行多元线性回归分析,结果显示,基线MR-ANP水平作为连续变量(P=0.004)或分类变量(P=0.04)时,均与空腹血糖值升高呈负相关。而基线NT-proBNP水平与空腹血糖值升高无关(连续变量时,P=0.106;分类变量时,P=0.05)。
3 讨论
本研究结论表明,糖尿病患者中能观察到MRANP及NT-proBNP水平的降低。在校正其它危险因素后,低水平MR-ANP能预测糖尿病的发生及空腹血糖的升高,提示低水平ANP与糖尿病发生可能存在因果关系。
ANP具有抑制血管紧张素的作用,参与机体水、盐代谢,并具有利尿、排钠、扩血管、降低血压等作用。人类及动物实验也证实了机体ANP水平降低与高血压发生有关[3]。本研究及既往横断面研究则表明,NPs水平降低与包括胰岛素抵抗在内的各种代谢综合征危险因素密切相关,推测其在糖尿病等代谢相关病理生理过程中起到重要作用[6],但其机制尚不明确。目前推测ANP水平降低可激活RAAS,增加氧化应激及炎症反应,并与胰岛素相互作用,干扰其降糖作用[7],形成胰岛素抵抗,从而影响机体糖代谢[8],使糖尿病发生风险大大增加,早期的临床研究也证实血管紧张素转化酶抑制剂或血管紧张素Ⅱ受体拮抗剂可降低糖尿病发生的风险,但最近的一项研究中,使用血管紧张素Ⅱ受体拮抗剂并不能显著降低血糖水平。其原因可能是,RAAS系统激活剂胰岛素抵抗并不能完全解释ANP水平降低与糖尿病发生的关系[9],本研究中,校正胰岛素抵抗及其他糖尿病危险因素后,MR-ANP水平降低同样与糖尿病发生相关,也证实了这一点。此外,机体ANP水平升高则能增加循环中胰岛素水平,并直接作用于胰岛抑制胰高血糖素的分泌,综上原因,ANP可能在糖代谢紊乱及糖尿病形成中具有重要作用。而在糖尿病患者中,心脏组织产生的ANP减少,和(或)清除增加可致NT-proBNP的降低,这也印证了我们的结论。
本研究同时还证实了低水平MR-ANP预测糖尿病发生及血糖升高明显优于低水平的NT-proBNP,这与之前的研究结果是一致的[6],反映了ANP和NT-proBNP作用于糖尿病或心血管疾病的倾向并不相同。这是因为ANP主要由心房肌细胞分泌,因而对心室内压及血流动力学状态的变化并不十分敏感,而NT-proBNP则主要由心室肌细胞分泌,能更敏感的反应出左室功能障碍[10]。因此,尽管本研究排除了心功能不全的患者,亚临床的左室收缩/舒张功能障碍仍能导致相对较高的NT-proBNP水平,从而掩盖低水平NT-proBNP与糖尿病发生及血统升高的关系。
从本研究可知,检测MR-ANP水平能与其它的糖尿病危险因素一起,共同预测糖尿病的发生。并且ANP水平降低还与高血压发生相关,因而提示通过生活方式或药物干预升高ANP水平将能有效预防糖尿病和高血压的发生。
但本研究中,我们并未在随访时检测MR-ANP及NT-proBNP水平,因而这些因子的变化在空腹血糖升高、胰岛素抵抗及糖尿病的发生中的作用仍有待进一步研究来加以证实。
总而言之,本研究证实了低水平MR-ANP与糖尿病发生及血糖水平升高的关系,表明了低水平ANP在糖尿病发生中可能起重要作用,因而可用于预测并作为预防糖尿病及相关疾病发生的新方法。
[1] D'Alessandro R, Masarone D, Buono A, et al. Natriuretic peptides:molecular biology, pathophysiology and clinical implications for the cardiologist.Future Cardiol, 2013, 9: 519-534.
[2] Kishi T, Hirooka Y, Konno S, et al. Angiotensin II receptor blockers improve endothelial dysfunction associated with sympathetic hyperactivity inmetabolic syndrome. J Hypertens, 2012, 30:1646-1655.
[3] Newton-Cheh C, Larson MG, Vasan RS, et al.Association of common variants in NPPA and NPPB with circulatingnatriuretic peptides and blood pressure. Nat Genet, 2009, 41:348-353.
[4] Miyashita K, Itoh H, Tsujimoto H, et al. Natriuretic peptides/cGMP/cGMP-dependent protein kinase cascadespromote muscle mitochondrial biogenesis and prevent obesity. Diabetes, 2009,58:2880-2892.
[5] Salomaa V, Havulinna A, Saarela O, et al. Thirty-one novel biomarkers as predictors for clinically incidentdiabetes. PLoS One, 2010,5:e10100.
[6] Wang TJ, Larson MG, Keyes MJ, et al. Association of plasma natriuretic peptide levels with metabolicrisk factors in ambulatory individuals. Circulation, 2007, 115:1345-1353.
[7] Moro C, Klimcakova E, Lolme`de K, et al. Atrial natriureticpeptide inhibits the production of adipokines and cytokineslinked to inflammation and insulin resistance in human subcutaneousadipose tissue. Diabetologia, 2007, 50:1038-1047.
[8] Bergandi L, Silvagno F, Russo I, et al. Insulin stimulates glucose transportvia nitric oxide/cyclicGMPpathway in human vascular smoothmuscle cells. Arterioscler Thromb Vasc Biol, 2003, 23:2215-2221.
[9] Barzilay JI, Gao P, Ryde´n L, et al. Effects of telmisartan on glucose levels in people at high riskfor cardiovascular disease but free from diabetes: the TRANSCEND study. Diabetes Care, 2011, 34:1902-1907.
[10] Elmas E, Brueckmann M, Lang S, et al. Mid-regional pro-atrial natriuretic peptide is a useful indicator for the detection of impaired left ventricular function in patients with coronary artery disease. Int J Cardiol, 2008, 128:244-249.

