萝卜硫素增加HL-60和人原代白血病细胞对化疗药敏感性实验研究
许晓峰 张学进 浙江省中西医结合医院肿瘤血液科 杭州 310003
程汝滨 浙江中医药大学药学院
高瑞兰 浙江省中医院血液病研究所
国内外研究发现,蔬菜中存在的一些化合物具有抗癌活性,尤其是富含胡萝卜素的蔬菜,胡萝卜、西兰花、椰菜及菠菜等[1-3],这些蔬菜富含多种芥子苷,经黑芥子硫酸苷酶酶解(myrosinase)或酸水解后产生萝卜硫素。萝卜硫素(sulforaphane,简称SF)是活力最强的一类异硫氰酸盐,它的抗癌作用已在大鼠的乳腺癌中得到充分证明[4],其对实体肿瘤的研究比较深入,但对白血病的研究很少。曾有学者报道SF 对HL-60细胞有抑制作用[5],但有关萝卜硫素与白血病细胞药物敏感性研究尚未见报道。因此,本研究采用白血病细胞体外集落形成药敏试验法和MTT 法探讨SF 与白血病化疗药物敏感性的关系,报道如下。
1 实验材料
1.1 靶细胞 HL-60 白血病细胞株:购自中科院上海细胞所。人原代白血病细胞:来自2010 年7 月-2012年11 月浙江省中西医结合医院血液科住院患者,共17 例,男12 例,女5 例,年龄15~76 岁;初治3 例,复发14 例。均经细胞形态学和组织化学染色确诊为髓系白血病,诊断均符合《血液病诊断及疗效标准》[6],按FAB 协作组分型确定M15 例,M210 例,M32 例。
1.2 主要试剂和药品 萝卜硫素(购自杭州临安天鸿生物科技有限公司,纯度98%,批号TH110720);高三尖杉酯碱(Hom,杭州民生药业集团有限公司);阿糖胞苷(Ara-c,杭州民生药业集团有限公司);小牛血清(杭州四季青生物工程材料研究所);IMDM 培养基(Gibco);青霉素钠(山东鲁抗制药);硫酸链霉素(华北制药公司);96 孔培养板(美国Becton);四唑蓝(上海生工);二甲基亚砜(国产分析纯);无菌水(平沙普爱思制药公司)。
1.3 仪器设备 CO2培养箱(德国Heraeus);移液器(P-20,P-200,法国Gilson);普通光学显微镜(日本Olympus);倒置显微镜(日本Olympus);层流洁净室(苏州净化);低温冰箱(日本三洋);恒温水浴箱(上海精宏实验设备有限公司);电子天平(瑞士Mettler-toledo);水平式离心机(北京医用离心机厂);酶标仪(BIO-TEX INSTRUMENTS.INC);游标卡尺(上海精密仪器仪表公司)。
2 实验方法
2.1 细胞株培养 HL-60 白血病细胞株常规接种于含10%灭活小牛血清、青霉素和链霉素各100U/mL的IMDM 培养液,置于37℃、5%CO2及饱和湿度的恒温箱中悬浮培养,每2~3 天换液。实验时取对数生长期的细胞。
2.2 化疗药物 选择临床常用的Hom 和Ara-c,琼脂半固体集落培养和MTT 法均经预实验体外培养对白血病细胞克隆抑制的生长曲线,确定恰当浓度用于实验。
2.3 琼脂半固体集落培养法 取对数生长期的HL-60 细胞进行集落培养实验。
2.3.1 抑制实验 经1 000rpm/min 离心5min,收集细胞。2mL 培养体系含20%小牛血清,青霉素、链霉素各100U/mL,0.3%琼脂的IMDM 培养液,实验组SF 的终浓度分别为5、10、20、40μmol/L,以不加SF为对照组。每浓度设3 个平行孔,接种细胞数均为2.0×102/0.5mL/孔。
2.3.2 协同实验 2mL 培养体系除含上述各组分外,再加入Hom,终浓度为5μg/L,抑制率为(20.2±6.7)%;加入Ara-c,终浓度为2μg/L,抑制率分别为(19.7±5.5)%,以不加SF 和化疗药物为对照组。
将上述不同组合的细胞均置于37℃、5%CO2及饱和湿度的恒温箱中,6 天后计数集落,根据各细胞株增殖潜能的不同,计数集落标准定为CFU-K562 和CFU-HL-60 集落(>40 个细胞),并计算各实验组对细胞生长的抑制率,抑制率=(1-A实验组/A对照组)×100%。
2.4 PHA-LCM 液相-半固体二步培养法[7]
2.4.1 抑制实验 观察不同浓度SF 对人原代白血病细胞的作用。将未经治疗的急性髓系白血病(AML)患者的骨髓标本沿试管壁加于淋巴细胞分离液上,1 500rpm/min 离心15min,吸取单个核细胞,单IMDM培养液洗涤1 次,离心弃上清,加入双IMDM 培养液使成2×106/mL 的细胞悬液。实验组SF 的浓度分别为5、10、20、40μmol/L,以不加SF 为对照组。总体积2mL,设3 个平行孔,接种细胞数为105/0.5mL/孔。
2.4.2 协同实验 观察SF 与化疗药物Hom 和Ara-c 的联合作用。2mL 培养体系中各组分和不同浓度的SF 均与上述增殖实验相同,再分别加入终浓度为0.5mg/L Hom 和25mg/L Ara-c,抑制率分别为(22.6±16.0)%和(21.5±9.9)%,以不加SF 和化疗药物为对照组,置于37℃、5%CO2及饱和湿度的恒温箱中孵育1h,用单IMDM 培养液洗涤1 次,离心弃上清,加入双IMDM 培养液使成2×106/mL 的细胞悬液。
将上述不同组合的细胞均用20%的植物血凝素-白细胞条件培养基(PHA-LCM)作刺激因子孵育20h,然后加入琼脂进行半固体集落培养,培养体系含20%的马血清、10%的PHA-LCM 和0.3%的琼脂,均置于37℃、5%CO2及饱和湿度的恒温箱中培养7天后,计数白血病集落数(>40 个细胞),并计算各实验组对细胞生长的抑制率,抑制率=(1-A实验组/A对照组)×100%。按化疗药物抑制率>30%作为对该药敏感,而<30%为对该药不敏感的标准来判断[8]。
2.5 MTT 法检测SF 对HL-60 细胞增殖的影响及其与化疗药物的联合作用
2.5.1 抑制实验 实验分为对照组和实验组,SF 终浓度分别为0.5、10、20、40μmol/L,药物干预时间为48h,每组设3 个复孔。收集对数生长期细胞,调整细胞悬液密度至5×104个/mL,96 孔板每孔接种100μL后,加入含不同浓度SF 的新鲜培养液80μL 培养48 h,每孔加入20μL MTT 溶液(5g/L,终浓度0.5g/L),细胞培养箱放置4h,吸弃孔内培养液后,每孔加入150μL DMSO,置摇床上低速振荡10min,使结晶物充分溶解。酶标仪490nm 处测定各孔的吸光度值(A490nm)。实验独立重复3 次。取三个孔的平均值,并计算各实验组对细胞生长的抑制率,抑制率=(1-A实验组/A对照组)×100%。
2.5.2 协同实验 试验分四组:空白对照组(不加SF)、SF 组(5μmol/L)、化疗药组和SF 联合化疗药组,培养体系除与上述抑制实验相同外,化疗药组中加入化疗药80μL/孔,SF 联合化疗药组中SF 和化疗药各加入40μL/孔,Hom 终浓度为0.025mg/L,抑制率为(20.3±7.1)%;Ara-c 终浓度为0.05mg/L,抑制率为(21.1±5.4)%。
2.6 统计学方法 应用SPSS13.0 软件进行统计分析,各组数据采用均数±标准差()表示,t 检验,P<0.05 为差异有统计学意义。
3 结果
3.1 SF 对HL-60 细胞株集落生长的抑制作用 SF对HL-60 细胞的集落生长的抑制作用呈浓度依赖性,10μmol/L SF 即显示轻度的抑制作用,集落数为(127.5±7.8)个,抑制率为(8.1±3.1)%,和对照组比较,P<0.05。当浓度增加至40μmol/L,其抑制作用更加明显,集落数为(36.5±4.2)个,抑制率为(74.1±9.0)%,明显少于对照组(P<0.01),见表1。
表1 SF 对HL-60 细胞集落的作用()
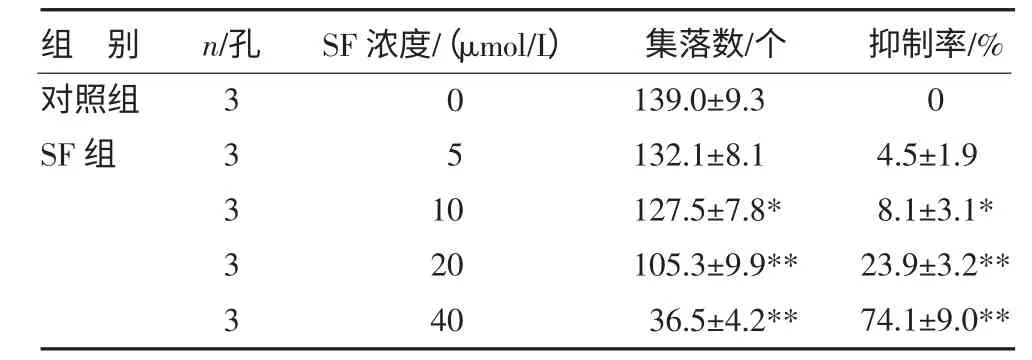
表1 SF 对HL-60 细胞集落的作用()
注:与对照组比较,*P<0.05,**P<0.01
3.2 SF 联合化疗药物对HL-60 的抑制作用 当SF与化疗药Hom 合用时,Hom 浓度不变(5μg/L),对HL-60 细胞的抑制与SF 呈剂量依赖关系,5μmol/L就可与Hom 起协同作用,集落数为(95.9±12.5)个,与单用相同浓度SF 的集落数(132.1±8.1)个比较,P<0.05,抑制率从(4.5±1.9)%升至(31.0±2.1)%,显著抑制HL-60 细胞集落的生成。随着SF 浓度的增加,抑制作用逐渐增强,当浓度增加至20μmol/L 时,集落数为(52.3±7.0)个,抑制率为(62.3±5.7)%。当不同浓度的SF 与化疗药Ara-c 合用时,对HL-60 细胞的抑制与SF 也呈剂量依赖关系。
以上结果提示SF 能够增强K562 和HL-60 细胞对化疗药物的敏感性,见表2~3。
3.3 PHA-LCM 液相-半固体二步培养SF 抑制人原代白血病细胞生长 SF 对人原代白血病细胞集落(CFU-AML)生长的抑制作用呈浓度依赖性,10μmol/L SF 就显示轻度的抑制作用,集落数为(88.5±29.3)个,抑制率为(35.6±14.5)%,与对照组的集落数(131.1±34.0)个相比较,P<0.05;当浓度增加至40μmol/L,其抑制作用更加明显,集落数为(46.9±26.7)个,抑制率为(68.6±22.3)%,明显少于对照组(P<0.01),见表4。
表2 SF 协同Hom 抑制HL-60 集落生成作用()
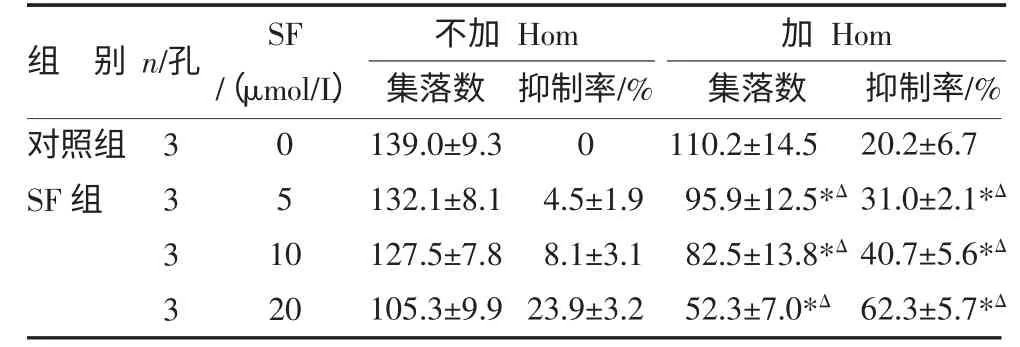
表2 SF 协同Hom 抑制HL-60 集落生成作用()
注:与对照组比较,*P<0.05;与对应SF 浓度组比较,ΔP<0.05
表3 SF 协同Ara-c 抑制HL-60 细胞集落生成作用()
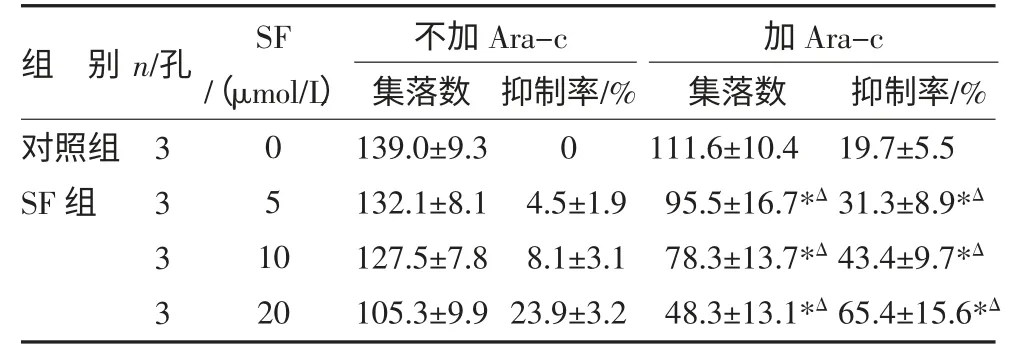
表3 SF 协同Ara-c 抑制HL-60 细胞集落生成作用()
注:与对照组比较,*P<0.05;与对应SF 浓度组比较,ΔP<0.05
表4 SF 对人原代白血病细胞集落的影响()
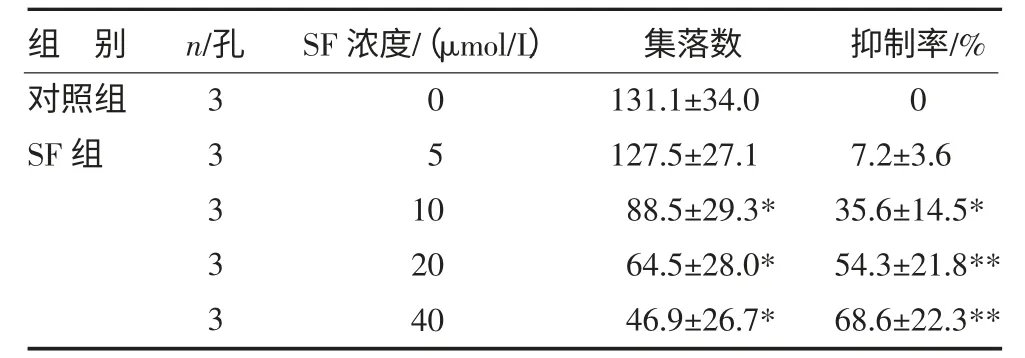
表4 SF 对人原代白血病细胞集落的影响()
注:与对照组比较,*P<0.05,**P<0.01
3.4 PHA-LCM 液相-半固体二步培养SF 协同化疗药抑制人原代白血病细胞生长 当SF 浓度为5μmol/L 时,和化疗药Hom 联合使用后,人原代白血病细胞集落(CFU-AML)集落数为(65.7±26.6)个,抑制率为(50.8±14.4)%,明显大于单用相同浓度SF 的(127.5±27.1)个和(7.2±3.6)%,P<0.05。随着SF 浓度增加,两药协同作用对CFU-AML 的影响越大,当SF浓度为40μmol/L 时,集落数为(2.8±2.6)个,抑制率为(97.4±2.8)%,见表5。
当SF 浓度为5μmol/L 时,和化疗药Ara-c 联合使用后,CFU-AML 集落数为(87.3±26.8)个,抑制率为(40.0±8.7)%,明显大于单用相同浓度SF 的(127.5±27.1)个和(7.2±3.6)%,P<0.05。随着SF 浓度增加,两药协同作用对CFU-AML 的影响越大,当SF浓度为40μmol/L 时,集落数为(3.9±3.2)个,抑制率为(96.4±4.2)%,见表6。
表5 SF 协同Hom 对人原代白血病细胞集落的影响() 个
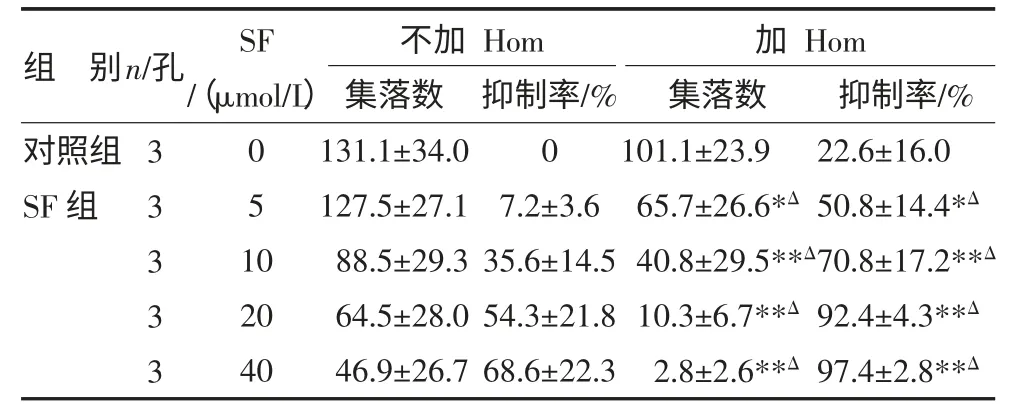
表5 SF 协同Hom 对人原代白血病细胞集落的影响() 个
注:与对照组比较,*P<0.05,**P<0.01;与对应SF 浓度组比较,ΔP<0.05
表6 SF 协同Ara-c 对人原代白血病细胞集落的影响() 个
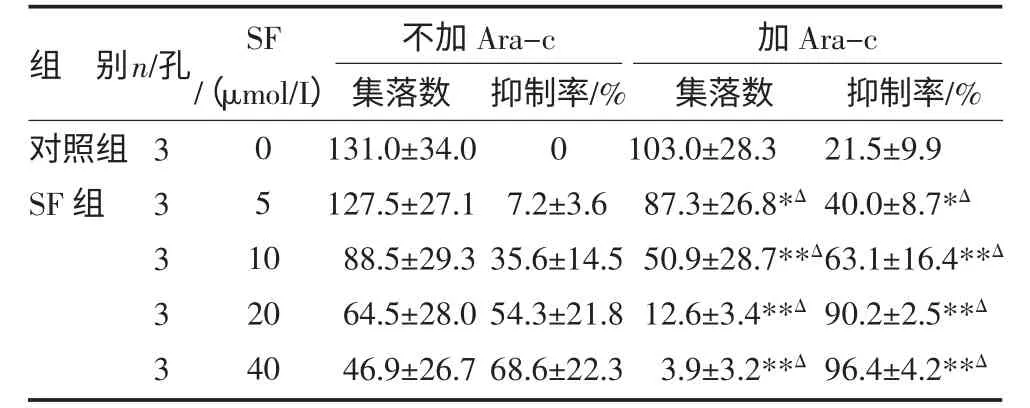
表6 SF 协同Ara-c 对人原代白血病细胞集落的影响() 个
注:与对照组比较,*P<0.05,**P<0.01;与对应SF 浓度组比较,ΔP<0.05
3.5 MTT 法培养SF 抑制HL-60 细胞增殖 MTT法检测到5μmol/L SF 时吸光度值为1.01±0.06,与对照组比较,P<0.05;40μmol/L SF 显示明显的HL-60细胞生长抑制,吸光度为0.26±0.03,与对照组比较,P<0.01,见表7。
表7 不同浓度SF 对HL-60 细胞的作用()
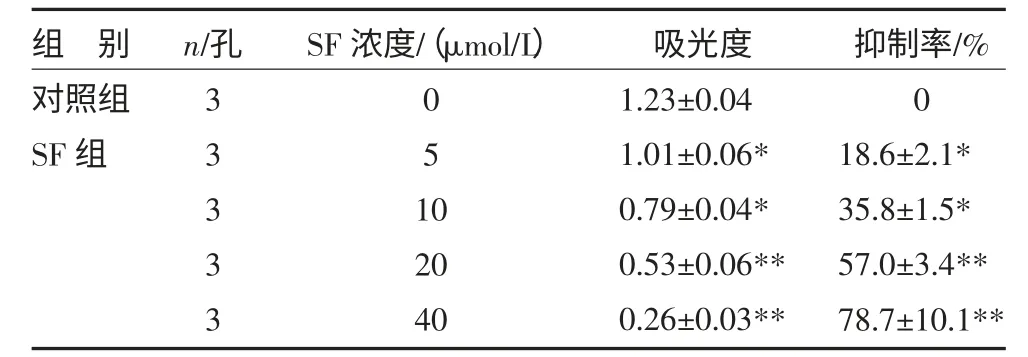
表7 不同浓度SF 对HL-60 细胞的作用()
注:与对照组比较,**P<0.05,**P<0.01
3.6 MTT 法检测SF 与化疗药的协同作用 以5μmol/L SF 和0.025mg/L 化疗药物Hom 合用,SF 能增强Hom 对HL-60 细胞的的杀伤作用,吸光度为0.59±0.09,明显小于空白对照组,抑制率为(59.3±7.6)%,P<0.01,见表8。
表8 SF 与Hom 对HL-60 细胞的协同杀伤作用()
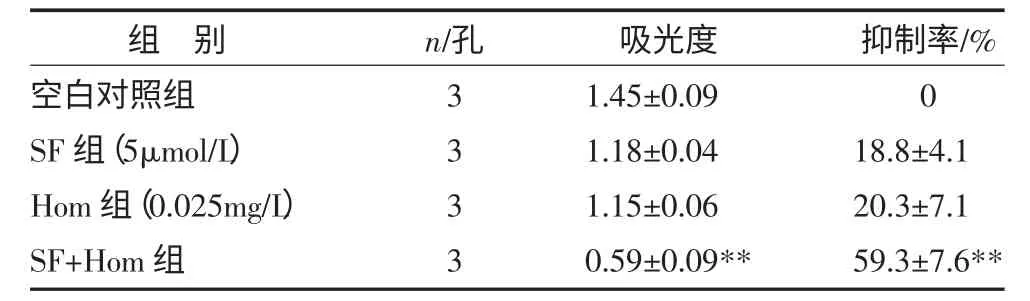
表8 SF 与Hom 对HL-60 细胞的协同杀伤作用()
注:与空白对照组比较,**P<0.01
以5μmol/L SF 和0.05mg/L 化疗药物Ara-c 合用,SF 能增强Ara-c 对HL-60 细胞的的杀伤作用,吸光度为0.51±0.08,明显小于空白对照组,抑制率为(62.2±8.5)%,P<0.01,见表9。
表9 SF 与Ara-c 对HL-60 细胞的协同杀伤作用()
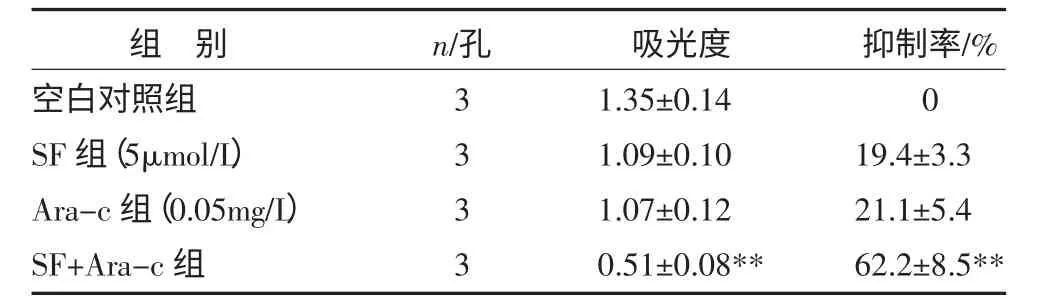
表9 SF 与Ara-c 对HL-60 细胞的协同杀伤作用()
注:与空白对照组比较,**P<0.01
4 讨论
萝卜硫素又称莱菔子素,就其化学成分而言,为异硫代氰酸盐衍生物,易溶于水,它是迄今为止蔬菜中发现的最强的抗癌成分。大量实验证明,萝卜硫素对食道癌、肺癌、结肠癌、乳腺癌、肝癌及大肠癌等有很好的防治效果[9-10]。其后也有学者报道[11],L-萝卜硫素对K562 和HL-60 细胞有诱导凋亡作用,但对于萝卜硫素增加白血病细胞对化疗药敏感性尚未有更多研究。
在过去的20 年中,白血病的完全缓解率和总生存率(OS)明显改善,但化疗药的毒副反应和耐药仍是治疗失败导致患者死亡的最主要原因。寻找一种既能提高化疗效果又安全可行的植物有效成分是现在抗白血病研究的热点。在本研究中,化疗药浓度保持不变,琼脂半固体培养和MTT 法均证实了萝卜硫素联合Hom 和Ara-c 比单用Hom 和Ara-c 对HL-60 白血病细胞抑制率明显增加(P<0.05),而且该实验使用人原代白血病细胞,也证实了此结果。
有文献报道[12],造血生长因子(G-CSF 和GMCSF)与化疗药物具有协同作用。因为白血病细胞能表达G-CSF 和GM-CSF 受体,造血生长因子与之结合后可促进细胞生长,从而诱导更多的白血病细胞进入周期细胞,使化疗药物的作用大大增强。临床上也证实同时使用造血生长因子(G-CSF 和GM-CSF)与化疗药,对白血病细胞的杀伤力确实比较大,治疗效果也比较好,比如CAG 方案。因此萝卜硫素联合化疗药能使患者的白血病细胞对化疗药敏感性增加,可能是通过促进细胞进入增殖周期所致。
本组结果提示,萝卜硫素能抑制白血病细胞增殖,并能增加化疗药Hom 和Ara-c 对白血病细胞的杀伤作用,具有协同作用,但是具体机制尚未研究。总之,萝卜硫素具有良好的开发应用前景,值得进一步开展临床研究。
[1]Joseph MA,Moysich KB,Freudenheim JL,et al.Cruciferolls vegetables,genetic polymorphisms in glutathione Stransferases M1 and T1,and prostate cancer risk[J].Nutrition and Cancer,2004,50(2):206-213.
[2]Graham PB,Yongping B,Gary W.Sulforaphane and its glutathione conjugate but not sulforaphane nitrile in-duceUDP-glucuronsyl transferase(UGT1A1)and glutathione transferase(GSTA1)in cultured cell[J].Carcinogenesis,2002,23(8):1399-1404.
[3]Srinibas D,Amrish KT,Harjit K.Cancer modulation by glucosinolates:a review[J].Current Science,2000,79(12):1665-1671.
[4]李志邈,曹家树.蔬菜的抗癌特性[J].北方园艺,2001,4:4-6.
[5]沈莲清,苏光耀,王奎武.西兰花种子中硫苷酶解产物萝卜硫素的提纯与抗肿瘤的体外试验研究[J].中国食品学报,2008,8(5):15-21.
[6]张之南.血液病诊断及疗效标准[S].第2 版.北京:科学出版社,1998:168-193.
[7]高瑞兰,金锦梅,马逢顺.急性髓细胞白血病集落生长的研究[J].浙江医学,1991,13(2):4-6.
[8]马逢顺,高瑞兰,金锦梅,等.白血病祖细胞集落形成及对高三尖杉酯碱和阿糖胞苷两药的敏感性测定[J].中华内科杂志,1989,28(12):737-740.
[9]Pham NA,Jacobberger JW,Schimmer AD,et al.The dietary isothiocyanate sulforaphane targets pathways of apoptosis,cell cycle arrest,and oxidative stress in human pancreatic cancer cells and inhibits tumor growth in severe combined immunodeficient mice[J].Molecular Cancer Therapeutics,2004,3(10):1239-1248.
[10]Misiewicz I,Skupinska K,Kasprzycka-Guttman T.Sulforaphane and 2-oxohexyl isothiocyanate induce cell growth arrest and apoptosis in L-1210 leukemia and ME-18 melanomacells[J].OncologyReports,2003,10(6):2045-2050.
[11]Rajendra Sharma,Abha Sharma,Pankaj Chaudhary,et al.Role of Lipid Peroxidation in Cellular Responses to D,LSulforaphane,A Promising Cancer Chemopreventive Agent[J].Biochemistry,2010,49(14):3191-3202.
[12]Li J M,Shen Y,Wu DP,et al.A clarubicin and low-dose Cyto sine arabinoside in combination with granulocyte colony-stimulating factor in treating acute myeloid leukemia patients with relapsed or refractory disease and myelody splastic syndrome:a multicenter study of 112 chinese patients[J].Int J Hematol,2005,82:48-54.

