选择性环氧化酶2抑制剂NS-398对胃癌细胞AGS增殖的抑制作用
胡孙宽,周 琴,林铁素,杨云秀,潘钰婷,陈必成,金 嵘
(温州医学院附属第一医院1.消化内科,2.肝胆胰外科,4.流行病学教研室,浙江温州 325000;3.九江市第一人民医院ICU,江西九江 332000)
由于目前无有效的方法发现早期胃癌,绝大多数胃癌发现时已进入进展期,而进展期胃癌预后差,故急需新颖的有效的治疗方案。Notch信号通路被认为在维持干细胞和祖细胞种群在细胞增殖、分化和凋亡中的平衡有重要的作用[1]。同时在多种肿瘤形成过程中,Notch信号通路也起着重要作用[2-3]。抑制Notch信号通路能抑制胃癌细胞增殖[4]。但是,Notch信号通路在胃癌形成过程中的调节机制仍尚未明了。已有研究表明,胃癌中环氧化酶(cyclooxygenase-2,COX-2)表达明显升高,是胃癌不良预后一个独立因素[5]。COX-2抑制剂诱导胃癌细胞凋亡,并呈剂量依赖性地抑制裸鼠胃癌的生长[6]。但是COX-2抑制剂诱导胃癌细胞凋亡的机制并未完全清楚。前期研究表明,COX-2和Notch细胞内结构域(Notch intracellular domain,NICD)在胃癌中表达呈正相关[7]。为此,本研究通过COX-2抑制剂 NS-398与胃癌细胞 AGS共培养,检测AGS细胞的增殖、凋亡和Notch信号通路相关基因的表达,并探讨NS-398诱导AGS细胞凋亡的机制,为胃癌基因靶向治疗提供理论基础。
1 材料与方法
1.1 主要试剂和仪器
NS-398购自碧云天生物技术研究所;F12培养基、青霉素、链霉素和Trizol购自Gibco BRL公司;胎牛血清购自Hyclone公司;CCK-8试剂盒购自日本株式会社同仁化学研究所。DMSO,AnnexinⅤ-FITC/PI双染法细胞凋亡检测试剂盒和胰蛋白酶为Sigma公司产品;PCR引物(表1)由上海基康生物技术有限公司设计合成;逆转录试剂盒购自Fermentas公司;SYBR Green实时荧光定量PCR试剂盒购自ABI公司;兔抗人NICD抗体和PVDF膜购自Millipore公司;兔抗人毛蛋白和断裂1增强子(hairy and enhancer of split 1,Hes-1)抗体购自Abcam公司;兔抗人NF-κB抗体购自Cell Signaling公司;兔抗人GAPDH抗体购自杭州贤至生物技术有限公司;辣根过氧化物酶标记的二抗羊抗兔IgG抗体购自北京中杉金桥生物技术有限公司;蛋白质定量试剂盒和电化学发光试剂盒为美国Pierce公司产品;X线胶片为日本柯达公司产品;其他试剂为国产分析纯。ELX800酶标仪为 Bio-Tek产品;ABI7500实时荧光定量PCR仪为ABI公司产品。

Tab.1 Primers used for real-time PCR
1.2 细胞培养和药物配制
胃癌细胞AGS购自中国科学院上海细胞库,培养基为含10%的胎牛血清、青霉素100 U·L-1和链霉素100 μg·L-1的 F12 培养基,培养在37℃,5%CO2孵箱中。2 d换液1次,3 d传代1次。NS-398用DMSO溶解,配制成50 mmol·L-1。储存在 -80℃冰箱。用无血清F12培养基稀释成所需的工作浓度。
1.3 CCK-8 法检测细胞存活率
取对数生长期的AGS细胞,胰酶消化后,调整成8 ×107L-1,接种于96 孔培养板中,每孔加100 μl,常规培养过夜,细胞贴壁后,换无血清F12培养基培养24 h,加入不同浓度的 NS-398,使终浓度为25,50和100 μmol·L-1,并设置细胞对照组(不加药物)和空白对照组(只加培养基不加细胞),每组设3个复孔。分别培养12,24和48 h后,每孔加入CCK-810 μl,2 h后用酶标仪上在波长450 nm处检测各孔吸光度(A)值。实验重复3次。胃癌细胞存活率(%)=(实验组A450nm-空白对照组A450nm)/(细胞对照组A450nm-空白对照组A450nm)×100%。
1.4 流式细胞术检测细胞凋亡率
同样取对数生长期的细胞,调整细胞密度为2×108L-1,接种于6孔培养板中。药物处理和实验分组同上。药物作用48 h后,收集细胞,按照AnnexinⅤ-FITC/PI双染法细胞凋亡检测试剂盒说明书,用流式细胞仪检测细胞凋亡率。
1.5 实时荧光定量PCR检测Notch信号通路相关基因的表达
取对数生长期的细胞,接种于6孔培养板,加入NS-39850 μmol·L-1(终浓度)作用 24 h,提取总RNA。按逆转录试剂盒说明书逆转录成cDNA。荧光实时定量PCR步骤参照ABI说明书进行,反应体系共20 μl,其中 cDNA 1 μl,上下游引物各2 μl,PCR Master Mix 10 μl,去酶水 5 μl。目的基因的相对表达水平由目的基因的2-ΔΔCt/GAPDH 的2-ΔΔCt比值表示。
1.6 Western印迹法检测Notch信号通路相关蛋白的表达
取对数生长期细胞,接种于6孔培养板,与NS-39850 μmol·L-1作用48 h,用RIPA裂解液裂解细胞,提取总蛋白。BCA法检测蛋白质浓度。常规SDS-聚丙烯酰胺凝胶电泳后,转至PVDF膜上。5%脱脂牛奶封闭后,加入一抗孵育(抗 NICD:1∶500,抗 Hes-1:1∶1000,抗 NF-κB2:1∶1000,抗GAPDH:1∶500),PBS 清洗后二抗孵育,ECL 发光,暗室X线胶片曝光。扫描胶片后,使用Image J图像分析软件测定蛋白条带积分吸光度(integrated absorbance,IA),待测蛋白相对表达水平用IA目标蛋白/IAGAPDH比值表示。
1.7 统计学分析
2 结果
2.1 NS-398对AGS细胞增殖的抑制作用
由图1看出,随着药物浓度的增加和作用时间的延长,NS-398对AGS细胞增殖的抑制作用明显增强,并呈时间和浓度依赖性(图1)。对48 h不同浓度25,50和100 μmol·L-1(x)和存活率(y)进行回归分析,得到回归方程 y=-0.537x+77.55(r浓度=-0.999,P=0.027),根据此公式可得 48 h的 IC50为51.34 μmol·L-1。对 NS-39850 μmol·L-1与AGS细胞作用12,24和48 h(x)和存活率(y)进行回归分析,得回归方程 y=-1.30x+111.92(r时间=-1.00,P=0.003)。
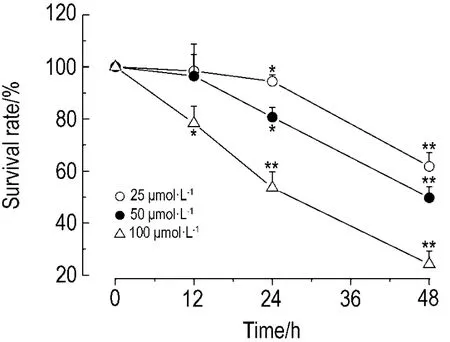
Fig.1 Effect of NS-398 on AGS cell survival.AGS cells were treated with NS-398 and measured by CCK-8 assay.±s,n=3.*P<0.05,**P<0.01,compared with normal control(0)group.
2.2 NS-398对AGS细胞凋亡的影响
流式细胞术结果显示,正常对照组早期凋亡右下象限为(3.5±1.4)%,NS-39850 μmol·L-1作用于AGS细胞48 h后,细胞早期凋亡率明显升高,达到(20.1±3.5)%(n=3,P<0.05)(图2)。

Fig.2 Effect of NS-398 on apoptosis of AGS cells detected with flow cytometry.AGS cells were cultured with NS-39850 μmol·L-1for 48 h.A:normal control;B:NS-39850 μmol·L-1.
2.3 NS-398对AGS细胞Notch信号通路相关基因mRNA表达的影响

Fig.3 Effect of NS-398 on mRNA expression of some genes related to Notch signal transduction in AGS cells.AGS cells were cultured with NS-39850 μmol·L -1for 24 h.mRNA expression was determined with real-time PCR and expressed as the ratio of 2-ΔΔCtof target gene/2-ΔΔCtof GAPDH.±s,n=3.*P<0.05,**P<0.01,compared with normal control group.
如图3所示,NS-39850 μmol·L-1作用24 h,NF-κB2 mRNA 表达显著低于对照组(t=5.08,P=0.007)Hes-1 mRNA 表 达 显 著 低 于 对 照 组(t=3.4,P=0.027)。Notch 信号通路的配体锯齿状 1(jagged-1,JAG1)和 δ 样 1(delta-like 1,DLL1)及Notch信号通路的受体Notch1和Notch2 mRNA表达未发现明显的变化。
2.4 NS-398对AGS细胞 NICD蛋白表达的影响
NS-39850 μmol·L-1与 AGS 细胞作用 48 h,NICD,NF-κB2和Hes-1蛋白表达明显低于对照组(P<0.05)(图4)。
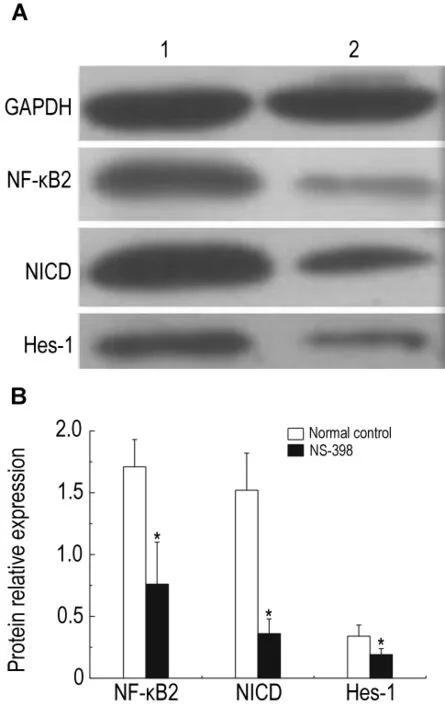
Fig.4 Effect of NS-398 on expression of NF-κB2,NICD and Hes-1 in AGS cells.AGS cells were cultured with NS-39850 μmo·lL-1for 48 h.The protein expression was measured with Western blotting(A)and expressed as the ratio of integrated absorbance of target protein/ingegated absorbance of GAPDH(B).Lane 1,normal control;lane 2,NS-398 group.±s,n=3.*P<0.05,compared with normal control group.
3 讨论
COX是前列腺素合成过程中非常重要的限速酶。COX-2是一种诱导酶,在正常生理条件下检测不到其表达,只有当受到相应的刺激时才开始合成。以前认为COX-2与炎症的发生密切相关,目前认为COX-2和肿瘤的发生也密切相关,其中包括胃癌。我们的前期研究已表明,COX-2表达增加与胃癌细胞分化、浸润和转移密切相关,COX-2也可反映胃癌的恶性程度并提示胃癌患者的预后[7]。
Notch信号通路在胃癌的发生发展中起着重要作用[9],主要是通过下游靶基因产生生物学作用。下游的靶基因中,最为典型的靶基因为Hes和Hes相关的家族,该基因转而调节下游基因的表达[10],如Hes-1表达减少能够促进细胞周期依赖蛋白CDKN1C/P57的表达从而促进细胞衰老[11],同时NF-κB也被证实是 Notch1 信号通路的靶基因[12]。通过用γ-分泌酶抑制剂(阻断Notch受体激活的药物)阻断Notch信号通路,能够减少结肠癌对奥沙利铂(oxaliplatin)的耐药性,从而促进奥沙利铂对结肠癌的疗效[10]。抑制Notch信号通路能下调抗凋亡基因bcl-2表达,上调bax表达[13],并且认为抑制Notch信号通路能够促进P21的表达,减少周期蛋白A的表达[14],提示抑制Notch信号通路能够促进细胞凋亡的发生。因此,通过抑制Notch信号通路来抑制胃癌细胞的增殖可能成为治疗胃癌的有效方法。本研究结果表明,NS-398可使AGS细胞NICD表达明显减少,提示Notch信号通路受到明显的抑制,NS-398抑制胃癌细胞增殖可能与Notch信号通路的抑制有关。
NF-κB2作为Notch信号通路的靶基因,具有抗细胞凋亡功能,涉及多个信号通路,过程复杂,主要通过上调或者诱导抗凋亡基因的表达而实现[15]。由于这些基因调节点上有NF-κB的结合位点,其表达产物通过抑制细胞凋亡的线粒体途径或者死亡受体途径发挥作用[16]。本研究结果表明,NS-398可使胃癌细胞AGS NF-κB2表达明显减少,提示可能通过该途径促进了胃癌细胞的凋亡。据报道,COX-2抑制剂治疗癌症所需的剂量比减少COX-2酶激活的剂量要少很多,从而推测该抑制剂的激活可能有多个模式[17]。曾有研究认为,抑制COX-2主要通过抑制前列腺素的合成而阻止其生物学作用。随后研究报道,COX-2抑制剂能通过 Fas介导的途径调节PTEN-AKt通路而诱导胃癌细胞凋亡[18]。本研究结果表明,NS-398能有效地抑制胃癌细胞AGS增殖,明显减少Notch靶基因Hes-1和NF-κB2 mRNA的表达,但并不影响Notch信号的配体(DLL1和JAG1)及受体(Notch1和Notch2)mRNA的变化。Western印迹实验结果表明,NS-398能减少NICD,Hes-1和NF-κB2蛋白的表达。综合上述结果提示,NS-398可能部分通过抑制 NICD的表达来阻断Notch信号通路,减少其靶基因Hes-1和NF-κB2的表达,进而抑制AGS细胞增殖,促进AGS细胞凋亡。
[1]Parkin DM,Bray F,Ferlay J,Pisani P.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2]Schroeter EH,Kisslinger JA,Kopan R.Notch-1 signalling requires ligand-induced proteolytic release of intracellular domain[J].Nature,1998,393(6683):382-386.
[3]Stockhausen MT,Kristoffersen K,Poulsen HS.Notch signaling and brain tumors[J].Adv Exp Med Biol,2012,727:289-304.
[4]Reedijk M.Notch signaling and breast cancer[J].Adv Exp Med Biol,2012,727:241 -257.
[5]Sun HW, Wu C, Tan HY, Wang QS.Combination DLL4 with Jagged1-siRNA can enhance inhibition of the proliferation and invasiveness activity of human gastric carcinoma by Notch1/VEGF pathway[J].Hepatogastroenterology,2012,59(115):924-929.
[6]Thiel A, Mrena J, Ristimäki A. Cyclooxygenase-2 and gastric cancer[J].Cancer Metastasis Rev,2011,30(3-4):387-395.
[7]Sawaoka H,Kawano S,Tsuji S,Tsujii M,Gunawan ES,Takei Y,et al.Cyclooxygenase-2 inhibitors suppress the growth of gastric cancer xenografts via induction of apoptosis in nude mice[J].Am J Physiol,1998,274(6 Pt 1):G1061-G1067.
[8]Sun GY, Luo DH, Hu JS, Pan YT,Jin R,Ma SG,et al.The expression of NICD and COX-2 in gastric carcinoma tissues and its clinical biological significance[J].J Med Res(医学研究杂志),2011,40(3):61-66.
[9]Wu WK, Cho CH, Lee CW, Fan D,Wu K,Yu J,et al.Dysregulation of cellular signaling in gastric cancer[J].Cancer Lett,2010,295(2):144-153.
[10]Meng RD,Shelton CC,Li YM,Qin LX,Notterman D,Paty PB,et al.gamma-Secretase inhibitors abrogate oxaliplatin-induced activation of the Notch-1 signaling pathway in colon cancer cells resulting in enhanced chemosensitivity[J].Cancer Res,2009,69(2):573-582.
[11]Giovannini C, Gramantieri L, Minguzzi M, Fornari F,Chieco P,Grazi GL,et al.CDKN1C/P57 is regulated by the Notch target gene Hes1 and induces senescence in human hepatocellular carcinoma[J].Am J Pathol,2012,181(2):413-422.
[12]Oswald F,Liptay S,Adler G,Schmid RM.NF-kappaB2 is a putative target gene of activated Notch-1 via RBP-Jkappa[J].Mol Cell Biol,1998,18(4):2077-2088.
[13]Ye QF,Zhang YC,Peng XQ,Long Z,Ming YZ,He LY.Silencing Notch-1 induces apoptosis and increases the chemosensitivity of prostate cancer cells to docetaxel through Bcl-2 and Bax[J].Oncol Lett,2012,3(4):879-884.
[14]Mori M,Miyamoto T,Yakushiji H,Ohno S,Miyake Y,Sakaguchi T,et al.Effects of N-[N-(3,5-difluorophenacetyl-L-alanyl)]-S-phenylglycine t-butyl ester(DAPT)on cell proliferation and apoptosis in Ishikawa endometrial cancer cells[J].Hum Cell,2012,25(1):9-15.
[15]Kucharczak J,Simmons MJ,Fan Y,Gélinas C.To be,or not to be:NF-kappaB is the answer-role of Rel/NF-kappaB in the regulation of apoptosis[J].Oncogene,2003,22(56):8961-8982.
[16]Senftleben U,Cao Y,Xiao G,Greten FR,Krähn G,Bonizzi G,et al.Activation by IKKalpha of a second,evolutionary conserved,NF-kappa B signaling pathway[J].Science,2001,293(5534):1495-1499.
[17]Norrish AE, Jackson RT, McRae CU. Non-steroidal anti-inflammatory drugs and prostate cancer progression[J].Int J Cancer,1998,77(4):511-515.
[18]Honjo S,Osaki M,Ardyanto TD,Hiramatsu T,Maeta N,Ito H.COX-2 inhibitor,NS398,enhances Fas-mediated apoptosis via modulation of the PTEN-Akt pathway in human gastric carcinoma cell lines[J].DNA Cell Biol,2005,24(3):141-147.

