ErbB4基因miRNA慢病毒载体的构建及其在小鼠海马齿状回的表达
李树玲,颜 慧,宫泽辉
(1.军事医学科学院毒物药物研究所新药评价研究室,北京 100850;2.北京军区总医院中心实验科,北京 100700)
近年来,精神分裂症的易感基因的鉴定及其功能研究大大推进了对精神分裂症病理机制的理解。神经调节素1(neuregulin 1,Nrg1)及其受体ErbB4的编码基因均是精神分裂症的易感基因[1-2]。Nrg1是一类含表皮生长因子(epidermal growth factor,EGF)结构域的营养因子家族的一员,通过激活ErbB酪氨酸激酶发挥作用[1]。研究发现精神分裂症患者脑内Nrg1/ErbB4信号转导增强[3]。发育过程中,Nrg1/ErbB4信号转导在γ-氨基丁酸能中间神经元兴奋性突触及投射细胞抑制性突触的形成中发挥作用[4-5]。Nrg1和 ErbB4也表达于成年脑中,通过促进γ-氨基丁酸释放来控制锥体神经元放电和抑制长时程增强[6-8]。另外,ErbB4也高表达于多巴胺能神经元中[9-10]。Nrg1和ErbB4等位基因或条件敲除鼠表现出活动过度、潜伏抑制受损和工作记忆缺陷等精神分裂样症状[7,11]。
尽管近年对Nrg1和ErbB4受体功能的研究进展令人振奋,但该信号系统的许多关键性问题依然不清楚,甚至有部分研究得出了相互矛盾的实验结果。研究Nrg1或ErbB4突变小鼠中Nrg1对神经传递的影响表明,Nrg1/ErbB4信号通路的改变可能导致已经异常发育的成熟大脑突触可塑性调节紊乱。在空间和时间上控制Nrg1/ErbB信号转导以分离发育和发育后机制建立的动物模型将推动未来的研究[1]。
为寻求ErbB4特异性调控手段,前期实验中构建了含绿色荧光蛋白(green fluorescent protein,GFP)标签的大鼠ErbB4基因特异性miRNA质粒,对靶基因表达的抑制率可达70%以上[12]。为实现在活体神经元中的持续调控,将前期实验所获得的miRNA干扰序列构建入慢病毒表达质粒,并包装浓缩获得高滴度慢病毒浓缩液,将所得慢病毒浓缩液经立体定位微量注射感染小鼠海马齿状回,并在感染6个月后观察基因表达情况,为后续ErbB4功能研究提供实验基础。
1 材料与方法
1.1 质粒、菌株和细胞
基于 pcDNA6.2-GW/EmGFP-miR(Invitrogen公司,美国)的含有ErbB4基因特异性miRNA序列的pMir32质粒由本实验室前期构建。供体质粒pDONR221,目的载体 pLenti6.3/V5-DEST,大肠杆菌菌株Stbl3和人胚肾细胞 HEK293T(Invitrogen公司,美国)。
1.2 实验动物、主要试剂和仪器
BALB/c成年小鼠,雄性,体质量18~22 g,购自军事医学科学院实验动物中心,动物质量合格证号:SCXK-[军]2007-004。
内切酶EagⅠ(NEB公司,美国);BP clonaseⅡ、LR clonaseⅡ、蛋白酶K、慢病毒包装系统(含pLP1,pLP2和pLP/VSVG质粒等)、脂质体Lipofectamine 2000、DMEM培养基和胎牛血清(Invitrogen公司,美国);聚凝胺(Sigma公司,美国);组织包埋剂Tissue-Tek® OCT(Sakura公司,美国);小鼠抗神经元核(neuronal nuclei,NeuN)抗原单克隆抗体;小鼠抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)单克隆抗体(Santa Cruz公司,美国);红色荧光素Tritc标记的山羊抗小鼠IgG抗体(中杉金桥生物技术有限公司)。
双臂小动物脑立体定位仪(Stoelting公司,美国);超微注射泵(WPI公司,美国);CM1850型冷冻切片机(Leica公司,德国);EVOS fl数码荧光显微镜(AMG公司,美国);LSM 510激光共聚焦显微镜(Carl Zeiss公司,德国)。
1.3 慢病毒载体构建
用Gateway重组技术以筛选出的干扰质粒pMir32构建慢病毒表达载体,步骤如下。将pMir32质粒进行EagⅠ酶切后,加入pDONR221质粒和BP clonaseⅡ酶,室温孵育过夜,以行BP重组,产生入门克隆。取其产物加入 pLenti6.3/V5-DEST质粒和LR clonaseⅡ酶,25℃反应5 h,以行LR重组,产生表达克隆。重组反应液加入蛋白酶K,37℃反应10 min后取 5 μl重组反应液转化 100 μl的stbl3感受态细胞,氨苄西林抗性筛选,测序验证质粒插入片段是否正确,摇菌扩增质粒。
1.4 慢病毒包装
取状态良好、处于对数生长期的HEK 293T细胞,细胞计数后接种于100 mm培养皿中培养过夜,以第2天转染时细胞均匀且融合度90%左右为最佳。取慢病毒表达质粒和慢病毒包装系统以1∶3的比例混合用脂质体Lipofectamine 2000按照说明书操作进行质粒转染。孵育6 h后,更换为含10%胎牛血清完全培养液 DMEM;转染换液24和48 h后,分别收集培养上清。将收集到的病毒原液混合均匀后,4℃,3000 ×g 离心 30 min,上清用0.45 μm的滤器过滤得慢病毒原液后50000×g,4℃超速离心2 h,沉淀溶解在含有2%胎牛血清的DMEM中,分装,-80℃保存,并留样进行滴度测定。
1.5 慢病毒活性滴度测定
实验第1天选取状态良好的HEK293T细胞以每孔8×106个细胞接种6孔板。第2天慢病毒浓缩液用培养基以10倍倍比稀释后,分别感染HEK293T细胞,并加入聚凝胺 8 mg·L-1,孵育过夜。同时消化空白对照孔,细胞计数。第3天细胞换液,继续培养。慢病毒感染细胞72 h后,在荧光显微镜下观察各孔细胞GFP表达情况。收集细胞PBS洗1次后,用1%的多聚甲醛固定细胞,流式细胞仪检测GFP表达阳性比例。以GFP表达率在1%~30%间的稀释孔按下列公式计算病毒滴度[13]:病毒滴度=病毒感染时细胞数量×GFP表达阳性细胞比例×病毒稀释倍数/接种体积。
1.6 慢病毒对活体小鼠海马齿状回的感染及转导情况观察[14]
BALB/c成年小鼠ip给予水合氯醛150 mg·kg-1和乌拉坦1125 mg·kg-1麻醉,固定于立体定位仪上。以横纵坐标定位前囟,进而参照小鼠脑立体定位图谱确定齿状回的位置:前囟后2.0 mm,前囟侧1.6 mm,颅骨面下2.6 mm。以超微注射泵控制以0.2 μ·lmin-1的速度在每侧注射1 μl慢病毒浓缩液并留针5 min。BALB/c小鼠在慢病毒注射6个月后,ip给予戊巴比妥钠60 mg·kg-1麻醉,心脏灌流后取脑,4%多聚甲醛固定24 h,30%蔗糖沉底,以40 μm厚度行冠状面冰冻切片。荧光显微镜下观察荧光表达情况。
1.7 慢病毒转导细胞类型检测
脑片以0.2%Triton,5%BSA封闭1 h后,分别以小鼠抗NeuN抗体(1∶100)和小鼠抗GFAP抗体(1∶50)4℃孵育过夜;Tritc标记的山羊抗小鼠IgG抗体(1∶100)室温孵育2 h后,以 DAPI(1∶5000)染核10 min,封片,激光共聚焦显微镜观察、扫描成像。
2 结果
2.1 构建的慢病毒载体
含有ErbB4基因特异性miRNA序列的pMir32质粒经Gateway重组后所得克隆测序显示质粒插入片段与设计一致(图1),提示片段正确插入,目的慢病毒载体 pLenti6/V5-GW/EmGFP-ErbB4-miR构建成功。

Fig.1 Sequence of lentivirus vector pLenti6/V5-GW/EmGFP-ErbB4-miR.
2.2 慢病毒在HEK293T细胞中的包装
将以上慢病毒表达质粒和慢病毒包装系统共转染HEK293T细胞,在荧光显微镜下观察到报告基因GFP的显著表达(图2)。收集培养上清,过滤并浓缩培养上清,得慢病毒浓缩液。

Fig.2 Fluorescent observation of lentivirus packaging in HEK293T cells 24 h after transfection.The green fluorescent protein(GFP)expression showing the successfully lentivirus packaging.
2.3 慢病毒活性滴度
空白对照孔HEK293T细胞计数为1.826×106个细胞。10倍梯度稀释的慢病毒浓缩液各取20 μl分别感染HEK293T细胞72 h后,流式细胞仪计数显示100倍稀释孔中GFP的表达率为10.68%(图3),计算得病毒活性滴度为1.0×1012转导单位(transduction units,TU)·L-1。

Fig.3 Titer of lentivirus stock 72 h post-transduction in HEK293T cells determined with flow cytometry.A:mock-transduced cells;B:10 -2-fold lentivirus stock-transduced cells.
2.4 慢病毒在活体小鼠脑组织的表达
由图4所示,小鼠在海马齿状回定位注射慢病毒浓缩液1.0×1012TU·L-16个月后,脑冰冻切片荧光观察显示,外源基因主要在注射部位即海马齿状回表达,细胞胞体及其投射的神经纤维均被GFP标记,提示慢病毒对所注射部位的长期稳定转导。

Fig.4 Expression of lentivirus on hippocampus dentate gyrus in mice 6 months after transduction with lentivirus 1.0 × 1012transduction unit·L-1.Green fluorescence showing the expression of lentivirus.
2.5 慢病毒转导的细胞类型
免疫荧光染色显示,慢病毒转导的细胞即GFP阳性细胞多呈NeuN抗体标记阳性,并与GFAP的表达不重叠,提示慢病毒转导的细胞类型主要为神经元(图5)。有一部分颗粒细胞下层区域的GFP阳性细胞没有与NeuN共标记,由于慢病毒可以感染非分裂细胞和分裂细胞,推测这一部分GFP阳性细胞可能是神经干细胞和神经前体细胞。
3 讨论
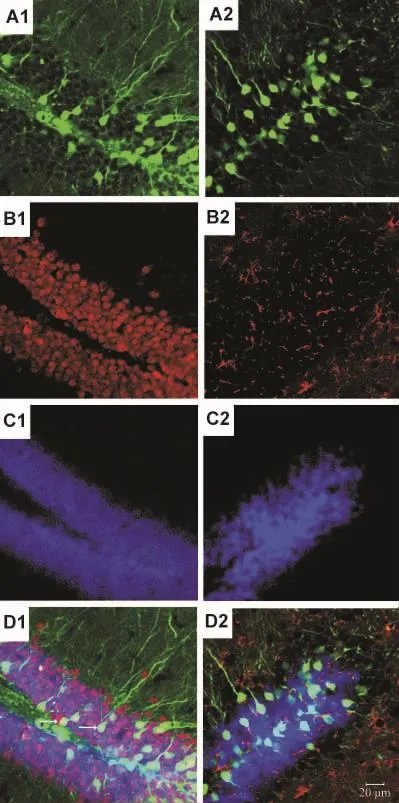
Fig.5 Primary cell type transduced by lentivirus is neurons.Confocalimmunofluorescence microscopy images of hippocampal dentate gyrus sections from lentivirus-injected mice.GFP as a reporter was used to track lentivirus mediated expression(A1 and A2).Immunofluorescence stainings with antibodies specific for neuronal marker neuronal nuclei(NeuN)(B1)and astrocytesmarkerglialfibrillary acidic protein (B2)were performed.Nuclei were stained by DAPI(C1 and C2).Merged imagewasalsoshown(D1andD2).Arrowspointto colocalization of GFP fluorescence with NeuN(D1).
Nrg1/ErbB4信号转导调控神经系统的发育和可塑性,在精神分裂症的发生发展中起重要作用[1-2,4-5]。为寻求 ErbB4 特异性调控手段,前期实验构建了大鼠ErbB4基因特异性miRNA质粒,获得了理想的干扰效率。通过RNAi成功地抑制目的基因的表达不仅需要高效特异性地靶向目标基因的干扰序列,还需要合适的基因传递方法。传递的方法因细胞种类和实验要求不同而异。为实现在体神经元的长期稳定表达,本研究采用了慢病毒载体系统。慢病毒是逆转录病毒的一种,既可感染分裂细胞,也可用于感染依靠传统转染方法难以转染的细胞如原代细胞、悬浮细胞和处于非分裂状态的细胞,并且在感染后可以整合到受感染细胞的基因组,实现长期稳定表达,复制缺陷型载体的使用使被转导细胞不产生触发细胞免疫反应的病毒蛋白,作为哺乳动物体内基因传递的手段非常适用于长期体内实验研究[15]。并且慢病毒还可用于基因敲除、基因治疗和转基因动物研究。
本研究在慢病毒微注射6个月后仍观察到了与miRNA同顺反子表达的GFP的表达,表明慢病毒介导的有效基因传递和长期外源基因表达,说明慢病毒可以作为体内长效实验的工具。本研究构建的ErbB4基因miRNA慢病毒载体及慢病毒包装所得高滴度慢病毒浓缩液为ErbB4的长期功能研究提供了手段。
[1]Mei L,Xiong WC.Neuregulin 1 in neural development,synaptic plasticity and schizophrenia[J].Nat Rev Neurosci,2008,9(6):437-452.
[2]Buonanno A.The neuregulin signaling pathway and schizophrenia:from genes to synapses and neural circuits[J].Brain Res Bull,2010,83(3-4):122-131.
[3]Hahn CG, Wang HY, Cho DS, Talbot K,Gur RE,Berrettini WH,et al.Altered neuregulin 1-erbB4 signaling contributes to NMDA receptor hypofunction in schizophrenia[J].Nat Med,2006,12(7):824-828.
[4]Fazzari P,Paternain AV,Valiente M,Pla R,Luján R,Lloyd K,et al.Control of cortical GABA circuitry development by Nrg1 and ErbB4 signalling[J].Nature,2010,464(7293):1376-1380.
[5]Ting AK,Chen Y,Wen L,Yin DM,Shen C,Tao Y,et al.Neuregulin 1 promotes excitatory synapse development and function in GABAergic interneurons[J].J Neurosci,2011,31(1):15-25.
[6]Chen YJ,Zhang M,Yin DM,Wen L,Ting A,Wang P,et al.ErbB4 in parvalbumin-positive interneurons is critical for neuregulin 1 regulation of long-term potentiation[J].Proc Natl Acad Sci USA,2010,107(50):21818-21823.
[7]Wen L,Lu YS,Zhu XH,Li XM,Woo RS,Chen YJ,et al.Neuregulin 1 regulates pyramidal neuron activity via ErbB4 in parvalbumin-positive interneurons[J].Proc Natl Acad Sci USA,2010,107(3):1211-1216.
[8]Woo RS,Li XM,Tao Y,Carpenter-Hyland E,Huang YZ,Weber J, etal. Neuregulin-1 enhancesdepolarizationinduced GABA release[J].Neuron,2007,54(4):599-610.
[9]Abe Y,Namba H,Zheng Y,Nawa H.In situ hybridization revealsdevelopmentalregulation ofErbB1-4 mRNA expression in mouse midbrain:implication of ErbB receptors for dopaminergic neurons[J].Neuroscience,2009,161(1):95-110.
[10]Zheng Y,Watakabe A,Takada M,Kakita A,Namba H,Takahashi H,et al.Expression of ErbB4 in substantia nigra dopamine neurons of monkeys and humans[J].Prog Neuropsychopharmacol Biol Psychiatry,2009,33(4):701-706.
[11]Gerlai R,Pisacane P,Erickson S.Heregulin,but not ErbB2 or ErbB3,heterozygous mutant mice exhibit hyperactivity in multiple behavioral tasks[J].Behav Brain Res,2000,109(2):219-227.
[12]Li SL,Yan H,Gong ZH.Construction of miRNA RNAi expression vectors targeting ErbB4 and validation their sup-pression effects[J].Mil Med Sci(军事医学),2012,36(4):258-262.
[13]Sastry L,Johnson T,Hobson MJ,Smucker B,Cornetta K.Titering lentiviral vectors:comparison of DNA,RNA and marker expression methods[J].Gene Ther,2002,9(17):1155-1162.
[14]Li YF, Cheng YF, Huang Y, Conti M, Wilson SP,O'Donnell JM,et al. Phosphodiesterase-4D knock-out and RNA interference-mediated knock-down enhance memory and increase hippocampal neurogenesis via increased cAMP signaling[J].J Neurosci,2011,31(1):172-183.
[15]Naldini L,Blömer U,Gallay P,Ory D,Mulligan R,Gage FH,et al.In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector[J].Science,1996,272(5259):263-267.

