猪圆环病毒2型ORF1和ORF3 T淋巴细胞抗原表位的克隆与原核表达
高 娟,王艳玲,蒋再学,竺 薇,罗满林
(华南农业大学兽医学院,广东 广州 510642)
猪圆环病毒感染已经成为严重危害世界养猪业的一种重要传染病.该病于2001年在我国首次发现,目前在猪群中广泛流行.猪圆环病毒(Porcine circovirus,PCV)有2个血清型,即 PCV1和 PCV2.PCV2对猪的危害极大,可引起一系列相关的临床病征,其中包括猪断奶后多系统衰弱综合征(PMWS)、皮炎肾病综合征(PDNS)、母猪繁殖障碍等.PCV2基因组全长为1767 bp或1768 bp,含有多个开放式阅读框(ORF),其中ORF2编码主要的结构蛋白(Cap蛋白).其他阅读框均编码非结构蛋白,其中ORF1有945个碱基,编码病毒DNA复制相关的蛋白(Rep蛋白),ORF3长315 bp,编码非结构蛋白,其性质与功能目前尚不十分清楚.华丽等[1]利用生物信息学软件分析,发现PCV2 SC株ORF3编码蛋白含有12个潜在的磷酸化位点;ORF3成熟蛋白有4个主要的抗原位点,可能与病毒的致病性有关.2007年,Steven-son等[2]研究 PCV2 T淋巴细胞抗原表位时证明ORF1(81~100位氨基酸和201~220位氨基酸)与ORF3(31~50位氨基酸)编码的3个多肽均可以诱导外周血液单核细胞中T淋巴细胞的增殖能力.2010 年,Meng等[3]研究识别PCV2 Rep蛋白N'端的单克隆抗体时发现,PCV2-RepN上80~110位氨基酸是3D10的抗原表位.本研究根据Stevenson等[2]发表的翻译3个多肽的序列合成抗原表位的基因,成功克隆了此段基因并在大肠埃希菌Escherichia coli中进行了融合表达,这不仅可以更深入了解PCV2 ORF1和ORF3等编码的非结构蛋白功能与应用,还为研制PCV2基因工程疫苗和抗体检测试剂盒奠定了基础.
1 材料与方法
1.1 菌株、载体与血清
大肠埃希菌 DH5α、BL21(DE3)、pMD18-T Simple Vector、pET-32a(+)、猪圆环病毒阳性血清为自制并保存:用华南农业大学兽医学院传染病实验室自主分离的PCV2平洲株进行猪的攻毒试验,待抗体滴度最高时抽血分离得到血清.
1.2 主要分子生物学试剂
Taq DNA 聚合酶、DL2000、DL5000、DL15000 Marker、限制性内切酶 EcoRⅠ、HindⅢ、T4DNA连接酶为大连宝生物工程有限公司产品;预染蛋白Marker(相对分子质量为10000~250000)为美国BIORAD公司产品;预染蛋白Marker(相对分子质量为10000~170000)为深圳中晶生物技术有限公司产品;E.N.Z.A质粒小抽、胶回收试剂盒为 Omega公司产品;6×His-Tagged Protein Purification Kit为广州建阳生物技术有限公司产品;蛋白A(HRP-Protein A)为武汉博士德生物工程有限公司产品.
1.3 基因的合成
应用DNAStar(Version 4.0)基因分析软件,参照Stevenson等[2]发表的T淋巴细胞抗原表位(T lymphocyte epitope,TCE)基因序列,并在其序列的上游5'端加入EcoRⅠ限制性内切酶位点,下游3'端加入HindⅢ限制性内切酶位点,序列送上海英俊生物技术有限公司合成.目的基因片段为180 bp,合成目的片段全长195 bp,包括终止密码子TAA的PCV2 T细胞多表位成熟蛋白基因,转入pMD18-T Simple载体,转化至大肠埃希菌DH5α感受态细胞中.目的片段序列为:


1.4 目的基因的鉴定与序列测定
按照Omega公司的 E.N.Z.A质粒小抽试剂盒说明书抽提含目的基因的重组克隆质粒DNA,然后经限制性内切酶EcoRⅠ和HindⅢ双酶切鉴定,挑选阳性克隆子送上海英俊生物技术有限公司测序,并命名为pMD-TCE.
1.5 原核表达载体的构建
将克隆于pMD18-T Simple载体中的tce基因用EcoRⅠ和HindⅢ进行双酶切,10 g/L琼脂糖凝胶电泳并进行胶回收.同样方法处理原核表达载体pET-32a(+),常规方法连接,将连接产物转化至大肠埃希菌BL21感受态细胞中.重组表达质粒经过双酶切鉴定,筛选出阳性重组质粒pET-32a-TCE送上海英俊生物技术有限公司测定,并命名为pET-TCE.
1.6 重组表达质粒pET-TCE在大肠埃希菌BL21中的诱导表达
吸取含阳性重组质粒pET-TCE的BL21菌液按10 mL/L接种量接种于4 mL含Amp+(100 μg/mL)的新鲜LB液体培养基中,160 r/min、37℃条件下振摇培养至D600nm为0.6~0.8时(约3 h),加入终浓度为1 mmol/L的无菌异丙基-β-D-硫代吡喃半乳糖苷(IPTG),37℃ 160 r/min继续振摇培养4~5 h.同时设置空白菌 BL21及含空白载体pET-32a(+)的BL21作为阴性对照.取1 mL菌液,12000 r/min离心30 s,弃上清液,用100 μL 2 ×SDS-PAGE 加样缓冲液重悬菌体,反复冻融3次,于沸水中煮沸5~10 min,冷却至室温,12000 r/min离心2 min,其上清液可直接进行SDS-PAGE分析.
1.7 包涵体的制备与蛋白纯化
300 mL含 Amp+(100 μg/mL)的新鲜 LB液体培养基大量诱导蛋白,收集诱导表达的菌体,按常规方法对菌体进行超声处理,包涵体的溶解以及蛋白纯化.蛋白纯化方法步骤按6×His-Tagged Protein Purification Kit说明书进行,收集洗脱峰,用于SDSPAGE分析.
1.8 重组表达蛋白的Western-blot检测
将纯化的重组表达蛋白经电转移后转印到硝酸纤维素膜上,用含有50 g/L脱脂奶粉的TBS溶液4℃条件封闭过夜,用TBST冲洗3次,与猪圆环病毒阳性血清在室温环境下作用1 h,用TBST洗涤3次,加入辣根过氧化物酶标记的Protein A,室温轻摇孵育1~2 h,用TBST洗涤5次,DAB显色确定有无可识别的特异性条带.
2 结果与分析
2.1 重组克隆质粒pMD-TCE的双酶切鉴定及测序结果
抽提重组克隆质粒琼脂糖凝胶电泳能检测到1条大约为2.9 kb的条带,与预期结果相符,且对该质粒经限制性内切酶EcoRⅠ和HindⅢ双酶切后,能检测到1条约183 bp的条带,与预期结果相符,表明tce基因成功插入到pMD18-T Simple Vector中(图1).
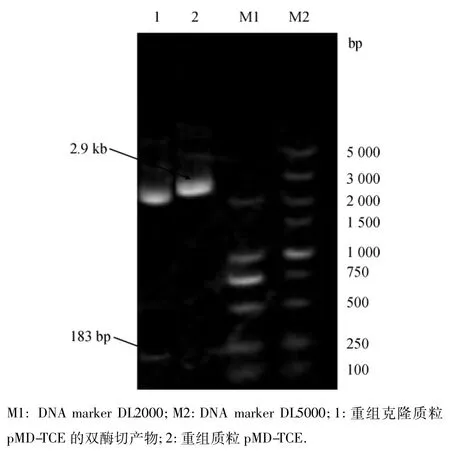
图1 重组克隆质粒pMD-TCE双酶切鉴定Fig.1 Identification electrophoresis of recombinant cloning plasmid pMD-TCE of double digestion
tce基因序列全长为183 bp,并且该序列与“1.3”合成的基因序列完全相同.
2.2 重组表达载体构建的结果
将从pMD-TCE质粒切下的tce基因片段纯化产物插入到pET-32a(+)载体的EcoRⅠ和HindⅢ位点之间,经筛选获得重组表达质粒pET-TCE.用10 g/L琼脂糖凝胶检测重组表达载体的双酶切产物,能检测到1条约183 bp的目的条带.试验结果与预期结果一致,从而表明目的片段tce基因成功亚克隆到pET-32a(+)载体中,且方向正确(图2).
tce基因的序列测定结果同样与1.3合成的基因序列完全相同,序列全长为183 bp.
2.3 表达蛋白的SDS-PAGE分析
收集重组菌诱导表达产物,经SDS-PAGE电泳结果显示,与诱导的BL21(DE3)菌体蛋白、诱导的pET-32a(+)/BL21(DE3)菌体蛋白显示的蛋白条带比较,重组表达质粒pET-TCE/BL21(DE3)在相对分子质量25000附近有1条蛋白条带,与预期大小相符(图3),表明tce基因在大肠埃希菌BL21中已初步成功获得表达.
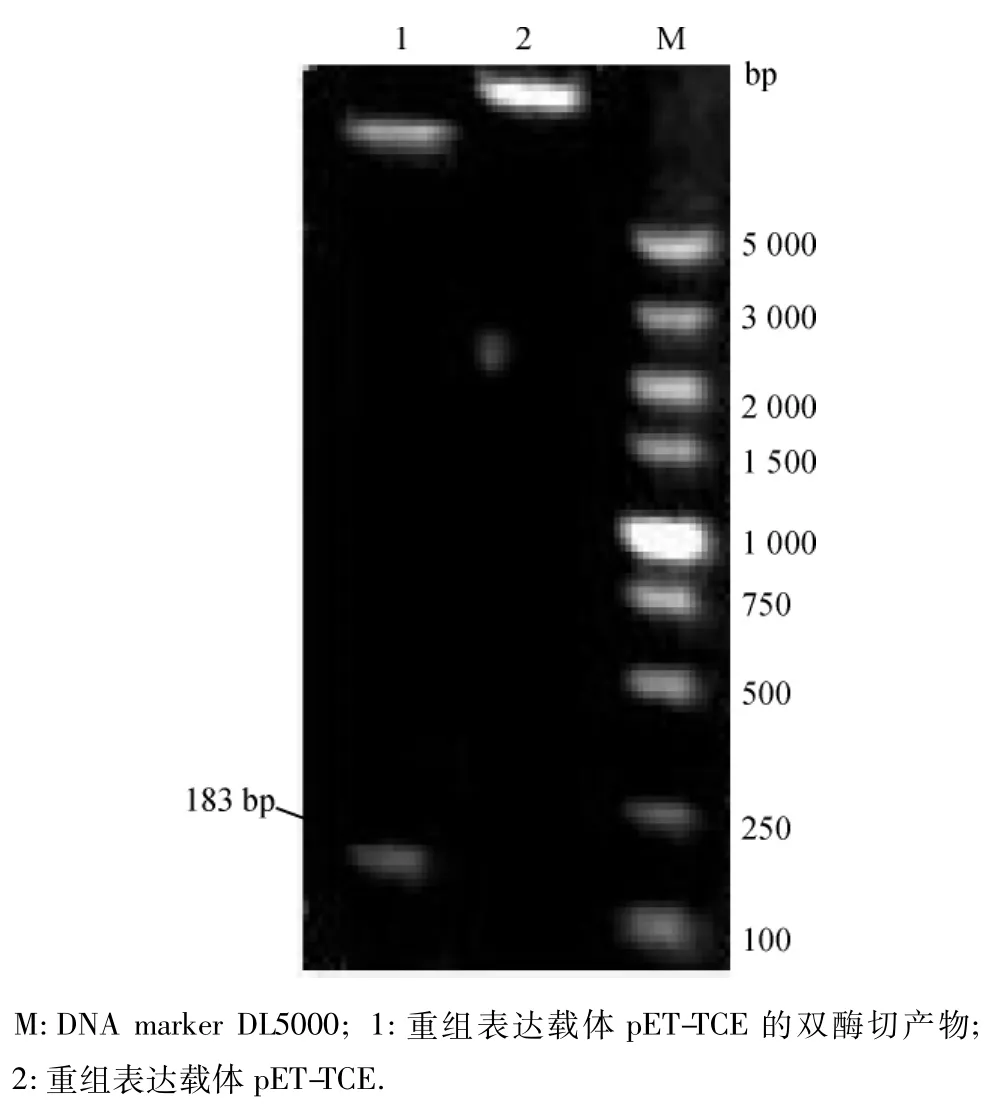
图2 重组表达载体pET-TCE的双酶切鉴定Fig.2 Identification electrophoresis of recombinant expression plasmid pET-TCE of double digestion
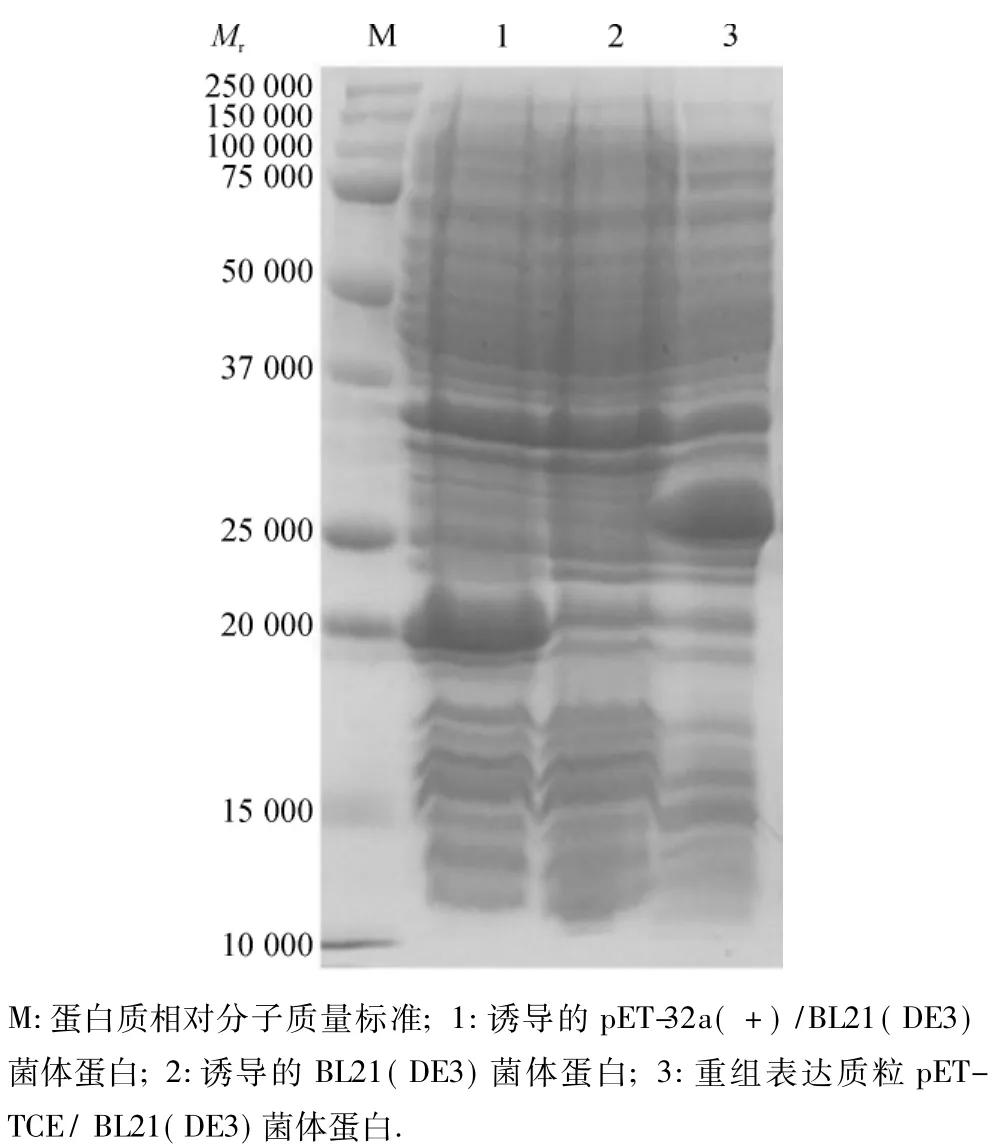
图3 表达蛋白SDS-PAGE分析Fig.3 SDS-PAGE analysis of the recombinant fusion protein
2.4 目的蛋白的纯化
对诱导表达的蛋白进行纯化,收集得到的洗脱峰经SDS-PAGE分析,得到清晰单一的条带(图4).
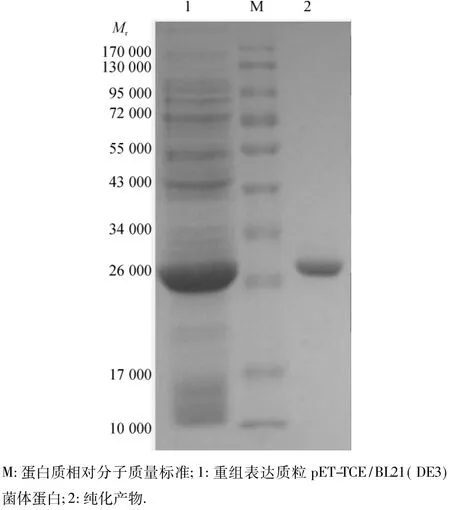
图4 纯化蛋白的SDS-PAGE分析Fig.4 SDS-PAGE analysis of the purified recombinant fusion protein
2.5 表达蛋白的Western-blot检测
将重组蛋白经SDS-PAGE电泳后,电转移至NC膜上进行Western-blot,并设阴性对照,结果显示,在相对分子质量26000附近出现1条清晰反应带(图5),说明表达蛋白与猪圆环病毒2型阳性多抗特异性结合,有良好免疫原性.
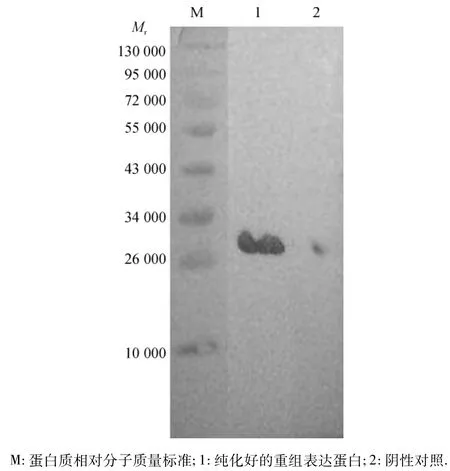
图5 重组蛋白的Western-blot检测分析Fig.5 Western-blot analysis of the recombinant fusion protein
3 讨论
原核的大肠埃希菌表达系统具有表达高效、经济方便以及遗传背景清楚的优点.虽然此系统具有局限性,当所表达的蛋白是复杂的真核来源的蛋白时,大肠埃希菌常常是形成不溶性、多肽链折叠错误以及没有活性的包涵体,而不能形成天然构象的蛋白质[4].但是,人们从多年的实践中得到了诸多经验,譬如:选择合适的表达菌株、优化适合表达自己目的蛋白的条件.另外Tobias等[5]在研究猪圆环病毒复制需要Rep和Rep'2种蛋白时表明猪圆环病毒主要蛋白上抗原表位多为线性的,因此蛋白质的加工无需复杂的加工与修饰.所以本试验选择此系统表达PCV2 T淋巴细胞抗原表位基因,简单快捷地表达了目的蛋白.根据氨基酸平均相对分子质量是128,计算大肠埃希菌表达的融合蛋白的相对分子质量应该是24768,但是本试验SDS-PAGE结果则显示稍大于26000.当外源蛋白在表达系统中表达时,影响表达蛋白大小的因素有很多:如二硫键的形成、蛋白的异常迁移以及糖基化的发生等.原核表达系统的主要特点就是表达产生的蛋白质不能进行糖基化、磷酸化等修饰,难以形成正确的二硫键配对和空间构象折叠,并且在SDS电泳时,把蛋白样品和上样缓冲液混合后在沸水中煮了10 min,尽量使蛋白的空间结构完全打开变性.Banker等[6]发现异常蛋白质在进行SDS-PAGE电泳时,蛋白质的表观相对分子质量会随着凝胶中丙烯酰胺浓度的改变而发生变化.本研究中,多次将蛋白样品进行凝胶电泳,分离胶的丙烯酰胺质量分数在12%~15%范围内变动,但是融合蛋白的凝胶电泳结果均相同,因此排除了以上的3种可能.该试验表达的融合蛋白Westernblot结果阳性,有很好的免疫原性,所以究其原因可能是蛋白平均相对分子质量不精确导致的计算误差.
抗原表位(Epitope)又称抗原决定簇(Antigenic determination),是指抗原分子上的一个免疫活性区,具有特殊结构和免疫活性的化学基团,是具有刺激机体产生抗体或致敏淋巴细胞并能够被其识别的部位.按与抗原受体细胞结合的不同,分为B细胞抗原表位和T细胞抗原表位.B细胞抗原表位介导体液免疫,T细胞抗原表位介导细胞免疫.单纯的B抗原细胞表位不能介导有效的体液免疫应答,须有T抗原细胞表位介导细胞免疫应答的参与.因此T细胞抗原表位在免疫应答反应中发挥着非常重要的作用.为了更深入地了解T细胞抗原表位的功能,本试验结合Stevenson等[2]的研究对发表的T细胞抗原表位基因进行了原核表达.
目前国内外研究PCV2 Cap蛋白的文献比比皆是,尤其是对此蛋白抗原表位的鉴定与分析.Shang等[7]在研究猪圆环病毒抗原表位时,筛选了5个B细胞线性表位,包括PCV2特有的氨基酸残基231~233和195~202位,PCV1特有的氨基酸残基92~103位,以及PCV1和PCV2共有的氨基酸残基156~162和175~192位;郭龙军等[8]对PCV2 Cap蛋白上抗原表位进行鉴定时发现核心序列为26RPWLVHPRHRY36的优势抗原表位位于Cap蛋白核定位信号区上,这些研究都有利于猪圆环病毒ORFs功能的研究以及得到有鉴别诊断价值的抗原表位.相比而言国内外研究PCV2 ORF1和ORF3等编码非结构蛋白功能与应用的文章较少,大部分研究用基因工程菌表达的Rep蛋白均可与PCV2阳性血清发生特异性反应,亦具有良好的免疫原性.杨晓农[9]在对PCV2 ORF1、ORF3和ORF5基因部分功能的研究中,用酶切缺失方法分别构建ORF1、ORF3、ORF5缺失突变毒株mPCV2-A、mPCV2-C和mPCV2-E,然后接种于28~30日龄健康仔猪,结果表明基因缺失对病毒的细胞免疫功能未产生影响,三基因缺失突变毒株仍有诱导仔猪细胞免疫应答的趋势,说明 ORF1、ORF3、ORF5上均有诱导细胞免疫的抗原表位.因此本文对PCV2 ORF1和ORF3上的具有细胞免疫活性的部位进行了研究,融合表达了ORF1与ORF3上的T淋巴细胞抗原表位,且得到了预期的效果,Western-blot结果显示融合蛋白与猪圆环病毒2型阳性血清发生特异性反应,有良好的免疫原性.
鉴于不清楚融合表达的TCE抗原表位是否可以诱导外周血液单核细胞中T淋巴细胞的增殖能力,目前本研究正着手用纯化好的TCE表达蛋白免疫小鼠,探讨其是否有更好的T细胞免疫功能,希望为PCV2基因工程疫苗的制备奠定基础.
[1]华丽,朱玲,史小红,等.猪圆环病毒Ⅱ型SC株ORF3基因克隆及其编码蛋白的生物信息学分析[J].基因组学与应用生物学,2010,29(5):857-864.
[2]STEVENSON L S,GILPIN D F,DOUGLAS A,et al.T lymphocyte epitope mapping of porcine circovirus type 2[J].Viral Immunol,2007,20(3):389-398.
[3]MENG Tao,JIA Qiang,LIU Sen,et al.Characterization and epitope mapping of monoclonal antibodies recognizing N-terminus of Rep of porcine circovirus type 2[J].J Virol,2010,165(2):222-229.
[4]刘爽胡宝成.原核系统可溶性表达策略[J].生物技术通讯,2005,16(2):172-175.
[5]TOBIAS S,TIM F,ANNETTE M.Rep and Rep'protein of porcine circovirus type 1 bind to the origin of replication in vitro[J].Virol,2001,291(1):152-160.
[6]BANKER G A,COTMAN C W.Measurement of free electrophoretic mobility and retardation coefficient of proteinsodium dodecyl sulfate complexes by gel electrophoresis:a method to validate molecular weight estimates[J].J Biol Chem,1972,247(18):5856-5861.
[7]SHANG S B,JIN Y L,JIANG X T,et al.Fine mapping of antigenic epitopes on capsid proteins of porcine circovirus and antigenic phenotype of porcine circovirus type 2[J].Mol Immunol,2009,46(3):327-334.
[8]郭龙军,陆月华,黄立平,等.猪圆环病毒2型Cap蛋白核定位信号区抗原表位的鉴定[J].中国农业科学,2010,43(7):1480-1486.
[9]杨晓农.猪圆环病毒Ⅱ型ORF1、ORF3及ORF5基因部分功能的研究[D].雅安:四川农业大学,2007.

