果葡糖浆生产过程中甘露糖产生的研究
刘 佳, 张晓萍, 段 钢
(杰能科(中国)生物工程有限公司 杜邦工业生物科技,江苏 无锡 214028)
果葡糖浆是由果糖和葡萄糖及其它少量的糖类所组成的混合物,是一种以淀粉为主要原料、运用生物工程技术生产出来的健康型糖源[1]。果葡糖浆主要应用于食品工业,也有少量高纯果糖可应用于医药工业。在食品工业中主要应用于软饮料行业、乳制品行业、罐头工业、糕点行业等。随着对果葡糖浆优越性的深入了解,其应用领域更加广泛,国内外市场需求量也在不断增加,质量要求也越来越高。
作者在分析客户样品过程中发现在一些果葡糖浆中存在一定量的甘露糖,所占比例从0.2%到1.5%不等。根据可口可乐公司对F55型果葡糖浆的质量要求,即果糖最小含量为55%,果糖与葡萄糖含量不小于95%。在一些F55果糖样品中,由于存在甘露糖,虽然果糖含量满足要求,单糖含量也在95%以上,但果糖与葡萄糖含量之和小于95%。由于可口可乐公司的要求中并不是指单糖含量,因此这种产品实际上是不符合要求的。由于F55果糖是由F90果糖和F42果糖混配而成,为了满足要求就需要提高F90的比例。因此研究果葡糖浆生产过程中甘露糖产生的原因具有重要意义。
通过仔细分析含有甘露糖的样品后发现,其主要产生在两个过程之后,一个是在异构化之后,另一个是在第二次离子交换之后,即F42果糖离交后。葡萄糖异构酶的来源较多,商业化的酶主要来源于Bacillus和streptomyces[2],可以催化葡萄糖、果糖,木糖、木酮糖之间的异构反应。由于对葡萄糖异构酶的研究多集中在底物特异性及提高反应稳定性等方面,因而对副反应产物的报道很少。此外果糖、葡萄糖易在碱性条件下,由于旋光改变作用发生分子重排和降解,通过烯二醇作为中间物可以实现果糖、葡萄糖和甘露糖之间的互相转化[3-4],此反应又称为Lobry de Bruyn-Alberda van Ekenstein转化,并且在此过程中单糖部分降解,产生少量有色物质等其它产物。而在生产过程中,果葡糖浆需要使用离子交换树脂进行纯化,离子交换树脂使用碱液进行再生,再生后清洗不彻底,容易造成局部过碱,从而发生此反应生成甘露糖。
作者研究了葡萄糖异构酶对甘露糖产生的影响,以及葡萄糖、果糖在不同碱性pH值条件下单糖旋光改变和降解反应的情况,比较了不同环境下葡萄糖和果糖含量变化对甘露糖产生的影响,同时检测了反应体系中产生的其它产物。为研究果葡糖浆中甘露糖和其它杂质的产生原因提供理论依据。
1 材料与方法
1.1 实验材料
葡萄糖,果糖,氢氧化钠和硫酸:国药集团产品;葡萄糖,果糖,甘露糖,甲酸,乙酸,乙酰丙酸,糠醛和5-羟甲基糠醛:Sigma公司产品;异构酶1和异构酶2:市售。
1.2 实验方法
1.2.1 异构酶对甘露糖产生的影响 25 g葡萄糖浆(客户样品,质量分数45%,pH 7.4,Mg2+质量浓度45 mg/kg)中加入2 g异构酶,于60℃水浴保温,分别于24 h及48 h取样分析。对照实验以分析纯葡萄糖加蒸馏水配置成相同浓度的糖浆,并调节pH及镁离子质量浓度相同,加入同样比例异构酶,60℃反应,于24 h和48 h取样分析。
1.2.2 不同碱性pH值条件下果糖及果糖和葡萄糖混合物的反应 用分析纯果糖和葡萄糖加水配成100 g/L 3种溶液,溶液中果糖浓度分别为100%、42%和20%。分别取10 mL上述溶液加入50 mL塑料离心管中,并加入10 mL不同浓度的NaOH溶液,使最终溶液体系成为6个不同pH值的50 g/L 100%果糖、42%果糖和20%果糖溶液。6个pH值分别 为 pH 7,pH 8.5,pH 10,pH 11,pH 12 和 pH 12.8。将离心管盖上盖子后放入60℃水浴进行反应,在0,4,7和23 h分别进行取样分析。
1.3 分析方法
1.3.1 葡萄糖,果糖和甘露糖分析 使用带有示差检测器的安捷伦1260 HPLC系统进行分析,色谱柱:Phenomenex RezexTMCalcium Monosaccharide(RCM)(300×7.8 mm);柱温 80 ℃;流动相纯水;流量0.6 mL/min;示差检测器温度40℃。
1.3.2 有机酸分析 使用带有示差检测器的安捷伦1100 HPLC系统进行分析,色谱柱:Phenomenex RezexTMOrganic Acid (300 mm×7.8 mm); 柱温 60℃;流动相 0.005 mol/L H2SO4;流量 0.6 mL/min;示差检测器温度30℃。
1.3.3 反应体系吸光度分析 使用分光光度计在420 nm处测定样品的A值。
2 结果与讨论
2.1 异构酶对甘露糖产生的影响
以客户的异构进料样为底物,其中葡萄糖质量分数为91.38%,考察了葡萄糖异构酶对甘露糖产生的影响,结果显示,底物自身几乎不含甘露糖,当糖液中不添加葡萄糖异构酶,24 h后仅有微量甘露糖产生,而加入葡萄糖异构酶24 h后,生成大量甘露糖。通常认为甘露糖是果糖在碱性条件下通过Lobry de Bruyn-van Ekenstein途径产生,也有研究认为在中性或酸性条件下,果糖也能够转化为甘露糖,但需要较长时间。在工业生产中,果糖异构反应的pH通常控制在7.3附近,此时果糖的Lobry de Bruyn-van Ekenstein转化速率慢,因此添加异构酶后所产生的甘露糖仅有极小部分是通过此反应产生,大部分应来源于异构酶的副反应活力。
为了进一步了解异构酶对甘露糖产生的影响,实验使用了两种商品化的异构酶,考察其影响,结果如图1所示。异构酶1和异构酶2是两种商业化多年的葡萄糖异构酶产品,从图1可以看出两者在异构过程中都会产生甘露糖。对于异构酶1,反应24 h后,甘露糖增加3倍,24 h后虽然甘露糖浓度仍然在增加,但速度减慢。对于异构酶2,24 h后甘露糖增加了3.4倍,同样其产生速度也在24 h后大幅降低。果糖与甘露糖的比值在一定程度上反应了异构酶对于主反应的选择性,由于两种异构酶产生甘露糖的能力有所不同,从而表现在主反应的选择性上也有所区别。但这种区别在底物被更换为分析纯葡萄糖配制的糖浆时表现的不明显。以分析纯葡萄糖为底物,反应24 h甘露糖的产生量减少了30.3~33.7%(图2),而果糖与甘露糖的比值则提高41.5~51.0%,由此可见提高底物纯度不仅能够降低甘露糖产生,也有利于提高异构反应的选择性。

图1 不同异构酶对甘露糖产生的影响Fig.1 Effect of different glucose isomerase on mannose formation
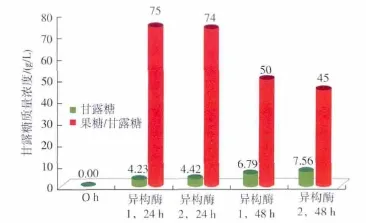
图2 以葡萄糖为底物时甘露糖的产生Fig.2 Mannose formation using glucose as substrate
果葡糖浆的生产是一个连续的过程,葡萄糖浆从异构柱进口进入,到F42果糖从出口流出的线速度通常为几毫米/秒[5],所需时间并没有24 h,因此在正常的生产中,并不会有太多的甘露糖在异构之后产生。但果糖生产存在淡、旺季之分,在淡季,工厂通常会封柱,或是将流速降至极低,这样就使得酶与糖浆的接触时间大大增加,因此在刚恢复正常流量时,会在异构出口处的样品中检测到较多的甘露糖。此外有些工厂在将异构酶装填进异构柱之前,会先对酶进行水化,水化时间通常需要数小时,也会产生一定量的甘露糖。
2.2 不同碱性pH值对果糖及果糖和葡萄糖混合物反应的影响
2.2.1 不同碱性pH值对甘露糖合成的影响 为了研究离子交换树脂中残留碱液对甘露糖产生的影响,作者使用质量分数100%果糖和42%、20%果糖含量的果葡糖浆作为底物,观察其在不同碱性pH条件下甘露糖的合成情况,结果如图3所示。
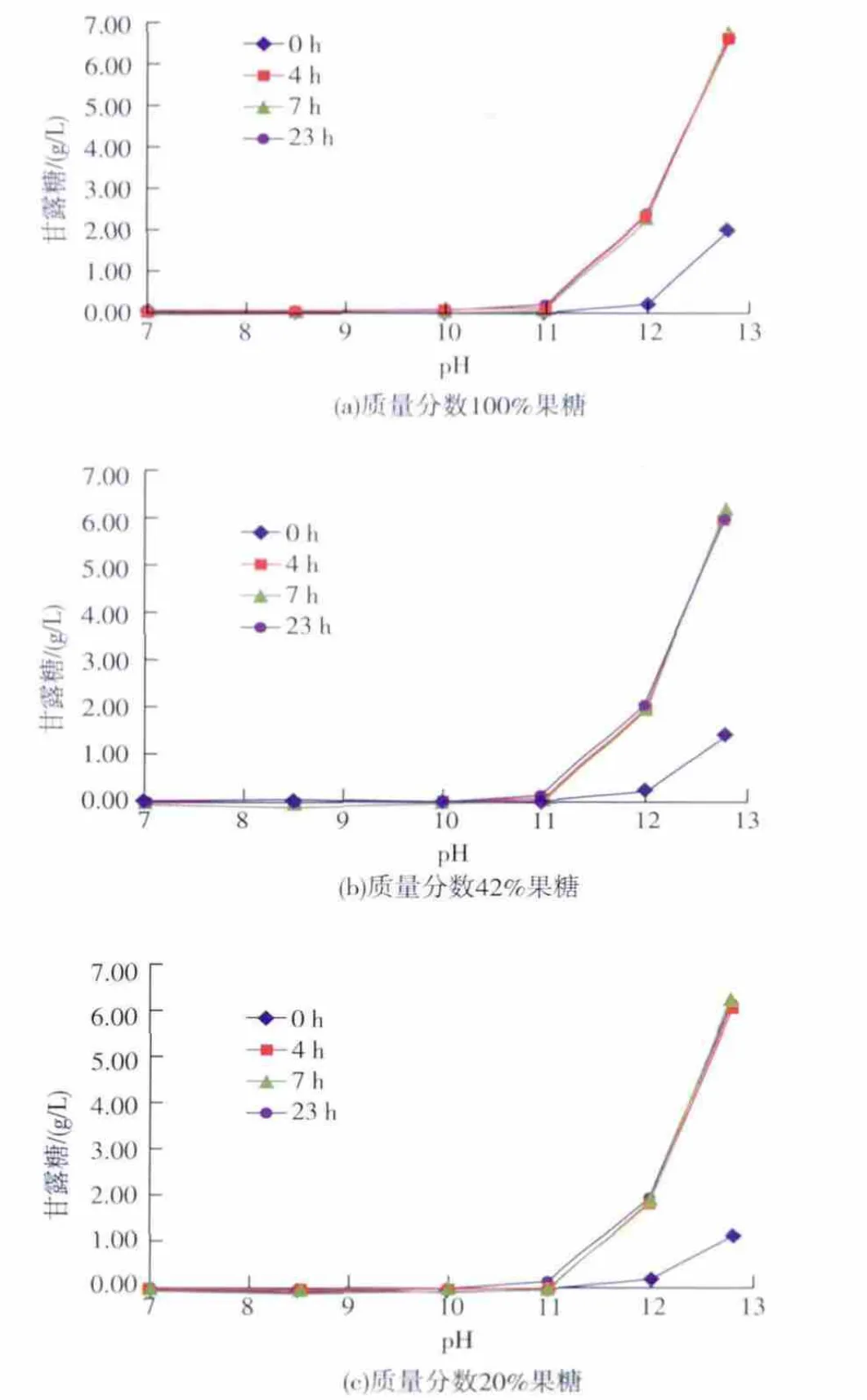
图3 不同pH值对甘露糖产生的影响Fig.3 Effect of different alkali pH values on mannose formation
以质量分数100%果糖作为反应底物时,在pH 7~10条件下反应体系只有微量甘露糖合成(甘露糖含量小于0.1 g/L)。当pH大于10后,甘露糖含量大幅提高,尤其在4 h后。当pH为12.8反应4 h后,甘露糖含量接近7 g/L。以质量分数42%果糖的果糖和葡萄糖混合物作为反应底物时,在pH 7~10条件下,在取样时间内没有明显甘露糖合成,当pH大于11后,0 h的样品中可检测到甘露糖。当pH为12.8,0 h的样品中可测得1.5 g/L左右甘露糖,反应4 h以后,其含量达到6 g/L,这与相同条件下质量分数100%果糖作为底物时相比略低。而以质量分数20%果糖含量的混合物作为底物时,产生的甘露糖变化曲线与另外两种底物类似,但甘露糖合成量比质量分数42%果糖含量的底物更低一些。由此可见,甘露糖的产生与环境pH值和接触时间密切相关,环境pH越高,果糖产生甘露糖的时间越短,当pH大于11后,接触瞬间既有少量甘露糖产生,因此在离子交换过程中,如果树脂碱性再生后没有清洗干净,造成局部pH过高,糖浆接触之后就会产生甘露糖,因此树脂再生后清洗干净有助于减少离子交换过程中甘露糖的产生。
2.2.2 不同碱性pH值对其它杂质 (有机酸和有色物质)合成的影响 上述果糖和葡萄糖体系在反应23 h时测定其pH值发现均有一定程度的下降,且均可降至pH 7以下。单糖在酸性条件下易发生降解反应产生有机酸及其它一些产物,其中有些降解产物,如糠醛、5-羟甲基糠醛(5-HMF)会影响果葡糖浆的风味,因此除甘露糖含量外,作者还测定了上述底物在不同pH条件下23 h时反应体系中甲酸、乙酸、乙酰丙酸、糠醛和5-HMF的含量,测定结果如图4所示。


图4 不同pH值下反应23 h对有机酸合成的影响Fig.4 Effect of different alkali pH values on organic acid formation after 23 hours
通过实验结果可以发现上述反应体系中无乙酰丙酸和糠醛检出。100%果糖和42%果糖作为反应底物时,甲酸在初始pH大于7的反应体系中均可产生;20%果糖作为反应底物时,甲酸在初始pH大于10以后才开始合成。在初始pH为12.8时3种不同果糖含量反应底物的甲酸含量接近,可达1.5 g/L。3种不同果糖含量反应底物均在初始pH大于11后才开始合成乙酸,且3种反应底物在初始pH为12.8时乙酸合成量非常接近,均可达1.6 g/L。在初始pH大于12时5-HMF开始合成,且100%果糖在初始pH为12.8时5-HMF含量最高,可超过0.05 g/L。3种有机酸的合成量均随果糖比例的增加而增加。这是由于葡萄糖降解较为困难,且需要金属离子作为催化剂,甲酸、乙酸和5-HMF主要为果糖降解产物。果糖的主要降解产物是5-HMF,但5-HMF并不稳定,在一定条件下也会发生低聚或进一步降解成乙酰丙酸和甲酸。乙酰丙酸也不稳定,容易生成γ-内酯[6]。因此反应体系中检测到的5-HMF含量较低,且无乙酰丙酸检出。
果糖和葡萄糖在高pH条件下溶液颜色会发生一定变化,图5为3种不同果糖含量的反应底物在不同pH条件下颜色变化曲线。使用分光光度计检测反应体系的A420nm,可以发现3种果糖含量的反应底物的颜色变化非常接近,有色物质在pH大于11时才开始合成,随着pH的增加反应体系颜色明显加深。

图5 不同pH值下反应23 h对体系颜色变化的影响Fig.5 Effect of different alkali pH values on color change of the system after 23 hours
3 结语
作者对果葡糖浆生产过程中甘露糖产生的原因进行研究,证实了葡萄糖异构酶和碱性环境均可能导致甘露糖产生。使用两种不同的商品化异构酶发现异构过程都会产生甘露糖;并通过比较客户异构进料样和纯葡萄糖浆两种底物,发现高纯度底物有助于降低甘露糖产生,另外糖浆与异构酶接触时间过长也是甘露糖产生的一个重要原因。在研究不同碱性pH环境对果糖和果糖葡萄糖混合物影响时发现将pH降至10以下可有效降低甘露糖产生并且较高的果糖比例也会提高甘露糖的合成。除甘露糖外,在碱性pH环境中果糖和果糖葡萄糖混合物还会产生少量甲酸、乙酸、5-HMF等有机酸杂质和一些有色物质。
[1]张力田,高群玉.淀粉糖[M].北京:轻工业出版社,2011.
[2]Snehalata H Bhosale,Mala B Rao,Vasanti V Deshpande.Molecular and industrial aspects of glucose isomerase[J].Microbiological Reviews,1996,60(2):280-300
[3]王镜岩,朱圣庚,徐长法.生物化学[M].北京:高等教育出版社,2005.
[4]Shafizadeh F,Lai Y Z.Base-catalyzed,pyrolytic rearrangement of some monosaccharides[J].Carbohydrare Research,1973,26:83-89.
[5]段刚,陆冬佳,周红伟,等.果糖生产中的问题探讨.全国果葡糖浆市场与发展高峰论坛论文汇编[C].北京:2012.
[6]李艳,魏作君,陈传杰,等.碳水化合物降解为5-羟甲基糠醛的研究[J].化学进展,2010,22(8):1603-1609.LI Yan,WEI Zuo-jun,CHEN Chuan-jie,et al.Praparation of 5-Hydroxy methylfurfural by dehydration of carbohydrates[J].Progress in Chemistry,2010,22(8):1603-1609.(in Chinese)

