4-a-糖基转移酶的催化区域结构及关键氨基酸解析
王金鹏 , 田耀旗 , 周 星 , 焦爱权 , 赵建伟 , 金征宇 *1,
(1.食品科学与技术国家重点实验室 江南大学,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡 214122;3.食品安全与营养协同创新中心 江南大学,江苏 无锡214122)
大环糊精(LR-CD)是由9个以上D-吡喃型葡萄糖单元通过α-1,4糖苷键连接而成的环状糊精的统称[1-2],具有比常见环糊精更加优越的水溶性及包埋性能[3]。合成大环糊精(LR-CD)的酶类被统称为4-α-糖基转移酶 (4αGtase)。 不同菌株来源的4αGtase的酶学性质具有很大的差异,这些差异导致LR-CD产率及聚合度范围存在很大区别,例如来自Paenibacillus sp.F8的CGTase能够作用淀粉产生聚合度6~9的环糊精,其中CD9的产量约为10%[4];而来自T.aquaticus的Maltase能够作用淀粉产生聚合度>22的LR-CD,产率高达84%[5]。从酶本身来考虑,造成产物专一性差异的因素主要有:氨基酸序列差异、酶-淀粉结合区域差异、酶-淀粉结合位点差异及酶活性中心区域的差异等。作者所在实验室构建了能够表达产生4αGtase的菌株[6],并验证了该酶催化淀粉产生聚合度(DP)范围为20~40的大环糊精,且最高转化率达55%[7],经核苷酸序列鉴定及生物信息学的方法分析发现4αGtase的α-螺旋/β-折叠比例为2.1,其中α-螺旋占23.3%,β-折叠占11.1%,酶的催化催化区域均匀分布在整个酶分子[8]。但是关于该酶的结构信息报道还非常少。为了加深对4αGtase的进一步了解,作者对4αGtase进行了化学修饰,深入探讨该酶活性中心的氨基酸种类,以期为揭示4αGtase的结构特点提供参考。
1 材料与方法
1.1 材料与仪器
低相对分子质量标准蛋白:分析纯,重庆升博科技有限公司产品;LB培养基(质量分数)(0.5%酵母膏,1%NaCl,1%蛋白胨);氨苄青霉素钠:美国Sigma公司产品;咪唑、三羟甲基氨基甲烷(Tris)、HCl,及巯基乙醇:均为分析纯,北京国药集团产品;丁二酮(DIC)、苯甲基黄酰氯(PMSF)、氯氨-T(Ch-T)、N-溴代丁二酰亚胺 (NBS)、 焦碳酸二乙酯(DEPC)、碳二亚胺(EDC)、二硫苏糖醇(DTT):均为分析纯,美国Sigma公司产品。
淋洗缓冲液(50 mmol/L Tris-HCl(pH 7.5)、300 mmol/L NaCl、20 mmol/L 咪唑)
洗脱缓冲液(50 mmol/L Tris-HCl(pH 7.5)、300 mmol/L NaCl、250 mmol/L 咪唑)。
SW-CJ-1F双人单面超净工作台:苏州安泰空气技术有限公司产品;LS-B50L自动立式电热压力蒸汽灭菌锅:上海华线医用核子仪器有限公司产品;3K30冷冻离心机:美国SIGMA公司产品;JYD-650超声波细胞粉碎机:上海三信仪器有限公司产品;RJ-TDL-50A底物台式大容量离心机:江苏瑞江分析仪器公司产品;纯泰Ni-NTA亲和层析柱(5 mL),生物医药纯化技术公共服务平台,AKTA purifier 900蛋白纯化系统:瑞典AKTA公司产品。
1.2 方法
1.2.1 质粒的转化 采用氯化钙法制备感受态细胞并对携带目标基因的p6×HTAaGT Ampr质粒进行转化,具体过程参见文献[9]。
1.2.2 4αGtase粗酶的提取 挑取阳性转化的基因工程菌单菌落,37℃培养8 h后,4 000 r/min离心10 min收集菌体,将菌体分散在约10 mL的Tris-HCl缓冲液(pH 7.5,50 mmol/L)中,冰浴下采用超声破壁的方法提取粗酶液,超声破壁提取条件为:功率300 W,超声时间3 s,间歇时间 5 s,超声次数180次。
1.2.3 4αGtase的分离纯化 采用Ni-NTA亲和层析柱对重组蛋白进行纯化,并采用不连续垂直平板电泳系统对纯化后的目标酶进行纯度鉴定。分离胶质量浓度15 g/L,浓缩胶质量浓度5 g/L,电泳采用pH 7.5的Tris-HCl缓冲体系,考马斯亮蓝R-250染色。
1.2.4 4αGtase的活性测定 酶活分析采用碘比色法。准确吸取100 μL体积分数90%DMSO溶解的质量分数0.2%的直链淀粉溶液,置入2 mL离心管中,加入 800 μL 50 mmol/L Tris-HCl(pH 7.5),用漩涡混合器将其混匀,置于超级恒温金属浴中75℃保温10 min,加入100 μL酶液,立即混匀并开始计时,当75℃保温10 min后,立即取出100 μL反应液加入到900 μL稀碘液,摇匀。以稀碘液为空白,采用三波长分光光度法(TWC)测定反应溶液中大环糊精的生成量,采用正交函数分光光度法来测定反应溶液中直链淀粉的下降量。
酶活定义:在测定条件下,每分钟转化生成1 μg大环糊精所需要的酶量为1 U的环化活性;每分钟转化1 μg直链淀粉所需要的酶量为1 U的总活性。
1.2.5 4αGtase的化学修饰
1)化学修饰剂对4αGtase的稳定性影响 分别采用精氨酸修饰剂DIC、蛋氨酸修饰剂ChT、色氨酸修饰剂NBS、组氨酸修饰剂DEPC、羧基修饰剂EDC、二硫键修饰剂DTT及蛋白变性剂巯基乙醇等修饰剂与等量4αGtase进行混合,达到各自所需修饰浓度,在25℃下保温30、60、90 min,然后测定4αGtase催化淀粉产生大环糊精的量及淀粉的下降量,在同样的条件下测定未加修饰剂的4αGtase环化活性及总酶活的影响。
2)化学修饰剂对4αGtase活性的影响 分别将上述化学修饰剂与4αGtase进行不同比例混合,并保持总体积一致,测定经不同浓度修饰的4αGtase环化活性及总酶活的变化。
2 结果与分析
2.1 精氨酸的化学修饰
精氨酸残基含有1个强碱性的胍基,可以与丁二酮可逆的生成精氨酸-丁二酮复合物[13]。向4αGtase中加入 0.1 mmol/L的DIC,分别保温 30、60、90 min,结果见图 1(a)。 由图 1(a)可以看出,在90 min的修饰时间内,经DIC修饰的4αGtase环化活性及总酶活性基本保持稳定,因此选择30 min作为修饰时间,进一步探讨DIC浓度对4αGtase活性的影响,结果见图 1(b)。 由图 1(b)可以看出,不同浓度的DIC添加对大环糊精含量及直链淀粉的含量基本无明显变化,统计学分析显示无明显差异,表明精氨酸不是4αGtase活性中心的必须基团。
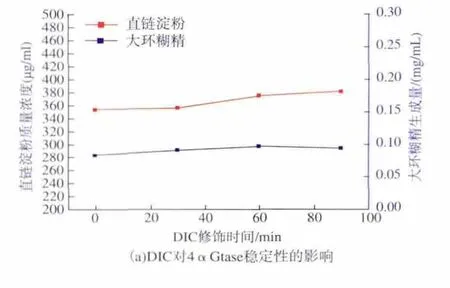

图1 (a)DIC对4αGtase稳定性的影响,(b)DIC浓度对4αGtase活性的影响Fig.1 (a)The effect of DIC on the stability of 4αGtase,(b)Effect of DIC concentration on the activity of 4αGtase
2.2 蛋氨酸的化学修饰
向4αGtase中加入0.1 mmol/L的ChT,分别保温 30、60、90 min,结果见图 2(a)。 由图 2(a)可以看出,在60 min的时间内,随着保温时间延长,大环糊精含量呈现明显上升趋势,而且直链淀粉含量呈现明显下降趋势,表明低浓度ChT修饰能够促进4αGtase的环化活性及总酶活。在 90 min时,4αGtase的活性基本保持稳定,因此选择90 min作为修饰时间,进一步探讨ChT浓度对4αGtase活性的影响,结果见图 2(b)。 由图 2(b)可以看出,随着ChT添加浓度增加到10 mmol/L时,大环糊精质量浓度由0.26 mg/mL下降至0.16 mg/mL,环化活性下降了38.5%;直链淀粉的质量浓度由425 μg/mL下降至307 μg/mL表明总酶活提高了27.8%。该结果说明蛋氨酸可能位于4αGtase的淀粉结合区域,而非催化区域。
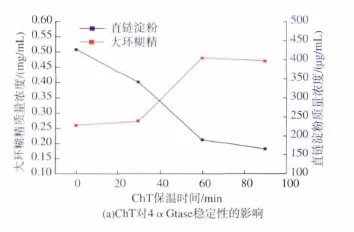

图2 (a)ChT对4αGtase稳定性的影响,(b)ChT浓度对4αGtase活性的影响Fig.2 (a)The effect of ChT on the stability of 4αGtase,(b)Effect of ChT concentration on the activity of 4αGtase
2.3 色氨酸的化学修饰
向4αGtase中加入0.1 mmol/L的NBS,分别保温 30、60、90 min,结果见图 3(a)。 由图 3(a)可以看出,在60 min的时间内,随着保温时间延长,大环糊精含量呈现明显上升趋势,而且直链淀粉含量呈现明显下降趋势,表明低浓度NBS修饰能够促进4αGtase的环化活性及总酶活。在 90 min时,4αGtase的活性基本保持稳定,因此选择90 min作为修饰时间,进一步探讨NBS浓度对4αGtase活性的影响,结果见图 3(b)。由图 3(b)可以看出,随着NBS添加浓度提高到10 mmol/L,大环糊精质量浓度由0.26 mg/mL增加到0.27 mg/mL,环化活性增加了3.8%;直链淀粉质量浓度由425 μg/mL减低到357 μg/mL,总酶活增加了16%,当修饰剂浓度超过10 mmol/L时,酶活基本不变,表明所有的色氨酸均被修饰。表明色氨酸可能是4αGtase催化活性中心的关键氨基酸之一。
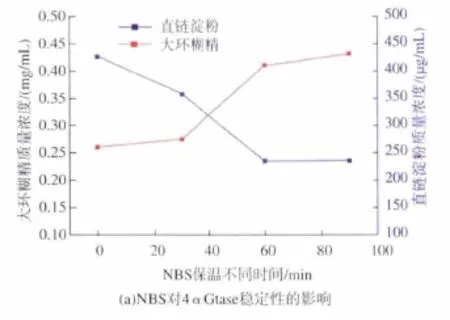
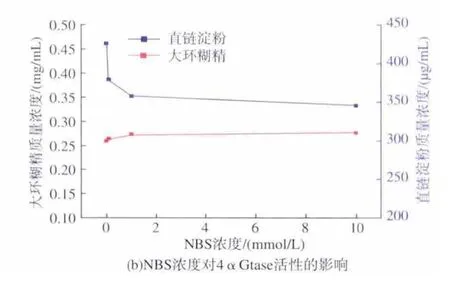
图3 (a)NBS对4αGtase稳定性的影响,(b)NBS浓度对4αGtase活性的影响Fig.3 (a)The effect of NBS on the stability of 4αGtase,(b)Effect of NBS concentration on the activity of 4αGtase
2.4 组氨酸的化学修饰
向4αGtase中加入0.1 mmol/L的DEPC,分别保温 30、60、90 min,结果见图 4(a)。 由图 4(a)及 4(b)可以看出,DEPC的加入使4αGtase迅速失活,图4(b)也表明不同浓度的DEPC能够造成4αGtase的环化活性及总酶活均完全失活,表明组氨酸是位于催化中心的关键氨基酸。
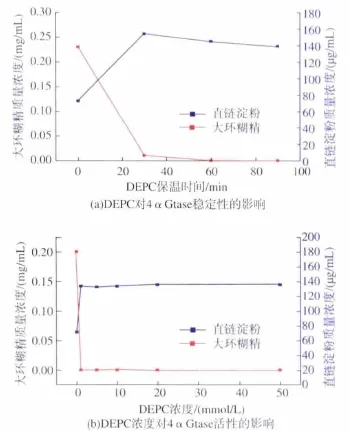
图4 (a)DEPC对4αGtase稳定性的影响,(b)DEPC浓度对4αGtase活性的影响Fig.4 (a)The effect of DEPC on the stability of 4αGtase,(b)Effect of DEPC concentration on the activity of 4αGtase
2.5 羧基的化学修饰
EDC是羧基(谷氨酸/天冬氨酸)专一性修饰试剂。向4αGtase中加入0.1 mmol/L的EDC,分别保温 30、60、90 min,结果见图 5(a)。 由图 5(a)可以看出,在30 min的时间内,随着保温时间延长,大环糊精含量呈现明显下降趋势,而且直链淀粉含量呈现明显上升趋势,表明低浓度EDC修饰能够使4αGtase的环化活性及总酶活均降低。在30 min时,4αGtase的活性基本保持稳定,因此选择30 min作为修饰时间,进一步探讨EDC浓度对4αGtase活性的影响,结果见图 5(b)。 由图 5(b)可以看出,随着EDC添加浓度提高到10 mmol/L,大环糊精质量浓度由0.53 mg/mL降低到0.41 mg/mL,环化活性降低了22.6%;直链淀粉质量浓度由108 μg/mL升高到161 μg/mL,总酶活降低了 58.3%,表明 4αGtase 的环化活性及总酶活均得到抑制,说明酶的活性中心存在有关键性的谷氨酸及天冬氨酸,这一结果和4αGtase结构生物信息学分析结果相一致[8]。
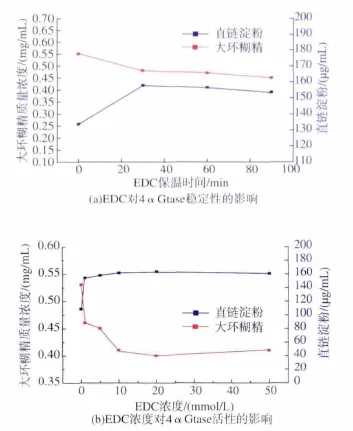
图5 (a)EDC对4αGtase稳定性的影响,(b)EDC浓度对4αGtase活性的影响Fig.5 (a)The effect of EDC on the stability of 4αGtase,(b)Effect of EDC concentration on the activity of 4αGtase
2.6 二硫键的化学修饰
向4αGtase中加入0.1 mmol/L的DTT,分别保温 30、60、90,结果见图 6(a)。由图 6(a)可以看出,在30 min的时间内,随着保温时间延长,大环糊精含量呈现明显下降趋势,而且直链淀粉含量呈现明显上升趋势,表明低浓度DTT修饰能够使4αGtase的环化活性及总酶活均降低。在30 min时,4αGtase的活性基本保持稳定,因此选择30 min作为修饰时间,进一步探讨DTT浓度对4αGtase活性的影响,结果见图5(b)。由图 5(b)可以看出,随着 DTT添加浓度提高到50 mmol/L,大环糊精质量浓度由0.23 mg/mL降低到0.1 mg/mL,环化活性降低了56.5%;直链淀粉质量浓度由 101 μg/mL升高到 177 μg/mL,总酶活降低了75.2%,这表明二硫苏糖醇还原了酶的二硫键后,破坏了酶的高级结构,影响酶的稳定性。

图6 (a)DTT对4αGtase稳定性的影响,(b)DTT浓度对4αGtase活性的影响Fig.6 (a)The effect of DTT on the stability of 4αGtase,(b)Effect of DTT concentration on the activity of 4αGtase
2.7 空间结构的化学修饰
向4αGtase中加入0.1 mmol/L的巯基乙醇,分别保温 30、60、90 min,结果见图 7(a)。 由图 7(a)可以看出,在90 min的修饰时间内,经巯基乙醇修饰的4αGtase环化活性及总酶活性基本保持稳定,因此选择30 min作为修饰时间,进一步探讨巯基乙醇浓度对4αGtase活性的影响,结果见图7(b)。由图7(b)可以看出,巯基乙醇浓度达到0.1 mmol/L时,4αGtase的环化活性几乎不变,总酶活增加了42.6%,表明空间结构的改变造成4αGtase催化区域以及与淀粉结合区域的变化不尽相同,再次证明了4αGtase也许同时存在催化区域和淀粉键合区域。
3 结语
在一定的条件下,4αGtase经DIC修饰后活性基本无明显变化;而经DEPC、EDC、DTT等修饰后4αGtase的环化活性及总酶活都有不同程度的下降,表明组氨酸、谷氨酸/天冬氨酸是构成4αGtase活性中心的关键氨基酸,二硫键对于维持4αGtase活性中心的空间结构具有重要作用;ChT、NBS、巯基乙醇等的修饰分别造成了总酶活不同程度的增加,而ChT修饰却导致环化活性下降、NBS修饰引起环化活性上升、巯基乙醇修饰对环化活性基本无影响,推测造成这个复杂现象的可能是酶分子同时存在淀粉键合区域和催化区域,蛋氨酸、色氨酸在两个区域存在状态不尽相同,空间结构的适当变换能够促进该酶与淀粉的结合,从而有利于总酶活的增加。
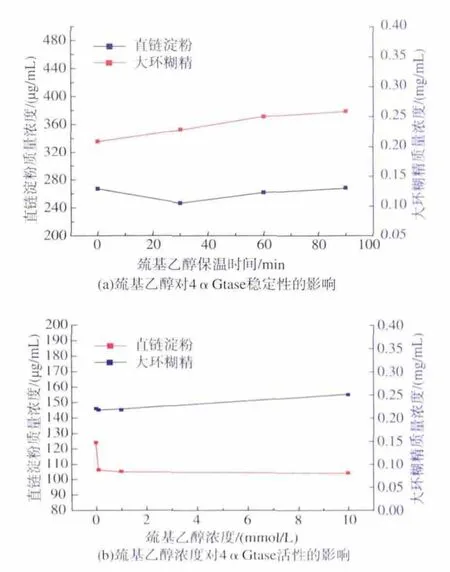
图7 (a)巯基乙醇对4αGtase稳定性的影响,(b)巯基乙醇浓度对4αGtase活性的影响Fig.7 (a)The effect of mercaptoethanol on the stability of 4αGtase, (b)Effect of mercaptoethanol concentration on the activity of 4αGtase
[1]Ueda H,Endo T.Large-ring cyclodextrins,In Cyclodextrins and their complexes[M].Weinheim:Wiley-VCH,2006:370-380.
[2]Furuishi T,Endo T,Nagase H,et al.Solubilization of C70 into water by complexation with δ -cyclodextrin[J].Chemical Pharmaceutical Bulletin,1998,46:1658-1659.
[3]Miyazawa I,Ueda H,Nagase H,et al.Physicochemical and inclusion complex production of δ -cyclodextrin[J].European Journal of Pharmaceutical Sciences,1995,3:153-162.
[4]Takeshi T,Molecular Y,Shigetaka O,et al.Disproportionating Enzyme(4-α-Glucanotransfera-se;EC 2.4.1.25)of Potato[J].The Journal of Biological Chemistry,1993,268:1391-1396.
[5]Miyazawa I,Ueda H,Nagase H,et al.Physicochemical and inclusion complex production of δ -cyclodextrin[J].European Journal of Pharmaceutical Sciences,1995,3:153-162.
[6]Wang J,Ji X,Jin Z,et al.Effects of fermentation conditions on the production of 4-α-glucanotransferase from recombinant Escherichia coli[J].African Journal of Biotechnology,2011,10(76):17519-17531.
[7]郭光辉,王金鹏,唐涛,等.产大环糊精制备条件优化[J].食品与发酵工业,2011,37(5):73-78.GUO Guang-hui,WANG Jin-peng,TANG Tao,et al.Optimization of the preparation of LR-CD[J].Food and Fermentation Industries,2011,37(5):73-78.(in Chinese)
[8]王金鹏.4α糖基转移酶环化活性定向控制及其大环糊精产物的分离及应用研究[D].无锡:江南大学,2011.
[9]张雨薇,杨雪鹏,魏东芝,等.生物电化学法转化甘油生产1,3-二羟基丙酮[J].食品生物技术学报,2012,3(31):266-270.ZHANG Yu-wei,YANG Xue-peng,WEI Dong-zhi,et al.Bio-electrochemical synthesis of 1,3-dihydroxyacetone from glycerol[J].Journal of Food Science and Biotechnology,2012,3(31):266-270.(in Chinese)

