离子交换法纯化α-酮戊二酸
占宏德 , 李江华 *1,, 刘 龙 , 堵国成 , 陈 坚
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
α-酮戊二酸(α-ketoglutarate,又 α-KG)作为三羧酸循环(TCA)的重要中间产物之一,在生物体内参与氨基酸、蛋白质、维生素的合成以及能量代谢,在各个领域有着重要的应用前景[1]。作为一种营养强化剂,α-KG可广泛应用于食品、医药、有机合成、化妆品和饲料等工业中。传统工业上,采用有机合成法生产α-KG,涉及一系列复杂的化学反应过程,从而存在原料来源、环境污染等方面的问题[2]。为此,国内外很多学者对微生物发酵法生产α-KG进行了研究。作者室通过研究,实现了发酵法生产α-KG[3],并在5 m3发酵罐上进行了中试。
离子交换法用于提取各种生物活性代谢物质具有成本低,工艺操作方便,提炼效率高,设备结构简单,以及节约大量的有机溶液等优点[4]。已有文献资料中也多见离子交换法用于有机酸等的提取。如李寅等[4]采用离子交换法从发酵液中提取丙酮酸;郑辉杰等[5]用离子交换法对发酵液中乳酸的提取工艺进行了研究;余炜等[6]采用离子交换法从发酵液中提取L-亮氨酸;王岸娜等[7]离子交换层析色谱法分离壳聚糖。α-KG发酵液中含有一定量的副产物丙酮酸,增加了纯化难度,有关α-KG的提取鲜有文献报道。作者以离子交换法对α-KG的提取纯化工艺进行了研究,为α-KG的提取与纯化提供理论参考。
1 材料与方法
1.1 试剂与仪器
离子交换树脂:201×7、202、213、D201、D202、D301,浙江杭州争光树脂有限公司生产;粉末状活性炭:国药集团化学试剂有限公司生产;丙酮酸及α-KG试剂:购自生工生物工程(上海)有限公司;α-KG发酵液:作者所在实验室发酵制备(发酵菌种:Yarrowia lipolytica WSH-Z06)。
高速冷冻离心机:HITACHI公司产品;恒温摇床:上海欣蕊自动化设备有限公司产品;烘箱:上海货德实验设备有限公司产品;电子天平:梅特勒-托利多仪器(上海)有限公司产品;UV2450紫外分光光度计:Shimadzu公司产品;HPLC高效液相色谱:Aglilen公司产品。
1.2 实验方法
1.2.1 发酵液预处理 采用静态法对发酵液进行脱色处理。发酵液脱色:将脱色前发酵液和脱色后发酵液进行全波长扫描,采取平均法来确定吸收波长[8]。采用单因素变量法优化脱色条件。在100 mL锥形瓶中加入25 mL发酵液,在不同的活性炭用量、pH、温度和脱色时间条件下,于恒温摇床上进行震荡脱色。测定脱色后发酵液的吸光度,计算脱色率:脱色率(%)=(脱色前发酵液吸光值-脱色后发酵液吸光值)/脱色前发酵液吸光值×100%
1.2.2 树脂的预处理及选型 树脂的预处理:见参考文献[9]。树脂的选型:通过静态试验来选择合适的树脂进行实验[4]。静态试验:准确量取已预处理好的离子交换树脂6 mL,分别放入内盛80 mL一定浓度的α-KG溶液的100 mL的锥形瓶中,在恒温摇床中28℃、200 r/min转速下震荡交换20 h,以减差法计算树脂平衡吸附量。
1.2.3 固定床动态吸附与洗脱 离子交换柱采用1×20 mm的玻璃层析住,树脂装填量为14 mL。将预处理过的发酵液进行上样,待树脂吸附饱和后,用超纯水洗去柱中残留的发酵液。然后用洗脱液进行洗脱。经过试验,采取阶段洗脱策略[10-11]。分别收集流出液、洗脱液,测定其中α-KG和丙酮酸含量,分析树脂的吸附情况以及α-KG和丙酮酸的分离情况。
1.2.4 分析方法 用HPLC法来检测α-KG和丙酮酸的含量[3]。将待测样品稀释一定倍数,过滤后,HPLC检测。流动相:5 mmol/L硫酸溶液(550 μL浓硫酸定容到2 L),用0.22 μm孔径的微滤膜抽滤并脱气。HPLC条件:Aminex HPX-87H ion exchange column,柱温:35 ℃,进样量:10 μL,流量:0.6 mL/min。检测器:紫外检测器;检测波长:210 nm。
2 结果与讨论
2.1 发酵液的脱色
2.1.1 吸收波长的确定 采用活性炭对发酵液进行脱色。将脱色前后的发酵液进行全波长扫描,如图1所示。全波长扫描图没有特征吸收峰,因此采用平均法[8],计算得到平均脱色率为64.4%,在440 nm到450 nm之间。不同波长下吸收光的颜色和观察到的颜色之间的关系,如表1所示。而发酵液颜色呈浅黄色偏橙色,故确定440 nm为检测波长。
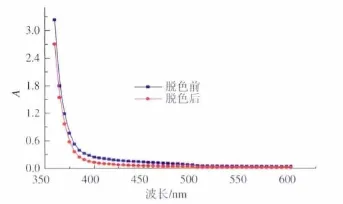
图1 全波长扫描Fig.1 Wavelength scanning

表1 吸收波长的颜色和观察到的颜色Table 1 Absorption of light color and observed color
2.1.2 活性炭用量对脱色效果的影响 活性炭用量对脱色效果的影响如图2所示。随着活性炭用量的增加,脱色率也不断增大,当活性炭用量为1.5 g/L时,脱色率达最大,为78.2%。故活性炭用量选择1.5 g/L。
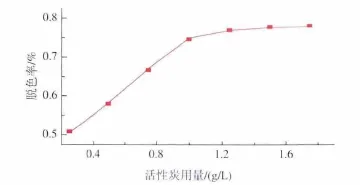
图2 活性炭用量对脱色率的影响Fig.2 Effect of carbon dosage on decolorization rate of fermentation broth
2.1.3 脱色时间对脱色效果的影响 脱色时间对脱色效果的影响如图3所示。脱色率在1 h时脱色率达到最大,为78.1%。随着时间的延长,脱色率反而下降。分析原因可能是随着脱色时间的延长,活性炭上吸附的色素物质会有一定程度的解吸附现象,直到吸附达平衡状态。故选择脱色时间为1 h。

图3 脱色时间对脱色率的影响Fig.3 Effect of time on decolorization rate of fermentation broth
2.1.4 温度对脱色效果的影响 温度对脱色效果的影响如图4所示。随着温度的升高,脱色率也逐渐增大,在温度达50℃后,脱色率变化趋于平缓。升高温度,能促进分子的运动,有利于提高活性炭的吸附效率。综合能耗考虑,选择脱色温度为50℃。
2.1.5 pH对脱色效果的影响 pH对脱色效果的影响如图5所示。随着pH值的降低,脱色率逐渐增大,在pH 3.0时,脱色率最高,为71.3%。故最佳脱色pH值为3.0。
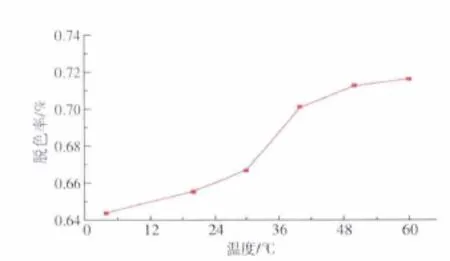
图4 温度对脱色率的影响Fig.4 Effect of temperature on decolorization rate of fermentation broth
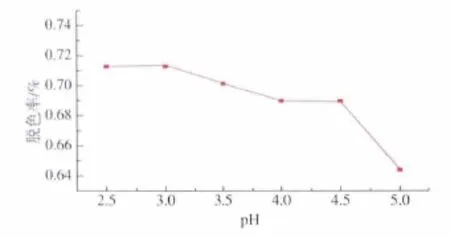
图5 pH对脱色率的影响Fig.5 Effect of pH on decolorization rate of fermentation broth
综合以上脱色条件,进行脱色验证,结果活性炭对发酵液的脱色率达到89.2%,脱色后的发酵液澄清透明带有少许浅橙黄色 (440 nm下吸光值为0.015)。
2.2 树脂的选型
通过静态吸附试验,得到各树脂吸附能力,如表2所示。其中弱碱大孔型树脂D301和强碱凝胶型树脂202对α-KG具有较大的吸附容量,但D301的吸附容量最大,为109.3 mg/mL。而弱碱性树在洗脱时较强碱性树脂脂更易于目标产物的洗脱。故选择弱碱大孔型树脂D301作为本实验的离子交换材料。
2.3 固定床上样条件优化
2.3.1 流量对流出曲线的影响 空间流量对流出曲线的影响如图6所示。随着上样流量的增加,固液接触时间变短,交换区域拉长,穿透点提前,流出曲线拉平展开,这不利于提高树脂的利用率。在实验范围内选择较低的流量2.67 BV/h较为合理。在实际生产中,可以根据实际情况,在上样开始阶段以高流量上样,之后选择低流量上样至穿透,可以在保证柱子利用率的前提下,适当提高生产效率。
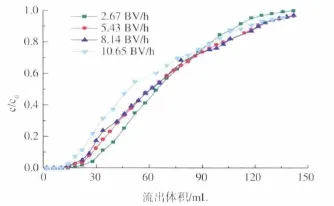
图6 不同流量对流出曲线的影响Fig.6 Effect of space velocity on the effluent curve
2.3.2 质量浓度对流出曲线的影响 上样质量浓度对流出曲线的影响如图7所示。当质量浓度较低为9.03 g/L时,曲线拉平展开,交换区间拉长;当质量浓度为20.3 g/L和33.9 g/L时,曲线前半部分变化趋势相似,但质量浓度为33.9 g/L时,曲线严重拖尾。分析原因可能是因为柱子体积较小导致吸附容量有限所致。故在实验范围内,α-KG的上样质量浓度选择为20 g/L较为合理,实际生产中可根据固定床大小来选择其合适的上样质量浓度。

图7 不同上样质量浓度对流出曲线的影响Fig.7 Effect of concentration of α-KG on the effluent curve
2.3.3 装填高度对流出曲线的影响 在不同的装填高度条件下进行上样,得到流出曲线,如图8所示。分析图中曲线发现,不同的径高比对流出曲线变化趋势的影响不大。当径高比为1∶24时,流出曲线坡度相对较缓,交换区域相对拉长,出现拖尾现象。分析原因可能主要是由于树脂装填不严实所致。故在实验条件下,选择径高比为1∶12较好。
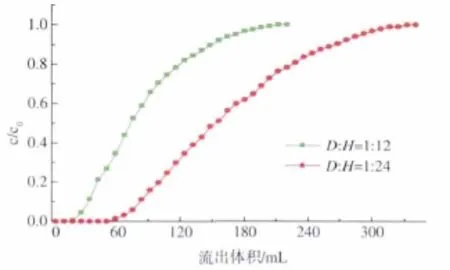
图8 径高比对流出曲线的影响Fig.8 Effect of resin height on the effluent curve
2.4 洗脱条件优化
由于发酵液中存有较高比例的丙酮酸,故将二者分离是α-KG纯化过程中最关键的一步。经过试验,确定采取阶段洗脱策略来分离α-KG。
第一阶段采用混合洗脱剂低浓度 (0.01 mol/L NaCl和0.01 mol/L HCl混合液)下进行洗脱,在损失一定量的α-KG的同时,将丙酮酸大量洗脱下来;第二阶段则用HCl一次洗脱,可得到较纯的α-KG溶液。收集洗脱液,测定其中α-KG和丙酮酸的含量,得到阶段洗脱曲线,如图9所示。第一阶段洗脱体积240 mL,第二阶段洗脱体积150 mL。在第二阶段洗脱液中,丙酮酸的含量几乎为零,α-KG的纯化效果较好。分析图9发现,洗脱液中所含丙酮酸的比例要远远低于原始发酵液中丙酮酸的含量,说明D301树脂对α-KG的吸附选择性较大。

图9 阶段洗脱曲线Fig.9 Stepwise elution curve
对第二阶段洗脱液浓度和洗脱流量进行了优化,如图10所示。当洗脱流量为6 BV/h,洗脱剂浓度为0.3 mol/L HCl时,洗脱峰较集中,且峰高较大,洗脱效果最佳。

图10 不同流量对第二阶段洗脱曲线的影响Fig.10 Effect of elution velocity on elution curve
2.5 洗脱验证
上样至刚好穿透,记上样体积V0,收集上样流出液和洗柱液V1,第一阶段洗脱液V2,第二阶段洗脱液V3,测定其中α-KG和丙酮酸的含量,计算得率,结果如表3所示。在第一阶段洗脱时,丙酮酸洗脱量为56.74 mg,远远大于α-KG的洗脱量6.21 mg;第二阶段中,α-KG 大量洗脱,为93.67 mg。在上述阶段洗脱策略下,最终α-KG收率达93.2%。在93.67 mg α-KG中含丙酮酸9.59 mg,由初始发酵液中α-KG与丙酮酸质量比1.5∶1提高到10∶1,更有利于后续的结晶。如果延长第一阶段洗脱时间,则最终α-KG纯度可进一步提高至完全不含丙酮酸,但α-KG的收率会有所下降。对比V0和V1中α-KG和丙酮酸的含量可知,D301树脂对α-KG的吸附选择性较大。因此可以设计串联柱过量上样,然后分柱洗脱,有助于α-KG和丙酮酸的分离。

表3 纯化结果验证Table 3 Consequence of purification
3 结语
通过全波长扫描,采取平均法确定检测波长为440 nm。用活性炭对发酵液进行脱色,在活性炭用量1.5 g/L、pH 3.0、脱色时间 1 h、脱色温度 50℃的条件下,脱色率可达89.2%。通过静态试验,选择吸附量最大的弱碱大孔型树脂D301为实验用离子交换树脂。上柱条件优化表明,在发酵液中α-KG质量浓度20 g/L、较低的流量(2.67 BV/h)和较小的装填高度(D∶H=1∶12)时,上样吸附效果最好。 采用阶段洗脱:第一阶段用0.01 mol/L的NaCl和0.01 mol/L的HCl混合溶液进行洗脱,第二阶段采用0.3 mol/L的HCl溶液进行洗脱,洗脱流速6 BV/h。在此工艺条件下验证,洗脱液中α-KG与丙酮酸的质量比由初始发酵液中的 1.5∶1 提高为 10∶1,α-KG 收率可达93.2%,纯化效果较好。该工艺可较好的纯化α-KG,但依然存在一定的损失,而且丙酮酸完全浪费,可进一步尝试其他洗脱策略,提高α-KG收率,并尽可能分离出丙酮酸,实现副产物的利用。
[1]Sauer M,Porro D,Mattanovich D,et al.Microbial production of organic acids:expanding the markets[J].Trends Biotechnol,2008,26(2):100-108.
[2]Zhang D,Liang N,Shi Z,et al.Enhancement of α-ketoglutarate production in Torulopsis glabrata:Redistribution of carbon flux from pyruvate to α-ketoglutarate[J].Biotechnology and Bioprocess Engineering,2009,14(2):134-139.
[3]YU Zong-zhong,DU Guo-cheng,ZHOU Jing-wen,et al.Enhanced a-ketoglutaric acid production in Yarrowia lipolytica WSHZ06 by an improved integrated fed-batch strategy[J].Bioresource Technology,2012,114:597-602
[4]李寅,傅为民,陈坚.离子交换法从发酵液中提取丙酮酸[J].无锡轻工大学学报,2001,20(4):335-339.LI Yin,FU Wei-ming,CHEN Jian.Extract pyruvate from fermatation borth by Ion-exchange[J].Journal of Wuxi University of Light Industry,2001,20(4):335-339.(in Chinese)
[5]郑辉杰,李志强,何姗,等.离子交换法提取发酵液中乳酸的工艺研究[J].食品科学,2009,30(6):84-87.ZHEN Hui-jie,LI Zhi-qiang,HE Shan,et al.Study on extraction process of lactic acid from fermentation broth with anionic resin[J].Food Science,2009,30(6):84-87.(in Chinese)
[6]余炜,伍时华,王恒山,等.离子交换法分离提取发酵液中L-亮氨酸[J].化学世界,2005,46(2):109-113.YU Wei,WU Shi-hua,WANG Heng-shan,et al.Separating and abstracting L-leucine from fermentation liquok with ion exchange[J].Chemical World,2005,46(2):109-113.(in Chinese)
[7]王岸娜,王璋,许时婴.离子交换层析色谱法分离壳聚糖[J].无锡轻工大学学报,2003,22(6):75-80.WANG An’na,WANG Zhang,XU Shi-yin.Study on the separation of chitosan by ion exchange chromatography[J].Journal of Wuxi University of Light Industry,2003,22(6):75-80.(in Chinese)
[8]楼良旺,高年发.丙酮酸发酵液脱色工艺的研究[J].广州食品工业科技,2004,20(3):12-14.LOU Liang-wang,GAO Nian-fa.Decolorization of pyruvate fermentation broth[J].Guangzhou Food Science and Technology,2004,20(3):12-14.(in Chinese)
[9]石慧东.离子交换法提取赖氨酸的研究[D].无锡:无锡轻工大学,1996.
[10]阮文辉.离子交换法分离纯化5’-三磷酸胞苷的研究[D].南京:南京工业大学,2004.

