不同处理时间的静磁场对体外培养大鼠成骨细胞成熟分化及雌激素受体基因表达的影响
王嘉琪,马小妮,周 建,葛宝丰,郭晓宇,陈克明
兰州军区兰州总医院骨科研究所,兰州730050
骨代谢是一个由成骨细胞的骨形成和破骨细胞的骨吸收构成的动态平衡的过程。1987年,Gray等[1]首次在体外培养成骨细胞上发现了雌激素受体(estrogen receptor,ER),揭示了雌激素对成骨细胞的直接影响。此外,电磁场已被证明能影响机体骨代谢,并广泛应用于临床上多种骨骼相关疾病的预防和治疗[2-3]。自 Yasuda等[4]发现骨具有压电效应以来,许多学者致力于低频磁场治疗骨质疏松的理论和实践研究,但尚未见有关电磁场与ER关系的报道。本研究以原代培养的大鼠颅骨成骨细胞为研究对象,探讨不同处理时间的静磁场 (static magnetic fields,SMFs)对体外培养成骨细胞ER的影响,以期为SMFs的临床应用提供依据。
材料和方法
SMFs发生仪实验所用SMFs发生仪由本研究组与兰州理工大学共同研制,线圈内径为180 mm,频率、磁感应强度均精确可调。磁感应信号经计算机控制程序产生后,经过信号放大器放大后传入磁场线圈,基本原理如图1[5]。经中国人民解放军兰州军区医学计量测试研究站测定表明,SMFs发生仪运行期间磁场环境均匀稳定 (报告编号:医计磁字ccqd-2008-01)。仪器经紫外线照射消毒后放入细胞培养箱内,由导线与外部控制装置相连。实验期间培养箱内CO2水平为5%,温度控制在 (37±0.2)℃,湿度为100%。
大鼠、主要试剂及仪器出生48 h内的SPF级SD大鼠10只 [甘肃省中医学院动物实验中心,合格证号SCXK(甘)2004-0006-152];胎牛血清 (fetal bovine serum,FBS,兰州民海生物公司),α-MEM培养基、Ⅱ胶原酶 (美国Gibco公司),地塞米松、磷酸化抗坏血酸、β-磷酸甘油钠、胰蛋白酶 (美国Sigma公司),噻唑蓝 (methyl thiazolyl tetrazolium,MTT,美国Sigma公司),SYBR®Premix Ex TaqTMⅡ、荧光染料、PCR正向引物、PCR反向引物 (大连宝生物公司),碱性磷酸酶试剂盒 (南京建成生物工程研究所)、茜素红 (美国AMRESCO公司);CO2细胞培养箱 (美国Thermo Fisher公司),倒置相差显微镜(日本OLYMPUS),紫外分光光度计、台式高速冷冻离心机 (德国Heraeus公司),实时荧光定量PCR仪(美国ABI公司)。
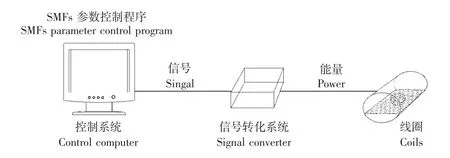
图1 静磁场发生仪图解Fig 1 Schematic of static electromagnetic fields device
成骨细胞分离培养将SD大鼠以75%酒精浸泡窒息后断头,无菌条件下取出头盖骨,置入盛有培养基的无菌培养皿中,去除骨膜、血管及结缔组织,磷酸盐缓冲液 (phosphate buffer saline,PBS)漂洗2次,加入0.25%胰酶于37℃下消化15 min,吸除消化液,再加入0.1% Ⅱ型胶原酶37℃下消化4次,每次20 min,收集并合并消化液,用200目细胞筛过滤,过筛后的消化液离心10 min(1000 r/min,r=11.18 cm),弃上清液,沉淀用 PBS漂洗后用含有10%FBS的α-MEM培养基悬浮,吹打均匀后,调整细胞浓度至3×104/ml。置于37℃、5%CO2培养箱中培养,每3天换液1次。待细胞生长融合至80%以上时,0.25%胰蛋白酶消化传代,传代后待单层细胞融合率达到80%以上时进行成骨性诱导。
成骨细胞鉴定将传代后的成骨细胞接种于35 mm的中皿,实验组和对照组分别进行碱性磷酸酶染色和钙化结节染色。碱性磷酸酶染色方法参考文献[6],磁场暴露处理至第8 d时进行偶氮偶合染色,待出现紫色斑点后停止染色,观察并照相记录结果。茜素红钙化结节染色方法参考文献 [6],磁场处理至第12 d,弃培养液,PBS冲洗两次,加入10%福尔马林固定10 min,弃固定液,加入pH 8.9、0.1%的茜素红染色液,37℃水浴1 h,流水冲洗,换固定液,照相记录结果。
细胞分组与磁场处理将第1代传代细胞 (passage 1,P1)分为9组,每组3个重复,用磁场强度为3.9 mT的SMFs分别处理0(对照组)、0.5、1.0、1.5、2.0、2.5、3.0、3.5和4.0 h。磁场中使用电子测温计实时监测电磁场线圈中的温度,使其始终保持在 (37±0.2)℃,排除热效应对培养细胞的影响。
细胞增殖分析将P1代细胞以3×104/ml接种于60 mm培养皿,24 h后每组分别用SMFs处理,对照组不用磁场处理。48 h后弃培养液,换为含10%MTT的无血清培养基,继续培养4 h。弃培养液,加入DMSO摇床震荡10 min,待紫色结晶沉淀彻底溶解后,于酶标仪上测定490 nm处的光密度 (optical density,OD)值。
骨钙素含量的测定成骨诱导培养后每3 d换液1次,每次换液时留取1 ml旧培养液,于-20℃保存,待SMFs处理后各时间点的样品收集齐全后,采用酶联免疫吸附法检测SMFs处理第3、6、9、12天的骨钙素分泌量,以μg/孔表示。
逆转录实时PCR分析分别在成骨性诱导培养0、24、48和72 h时提取总RNA,检测ERα和ERβ的mRNA表达水平。所用引物均委托宝生物 (大连)公司根据GenBank所发布的序列设计并合成(表1),总RNA的提取采用TRIzol,紫外分光光度计检测浓度,并用1%甲醛变性琼脂糖电泳检测其完整性。调整总RNA的浓度至50 mg/L,取2μl进行逆转录。逆转录体系包括5×缓冲液4 μl,酶混合物1 μl,50 μmol/L 寡核苷酸引物 1 μL,100 μmol/L 随机引物1 μL,总 RNA 2 μl,用 RNA 无酶水定容至20 μl。混匀后离心 30 s(3000 r/min,r=6.7 cm),37℃ 15 min,85℃ 5 s,4℃ 5 min,取出置于-20℃保存备用。PCR反应体系为 20 μl,包括:SYBR Premix Ex TaqTM Ⅱ (2 × )10 μl、10 μmol/L 正向引物 0.8 μl、10 μmol/L 反向引物 0.8 μl、50 × 染液0.4 μl、模版 cDNA 2 μl、蒸馏水 6 μl。反应条件为95℃预变性30 s,95℃变性5 s,60℃退火31 s,进行40个循环,每个循环的延伸末收集荧光信号。随后缓慢升温,95℃15 s,60℃1 min,95℃15 s,温度变化速度为0.1℃/s,进行PCR反应,制备标准曲线。经内参校正,得到目的基因的相对表达水平。
统计学处理采用SPSS 18.0统计软件,结果均以均数±标准差表示,采用方差分析检验各组间是否有显著性差异,当存在有统计学意义的差异时,采用多参数单因素方差分析检验各均数间差异是否有统计学意义,P<0.05为差异有统计学意义。
结 果
成骨细胞鉴定结果培养之初细胞呈三角形、纺锤形或多角形,48 h后数量明显增加,体积增大,3~4 d细胞有克隆形态 (图2A)。细胞培养8 d后碱性磷酸酶组织化学染色鉴定呈阳性 (图2 B);细胞培养12 d后茜素红染色鉴定呈阳性 (图2 C)。

表1 逆转录实时PCR的引物序列Table 1 The primer sequences of reverse transcription-real time polymerase chain reaction

图2 成骨细胞形态 (×100)Fig 2 Characterization of osteoblasts(×100)
对细胞增殖的影响与对照组比较,SMFs处理2.0 h组和3.0 h组的细胞增殖显著增加 (P<0.05),2.5 h组的细胞增殖增加也有统计学意义 (P<0.01),其他各组的差异均无统计学意义 (表2)。
对骨钙素的影响各组骨钙素的含量第3~9天呈升高趋势,第12天略有下降。SMFs处理第3天时,2.5 h组的骨钙素含量显著高于1.5 h组 (P<0.05)。SMFs处理第6天时,1.0 h组骨钙素含量显著高于对照组 (P<0.05),1.5 h、2.0 h、2.5 h和3.0 h组也显著高于对照组 (P<0.01),2.5 h组骨钙素含量显著高于 0.5 h、1.0 h、1.5 h、2.0 h、3.5 h和4.0 h组 (P<0.05)。SMFs处理第9天时,1.0 h、1.5 h、2.0 h、2.5 h和3.0 h组骨钙素含量显著高于对照组 (P<0.05),2.5 h组骨钙素含量显著高于0.5、1.0和3.0 h组 (P<0.01)。SMFs处理第12天时,2.5 h组骨钙素含量显著高于对照组、1.5 h组和4.0 h组 (P<0.05)(图3)。
表2 磁场处理48 h后细胞增殖结果 (±s)Table 2 MTT test results after 48h of SMFs treatment(±s)

表2 磁场处理48 h后细胞增殖结果 (±s)Table 2 MTT test results after 48h of SMFs treatment(±s)
OD490:490 nm吸光值OD490:optical density value at 490 nm
组别Group样本含量Sample number OD490P 0 h 3 2.369±0.0640 —0.5 h 3 2.367±0.1111 0.9789 1.0 h 3 2.304±0.0461 0.3536 1.5 h 3 2.287±0.1974 0.4902 2.0 h 3 2.432±0.0519 0.0221 2.5 h 3 2.591±0.0419 0.0084 3.0 h 3 2.463±0.0960 0.0387 3.5 h 3 2.333±0.3581 0.8675 4.0 h 3 2.507±0.1268 0.0740
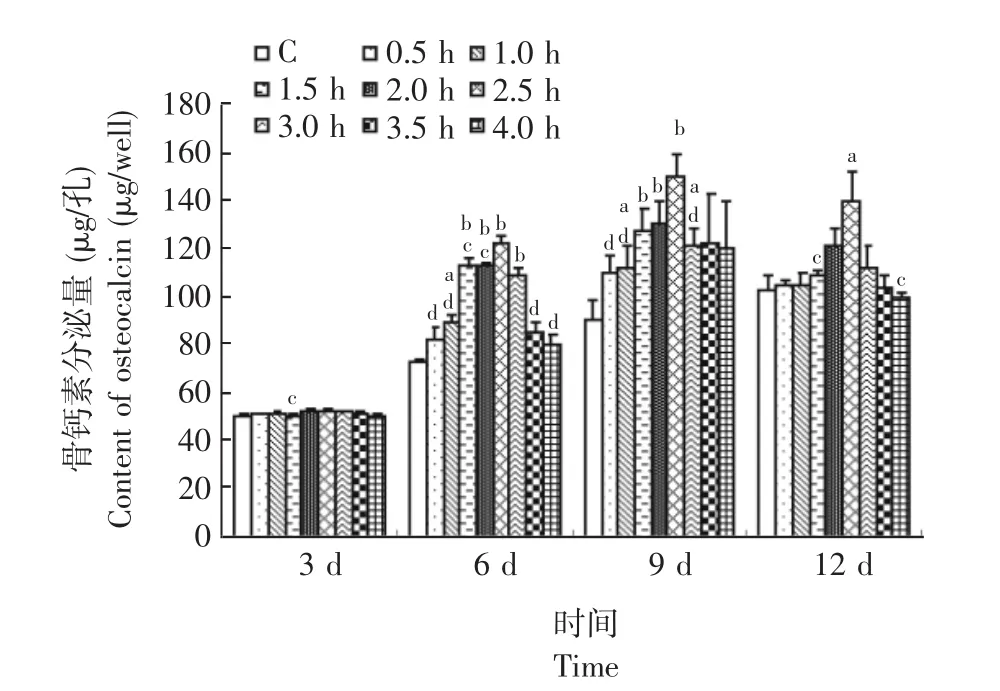
图3 磁场处理后骨钙素含量的变化Fig 3 The content of osteocalcin in SMFs treated rat osteoblasts
实时荧光PCR实验结果SMFs处理成骨细胞0 h后,与对照组比较,1.0 h、2.5 h、3.0 h和3.5 h组的ERα mRNA的表达水平显著升高 (P<0.05),SMFs处理组之间比较,2.5 h组的ERα mRNA表达水平显著高于1.5 h、2.0 h、3.5 h和4.0 h组 (P<0.05)。SMFs处理 24 h后,0.5 h、1.5 h、2.0 h、3.0 h和3.5 h组的ERα mRNA表达量显著低于对照组 (P<0.05),2.5 h组的ERα mRNA表达水平显著高于0.5 h、1.5 h、2.0 h、3.0 h和 3.5 h组 (P<0.01)。SMFs处理 48 h后,1.0 h、1.5 h、2.0 h、2.5 h和3.0 h组的ERα mRNA表达水平显著低于对照组 (P<0.05),2.5 h组显著高于0.5 h、2.0 h和3.0 h组 (P<0.05)。SMFs处理72 h后,1.0 h、1.5 h和2.5 h组ERα mRNA表达水平显著高于对照组 (P<0.05),而3.0 h、3.5 h和4.0 h组显著低于对照组 (P<0.05);2.5 h组的ERα mRNA表达水平显著高于其他7个SMFs处理组 (P<0.05)(图4)。
SMFs处理成骨细胞0 h后,除了2.5 h组 ERβ mRNA的表达显著高于对照组外 (P<0.01),其他各组的ERβ mRNA表达均受到不同程度的抑制,而2.5 h组的ERβ mRNA表达水平显著高于其他SMFs处理组 (4.0 h组除外,P<0.05)。SMFs处理24 h后,除2.0 h和2.5 h组外,各SMFs处理组的ERβ mRNA表达水平均显著低于对照组 (P<0.05)。SMFs处理48 h后,0.5 h、2.5 h和3.5 h组ERβ mRNA表达显著高于对照组 (P<0.01),1.5 h、2.0 h、3.0 h和4.0 h组的ERβ mRNA表达显著低于对照组 (P<0.05);2.5 h组ERβ mRNA的表达显著低于0.5 h组 (P<0.01),而显著高于1.0 h、2.0 h、3.0 h、3.5 h和4.0 h组 (P<0.05)。SMFs处理72 h后,各SMFs处理组的ERβ mRNA表达水平均显著低于对照组组 (P<0.05);2.5 h组的ERβ mRNA表达水平显著低于0.5 h、1.0 h、2.0 h、3.5h和4.0 h组 (P<0.05)(图5)。
讨 论
成骨细胞是骨中占主导地位的细胞,是机械和电刺激通过连接间隙传送信号的基本条件[7],也是骨发生和骨形成的物质基础,在骨组织的更新活动中是最重要的功能细胞。电磁场具有促成骨效应,临床上已被用于缓解骨质疏松症状,促进骨折愈合,治疗骨不连、骨移植、骨坏死等[8]。有大量证据表明骨再生与雌激素样作用有着不可分割的联系[9-10],但有关SMFs不同处理时间对成骨细胞ER的影响仍存在争议。本研究观察了强度为3.9 mT、处理时间分别为 0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 h的SMFs对成骨细胞成熟分化及雌激素受体ERα和ERβ基因表达的影响。
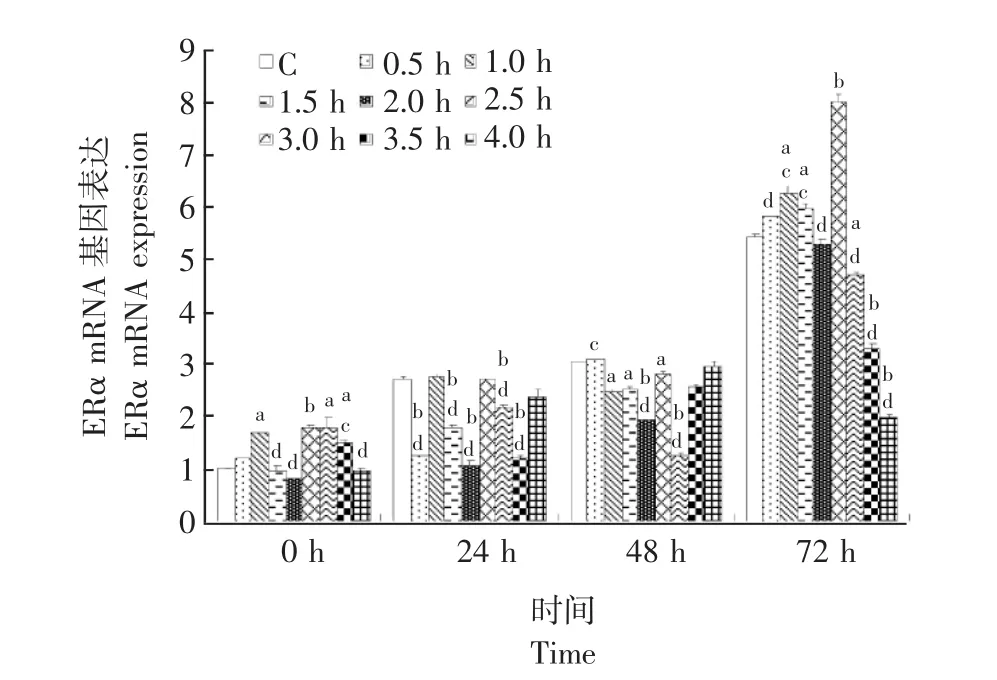
图4 SMFs对ERα mRNA表达水平的影响Fig 4 Effect of SMFs on ERα mRNA expression in SMFs-treated rat osteoblasts
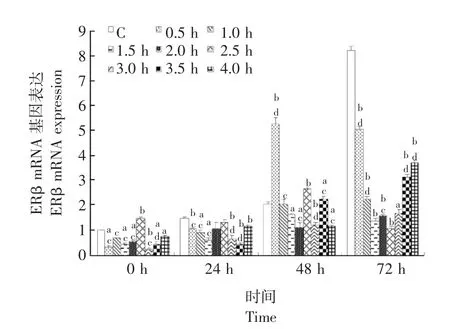
图5 SMFs对ERβ mRNA表达水平的影响Fig 5 Effect of SMFs on ERβ mRNA expression in SMFs-treated rat osteoblasts
细胞增殖是生物最根本、最基础的生命活动,是个体生长和生命延续的基本保障。外界的刺激会使细胞周期发生变化,影响细胞增殖,而成骨细胞的增殖对于骨缺损、骨不连等骨病非常重要[11]。Kotani等[12]将大鼠成骨细胞MC3T3-El暴露于8 T强静磁场60 h,结果显示高强度磁场能通过增强碱性磷酸酶的活性来促进成骨细胞分化,但对成骨细胞的增殖并无明显影响。与此结果不同,本研究发现,SMFs处理成骨细胞2.0、2.5、3.0 h时,可显著促进细胞增殖。
由成骨细胞分泌的骨钙素被认为是评价成骨功能的特异指标,直接反映成骨细胞的活性和骨生理代谢变化[13],骨钙素可能参与调节钙代谢,在骨组织发育中发挥钙化作用,促进骨基质成熟,在骨质疏松发生发展过程中的作用受到较多关注。本研究结果表明,SMFs的处理时间对成骨细胞的骨钙素含量有一定影响,其中SMFs处理2.5 h时骨钙素含量的变化最为明显。
雌激素通过与成骨细胞上的ER特异性结合,能直接增强成骨细胞功能,从而促进骨形成,调节雌激素与骨吸收、骨形成之间的关系,从而对骨代谢及骨重建起到重要的调控作用,因此ER是骨质疏松症发生过程中的关键物质[14]。杨永红等[15]认为低频脉冲电磁场对骨质疏松的预防性治疗作用机理不是通过提高雌激素水平途径实现的。本研究结果表明,SMFs的处理时间对成骨细胞ERα和ERβ的基因表达有一定的影响。在SMFs处理成骨细胞0 h时,1.0 h、2.5 h、3.0 h和3.5 h组 ERα mRNA表达量显著高于对照组;处理72 h时,1.0 h、1.5 h和2.5 h组ERα mRNA表达量显著高于对照组。与之相反,SMFs处理 0 h时,0.5 h、1.5 h、2.0 h、3.0 h、3.5 h和4.0 h组ERβ mRNA表达量显著低于对照组;处理72 h时,所有磁场处理组ERβ mRNA表达量均显著低于对照组。这一结果提示ERα和ERβ在成骨细胞中的共同表达调控作用,且ERα和ERβ的表达调控方向相反。
本研究探讨了SMFs对体外培养成骨细胞增殖、分化及ER基因表达水平的影响,发现在采用SMFs处理体外培养成骨细胞时,处理时间为2.5 h时的作用效果最为明显。以本研究结果为基础,进一步探索电磁场与ER表达之间的关系,有望为磁场治疗骨质疏松症提供细胞水平的实验依据。
[1]Gray TK,Flynn TC,Gray KM,et a1.17 beta-estradiol acts directly on the clonal osteoblastic cell line UMR106[J].Pro Natl Acad Sci USA,1987,84(17):6267-6271.
[2]Inoue N,Ohnishi I,Chen D,et al.Effect of pulsed electromagnetic fields(PEMF)on late-phase osteotomy gap healing in a canine tibial model[J].J Orthop Res,2002,20(5):1106-1114.
[3]Funk RH,Monsees TK.Effects of electromagnetic fields on cells:physiological and therapeutical approaches and molecular mechanisms of interaction [J].Cells Tissues Organs,2006,182(2):59-78.
[4]Yasuda I.Fundamental aspects of fracture treatment[J].J Kyoto Med Soc,1953,4:395-397.
[5]周建,陈克明,葛宝丰,等.50Hz 1.8mT电磁场对成骨细胞增殖与分化成熟影响的波形比较研究 [J].生物化学与生物物理进展,2011,38(10):967-974.
[6]王胜国,周力,陈扬熙,等.不同强度静磁场对成骨细胞细胞内钙离子浓度的影响 [J].第三军医大学学报,2010,32(23):2515-2518.
[7]Chang WH,Chen LT,Sun JS,et al.Effect of pulse burst electromagnetic fields stimulation osteoblast cell activities[J].Bioelectromagnetics,2004,25(6):457-465.
[8]Bassett CA.Beneficial effects of electromagnetic fields[J].J Cell Biochem,1993,51(4):387-393.
[9]张聪,林嘉滨,等.雌激素对老年雄性大鼠植入骨新形成的影响[J].中华内科杂志,2000,39(10):686-689.
[10]周轶琳,赵敏,杨杏芬,等.雌激素对去卵巢大鼠生长发育及骨代谢影响 [J].中国公共卫生,2008,24(2):244-245.
[11]周通华,戴闽,邹文楠.静磁场对成骨细胞生物学影响机制的研究进展[J].南昌大学学报:医学版,2010,50(6):100-102.
[12]Kotani H,Kawaguchi H,Shimoaka T,et a1.Strong static magnetic field stimulates bone formation to a definite orientation in vitro and in vivo [J].J Bone Miner Res,2002,17(10):1814-1821.
[13]杨梅芳,李振甲,朱守荣,等.骨钙素RIA试剂盒研发及其临床应用 [J].中华核医学杂志,1994,14(3):167-169.
[14]侯宁宁,朱依敏,黄荷凤.雌激素受体α和β在不同雌激素干预大鼠骨代谢中的表达 [J].分子细胞生物学报,2006,39(4):289-295.
[15]杨永红,何成奇,杨霖,等.不同强度脉冲电磁场对去势大鼠血清雌二醇的影响 [J].四川大学学报:医学版,2008,39(2):256-258.

