铁过载催化的氧化应激对骨髓间充质干细胞的影响及其作用机制
卢文艺,赵明峰,Sajin Rajbhandary,赵 楠,谢 芳,肖 霞,穆 娟,李玉明
天津医科大学一中心临床学院 天津市第一中心医院血液科,天津 300192
铁过载是指由于大量铁在体内过度沉积而导致心、肝、胰等重要脏器结构受损、功能障碍[1]。大量临床资料已经证明铁过载可损伤骨髓的造血功能,近期又有研究报道这可能是由于铁诱导的大量活性氧 (reactive oxygen species,ROS)影响造血干细胞和祖细胞的功能[2-7]。目前尚不清楚铁过载对骨髓微环境有无影响。作为骨髓微环境的重要成分,间充质干细胞 (mesenchymal stem cells,MSCs)可通过分泌多种细胞因子和生长因子,形成非造血基质组织来支持骨髓造血,铁过载有可能通过影响MSCs来损伤骨髓的造血功能。本研究观察了铁过载后MSCs增殖及凋亡的变化,并探索其相关机制,试图找到治疗铁过载疾病的新的突破点。
材料和方法
主要试剂、设备和骨髓标本 低糖DMEM培养基(L-DMEM)、胎牛血清(fetal bovine serum,FBS)、0.25%胰酶均购自美国Gibco公司,FACSCalibur流式细胞仪及鼠抗人单克隆抗体CD34、CD45、CD90抗体均为美国BD公司产品,枸橼酸铁铵 (ferric ammonium citrae,FAC)购自美国Sigma公司,ROS检测试剂盒购自上海碧云天生物技术公司,AnnexinV-FITC流式细胞术检测试剂盒购自上海美季公司,蛋白激酶B(protein kinase B,AKT)、磷酸化p38丝裂原活化蛋白激酶(phosphorylated p38 mitogen activated protein kinase,P-p38MAPK)、p38MAPK兔单抗均购自美国Cell Signaling Technology公司,p53兔多抗购自美国Santa Cruz Technology公司,α-微管蛋白兔单抗购自美国Epitomics公司,辣根过氧化物酶 (horse radish peroxidase,HRP)标记的鼠抗兔抗体购自Jackson ImmunoResearch Laboratories公司,多功能酶标仪为美国 BioTek公司产品,TH4-200型荧光倒置显微镜为日本Olympus公司产品。
骨髓标本取自天津市第一中心医院胸外科非血液病患者手术切除的未受累肋骨,肝素抗凝。
MSCs的培养及鉴定 取新鲜骨髓液4 ml,用淋巴细胞分离液分离提取单核细胞层,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2次。用完全培养液 (含15%FBS、100 U/ml青霉素、100 U/ml链霉素的L-DMEM培养液)调整细胞密度至1×106/ml,接种于25 cm2的培养瓶中,于37℃、5%CO2饱和湿度培养箱中培养。4~5 d后已有少量细胞贴壁呈梭形,首次全量换液,去除未贴壁细胞,以后每3 d换液一次。培养14 d后,细胞融合率达到80%~90%,用含0.1%乙二胺四乙酸 (ethylene diamine tetraacetic acid,EDTA)的胰酶消化细胞,并按1∶2进行传代,取3~5代的MSCs进行后续实验。MSCs的纯度通过流式细胞仪免疫标记法 (CD34、CD45、CD90)鉴定。
铁过载模型的建立及鉴定 用PBS溶解的FAC提供Fe3+离子,向实验组细胞的培养液内加入不同浓度的FAC(100、200、400 μmol/L)培养12、24、48 h后观察细胞生长状态,消化细胞后行台盼蓝染色。根据此步骤结果选取FAC的最佳作用浓度和时间来处理MSCs,利用不稳定铁可以淬灭钙荧光素乙酰氧基甲酯(calcein-acetoxymethylester,calcein-AM)的原理,依据参考文献[8]的方法检测细胞内不稳定铁池 (labile iron pool,LIP)的含量:用胰酶消化细胞,PBS洗涤2次后重悬细胞于PBS中,加入calcein-AM,使其终浓度为0.125 μmol/L,37℃避光温育15 min,用PBS洗涤2次后,采用流式细胞仪检测细胞的平均荧光强度值 (mean fluorescence intensity,MFI)。
ROS的测定 2',7'-二氯荧光黄双乙酸盐 (dichlorofluorescin diacetate,DCFH-DA)为非荧光脂类可渗透性成分,能被细胞内的ROS氧化生成非渗透性荧光成分DCF,故DCF的荧光强度与细胞内ROS水平成正比。本实验采用参考文献 [9]的方法,在此基础上略加改进:将MSCs以1×105/ml的密度接种于六孔板上,分别加入100、200、400 μmol/L FAC处理细胞后,PBS洗涤2次,加入 DCFH-DA,使其终浓度为10 μmol/L,处理细胞15 min后洗涤3次,直接在荧光显微镜下观察各组荧光的强弱。每孔加入细胞裂解液700 ul,37℃摇床裂解细胞10 min后将混匀的裂解液加入到96孔板中,用荧光酶标仪检测荧光强度 (激发波长为488 nm,吸收波长为530 nm),结果采用Gene5软件进行分析。
MSCs的群体倍增时间 取对数生长期的MSCs,以4×104/孔的密度接种于12孔板上,在37℃温箱中培养,当细胞达到80%~90%融合时,用胰酶消化传代。按以下公式计算MSCs的倍增时间 (doubling time,DT):DT=CT×log2/log(X1/X0),其中X0是细胞最初的数量,X1是细胞最终的数量,CT是细胞培养时间。
Annexin V-PI双标法检测细胞凋亡 按照试剂盒说明进行操作,用不含EDTA的胰酶消化MSCs,用PBS洗涤细胞2遍,悬于结合缓冲液,调整细胞密度至1×106/ml。取400 μl细胞悬液于流式管中,加入5 μl Annexin V-FITC 4℃避光孵育15 min后,再加入10 μl碘化丙啶 (propidium iodide,PI)在4℃下避光孵育5 min,用流式细胞仪检测细胞凋亡率。
Western blot检测 收集1×106个 MSCs,用预冷的PBS洗涤2遍,冰上裂解细胞,提取总蛋白。将提取的蛋白以30~100μg的上样量行聚丙烯酰胺凝胶电泳,然后转移到聚二氟乙烯膜上,用含5%牛血清蛋白的TBST缓冲液室温封闭1 h后,4℃过夜,分别孵育兔单抗AKT、P-p38MAPK、p38MAPK、α-微管蛋白 (1∶1000)和兔多抗p53(1∶250),洗膜后室温下以 HRP-鼠抗兔抗体 (1∶5000)孵育2 h。抗原抗体复合物采用增强化学发光法显色,暗室X胶片曝光后采用Image-Pro Plus图像分析软件分析蛋白条带的灰度值,将目的蛋白与内参α-微管蛋白的灰度值比值作为相对表达水平行半定量分析。
统计学处理 采用SPSS 17.0统计软件进行分析,实验数据以均数±标准差表示,采用t检验,P<0.05为差异具有统计学意义。
结 果
MSCs的形态及免疫表型 原代培养的MSCs最初呈圆形,24 h后开始有少量细胞贴壁,培养5 d后贴壁细胞明显增多,呈梭形。培养14 d后细胞达到完全融合,以1∶2比例传代,传3代后细胞形态均一,呈纤维漩涡状贴壁生长 (图1)。经流式细胞仪直接免疫标记法检测,发现第3代的MSCs中极少细胞表达CD34、CD45(阳性率分别为1.45%、1.1%),绝大多数细胞表达 CD90(阳性率为96.97%),MSCs的纯度较高 (图2)。
铁过载模型的鉴定 FAC处理浓度为400 μmol/L、时间为24 h时活细胞在95%以上,继续加大铁浓度和作用时间,活细胞比例下降,故选用此条件进行LIP测定。结果显示,加铁组MSCs的MFI较对照组明显减弱 [(482.49±20.96)比 (303.88±23.37),P<0.05],因此加铁组细胞内LIP水平明显升高 (图3)。
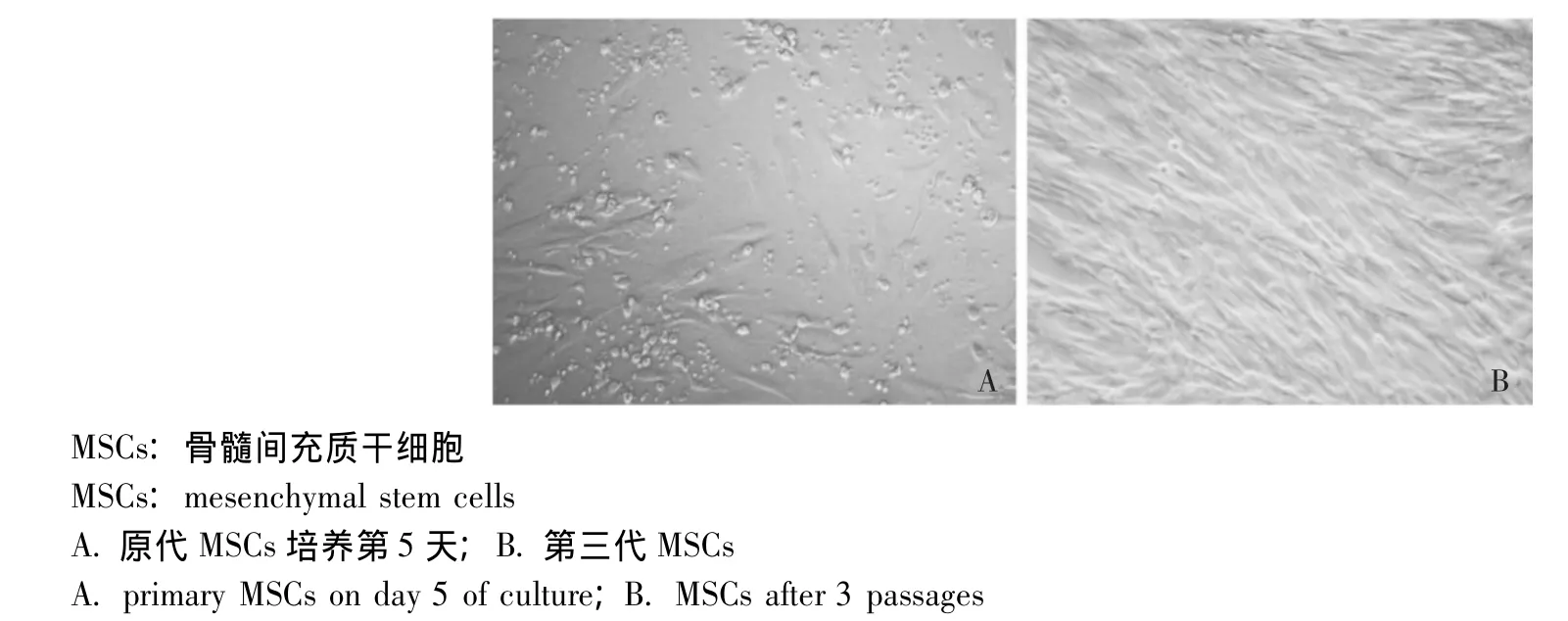
图1 MSCs形态学观察结果 (×200)Fig 1 Morphology of MSCs(×200)

图2 MSCs免疫表型鉴定结果Fig 2 Results of immunophenotying of MSCs

图3 MSCs细胞内的LIP表达水平Fig 3 Levels of intracellular LIP in MSCs
铁过载增加MSCs内ROS的生成 用不同浓度的 FAC(100、200、400 μmol/L)处理 MSCs 24 h后,荧光显微镜观察到加铁组荧光强度比对照组增强 (图4)。采用荧光酶标仪对MSCs内ROS进行的定量检测也发现铁过载组的ROS比对照组明显增加,且ROS随着铁浓度的增加而增加 (图5)。
铁过载抑制MSCs增殖、诱导其凋亡 结果显示,对照组的MSCs生长旺盛,符合MSCs的生长特性,而铁过载的MSCs增殖能力明显下降。对照组的DT为 (1.20±0.05)d,加铁处理12、24、48 h组的DT分别为 (1.47±0.11)、(1.80±0.13)、(2.04±0.14)d,铁过载组MSCs的DT明显长于对照组 (P均<0.05)。Annexin V-PI双标法显示铁过载组MSCs的凋亡率明显高于对照组的凋亡率 [(3.51%±1.17%)比 (0.66% ±0.62%),P<0.05,图6]。
铁过载MSCs的p38MAPK-p53信号途径被激活铁过载组MSCs凋亡相关蛋白P-p38MAPK、p38MAPK、p53的表达明显高于对照组 (P均<0.05),而细胞生存相关蛋白AKT的表达无统计学差异 (图7、表1)。

图4 铁过载对MSCs内ROS水平的影响(DCFH-DA,×100)Fig 4 Effect of iron overload on ROS fluorescence level in MSCs(DCFH-DA, ×100)
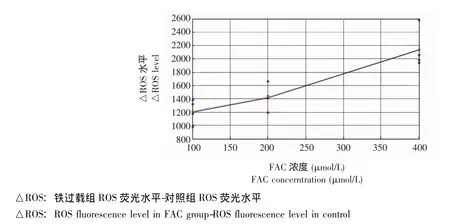
图5 荧光酶标仪测定量分析ROS荧光值Fig 5 Quantification assays of the ROS level by fluorescence plate reader
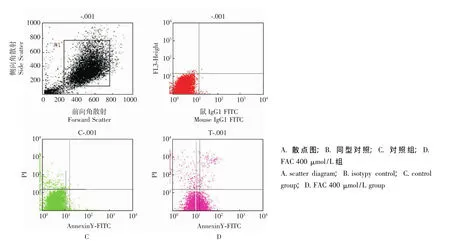
图6 铁过载对MSCs凋亡的影响Fig 6 Effect of iron overload on the apoptosis of MSCs

图7 铁过载增加了MSCs内p38MAPK、p53信号传导因子的表达Fig 7 Iron overload augmented the expression of p38 MAPK and p53 in MSCs
表 1 Western blot检测结果 (n=3,)Table 1 Results of Western blot analysis(n=3,)

表 1 Western blot检测结果 (n=3,)Table 1 Results of Western blot analysis(n=3,)
P-p38MAPK:磷酸化p38丝裂原活化蛋白激酶;AKT:蛋白激酶B;与对照组比较,aP<0.05P-p38MAPK:phosphorylated p38 mitogen activated protein kinase;AKT:protein kinase B;aP<0.05 compared with the control group
组别 Group P-p38MAPK/α-微管蛋白 P-p38MAPK/α-tublin p38MAPK/α-微管蛋白 p38MAPK/α-tublin AKT/α-tublin p53对照组Control group 0.202±0.024 0.637±0.013 0.721±0.009 0.084±0.011铁过载组FAC group 0.346±0.040a 0.746±0.026a 0.689±0.023 0.978±0.071a
讨 论
铁过载是一种临床常见病,多见于遗传性血色病等遗传因素及红系无效造血、长期输血等继发因素造成的机体内铁吸收过多及代谢障碍。多项研究表明铁过载患者的骨髓功能明显抑制,而给予去铁治疗后部分患者血象可恢复正常,能不依赖输血而长期存活[2]。本研究组的前期研究发现,铁过载的骨髓和脐血造血细胞内ROS明显升高,细胞凋亡比例增加,造血功能明显下降,造血干/祖细胞比例减低,而这些损伤都可以通过去铁治疗和抗氧化剂治疗部分缓解[3-6]。进一步深入研究发现,铁过载不仅影响骨髓造血细胞的功能,对MSCs也有明显的影响。铁过载可提高MSCs内的ROS水平,抑制MSCs增殖、诱导其凋亡,且这些作用可能与p38MAPK-p53信号通路的激活相关。
在体外培养MSCs时给予不同浓度的FAC来提供游离的Fe3+,铁可通过与细胞膜上的铁转运蛋白结合进入到细胞内[10],calcein-AM荧光染料染色法显示铁过载细胞内LIP的水平明显升高。胞浆内聚集的大量自由铁能转运到线粒体,通过Fenton反应和Haber-Weiss途径催化生成大量 ROS[11]。本研究利用DCFH-DA探针检测了铁过载MSCs内的ROS,发现细胞内ROS水平和FAC的浓度成正相关,说明本研究建立的MSCs铁过载模型可诱导ROS的生成,进一步证实了铁过载与氧化应激的关系。
ROS可通过多种信号途径抑制MSCs的增殖,诱导其衰老凋亡[12]。许多研究表明,p38MAPK信号途径参与了ROS介导的MSCs损伤过程,它可通过下调细胞周期蛋白、上调细胞周期蛋白依赖性激酶抑制因子等机制抑制细胞周期由G1向S及由G2向M过渡,从而使MSCs的增殖能力下降[13]。经线粒体途径和内质网应激激活的p38MAPK还可调节Bax的转移和细胞色素C的释放,从而诱导骨髓MSCs的凋亡[14]。与此过程密切相关的另一个信号因子是p53,该信号因子可被p38MAPK激活,进而作用其下游靶点p21Cip1使细胞周期停滞,最终降低MSCs的增殖能力,p53还可通过调控促凋亡因子和凋亡因子来诱导 MSCs的凋亡[15]。
本研究发现,处于氧化应激状态下的铁过载组MSCs增殖活性明显受抑,凋亡率明显增加,可见该作用很有可能与铁催化产生的大量ROS有关。本实验进一步研究ROS相关信号通路发现,铁过载的MSCs内P-p38MAPK、p38MAPK蛋白的表达高于对照组,p53的表达也升高,提示p38MAPK-p53途径可能参与了铁过载对MSCs增殖的抑制及对MSCs凋亡的诱导。AKT信号途径在ROS对MSCs的影响中也起着重要作用,磷酸化的AKT可以激活Bcl-2抗凋亡蛋白,增强MSCs的抗凋亡能力[16]。但是,本研究并未观察到AKT蛋白的表达有明显变化,有可能是因为在不同的应激条件下,不同的细胞内ROS可激活不同的信号途径,而升高的ROS在该过程中并未激活AKT来增加细胞的抗凋亡能力。还有一种可能是,ROS仅仅通过提高磷酸化的AKT来发挥作用,所以本研究中总AKT蛋白的表达并无明显变化。
ROS是否参与铁过载对骨髓微环境的影响以及p38MAPK、p53信号通路是否介导了MSCs的损伤仍需要进一步研究,通过抗氧化治疗、去铁治疗、靶向特异的信号传导因子及体内研究可进一步探究其机制。研究铁过载对造血微环境的影响不仅有助于发现临床治疗铁过载疾病的新方法 (抗氧化治疗),也对研究者提出了一个新的问题:如果铁过载患者造血功能的下降和MSCs损伤有关,给予细胞治疗是否能改善患者的造血功能?目前对这一方面的研究尚处于初步阶段,有待进一步探索。
[1]中华医学会血液学分会.铁过载诊断与治疗的中国专家共识[J].中华血液学杂志,2011,32(8):572-574.
[2]Guariqlia R,Martorelli MC,Villani O,et al.Positive effect on hematopoiesis in patients with myelodysplastic sydrome receiving deferasirox as oral iron chelation therapy:a brief review[J].Leuk Res,2011,35(5):566-570.
[3]Zhao MF,Xie F,Li YM,et al.Increased intracellular concentration of reactive oxygen species mediated the deficient hematopoiesis of iron overload bone marrow [J].Blood(ASH Annual Meeting Abstract),2010,116(11):4247a.
[4]谢芳,赵明峰,李玉明,等.铁过载诱导活性氧物质生成对骨髓造血功能影响的体外实验研究[J].中华血液学杂志,2011,32(9):606-609.
[5]谢芳,赵明峰,朱海波,等.铁过载骨髓造血细胞体外模型的建立及其对造血的影响[J].中国实验血液学杂志,2011,19(4):1038-1042.
[6]谢芳,赵明峰,朱海波,等.氧化应激对铁过载造血干祖细胞造血功能的影响[J].中华医学杂志,2011,91(46):3284-3288.
[7]Taoka K,Kumano K,Nakamura F,et al.The effect of iron overload and chelation on erythroid differentiation[J].Int J Hematol,2012,95(2):149-159.
[8]Prus E,Fibach E.Flow cytometry measurement of the labile iron pool in human hematopoietic cells[J].Cytometry A,2008,73(1):22-27.
[9]Wang G,Gong Y,Burczynski FJ,et al.Cell lysis with dimethyl sulphoxide produces stable homogeneous solutions in the dichlorofluorescein oxidative stress assay[J].Free Radic Res,2008,42(5):435-441.
[10]Troadec MB,Ward DM,Lo E,et al.Induction of FPN1 transcription by MTF-1 reveals a role for ferroportin in transition metal efflux[J].Blood,2010,116(22):4657-4464.
[11]Valko M,Morris H,Cronin MT.Metals,toxicity and oxidative stress[J].Curr Med Chem,2005,12(10):1161-1208.
[12]卢文艺,赵明峰.氧化应激对骨髓间充质干细胞的影响[J].中国医学科学院学报,2012,34(1):90-94.
[13]Bhandari DR,Seo KW,Roh KH,et al.REX-1 expression and p38MAPK activation status can determine proliferation/differentiation fates in human mesenchymal stem cells[J].PLoS One,2010,5(5):e10493.
[14]Wei H,Li Z,Hu S,et al.Apoptosis of mesenchymal stem cells induced by hydrogen peroxide concerns both endoplasmic reticulum stress and mitochondrial death pathway through regulation of caspases,p38 and JNK[J].J Cell Biochem ,2010,111(4):967-978.
[15]Mimeault M,Batra SK.Recent insights into the molecular mechanisms involved in aging and the malignant transformation of adult stem/progenitor cells and their therapeutic implications[J].Ageing Res Rev,2009,8(2):94-112.
[16]Downward J.PI 3-kinase Akt and cell survival[J].Semin Cell Dev Biol,2004,15(2):177-182.

