塞来昔布联合替吉奥对胃癌裸鼠移植瘤生长及淋巴管生成的影响
孟翠翠,罗治彬
胃癌是世界范围内死亡率居第二位的恶性肿瘤,5年生存率不足25%[1-2]。化疗在胃癌治疗中占有重要地位。淋巴结转移是胃癌的主要转移途径,而淋巴管生成可促进肿瘤的淋巴结转移。血管内皮生长因子(vascular endothelial growth factor C,VEGF-C)是最先发现的淋巴管生成因子,可以促进肿瘤的淋巴管生成。环氧化酶-2(cyclooxygenase-2,COX-2)是一种新近发现的淋巴管生成因子,在头颈部鳞癌[3]、乳腺癌[4]中可通过上调VEGF-C的表达促进肿瘤淋巴管生成。塞来昔布是一种高选择性COX-2抑制剂,在乳腺癌裸鼠移植瘤模型中可抑制肿瘤生长及淋巴管生成[5]。Ran等[6]提出联合使用化疗和抗肿瘤淋巴管生成治疗或许能够有效抑制受损淋巴系统的重构,抑制肿瘤转移。塞来昔布、塞来昔布联合替吉奥对胃癌裸鼠皮下移植瘤淋巴管生成的影响国内外未见报道。本研究通过建立胃癌裸鼠皮下移植瘤模型,给予塞来昔布、替吉奥进行干预,观察塞来昔布单药及联合给药的肿瘤治疗作用,并探讨其可能的机制。
1 材料与方法
1.1 动物及试剂 人胃癌SGC-7901细胞株由重庆医科大学附属第一医院实验研究中心保存。4~6周龄BALB/c雌性裸鼠31只,购于中国协和医科大学实验动物研究所,动物合格证号SCXK(京)2009-0004。裸鼠饲养于重庆医科大学附属第一医院动物实验室SPF级环境中,自由进食水。塞来昔布购自辉瑞制药公司(美国),替吉奥购自江苏恒瑞制药公司。胎牛血清、RPMI 1640培养基购自Hyclone公司(美国)。兔抗COX-2抗体购自Bioworld公司(美国),兔抗VEGF-C抗体购自Epitomics公司(美国),叙利亚仓鼠抗小鼠Podoplanin(肾小球足突细胞膜蛋白)抗体购自Biolegend公司(美国),生物素标记的羊抗叙利亚仓鼠抗体购自Bethyl公司(美国)。免疫组化SP试剂盒、DAB显色剂购于北京中杉金桥生物公司。
1.2 实验方法
1.2.1 细胞培养 人胃癌SGC-7901细胞培养于含10%胎牛血清的RPMI 1640培养基中,于37℃、5%CO2培养箱中培养,2~3d换液1次,细胞生长至80%~90%融合时进行传代。
1.2.2 裸鼠皮下移植瘤模型的建立及分组干预取对数生长期细胞,以0.25%胰酶消化后离心并计数,用PBS调整细胞浓度至1×107/ml,每只裸鼠于背部靠近前肢部位接种2×106个细胞,共接种31只。肿瘤最大径达5mm时开始分组干预。成瘤裸鼠随机分为阴性对照组、塞来昔布组、替吉奥组、塞来昔布联合替吉奥组(联合给药组,n=6)。塞来昔布、替吉奥均混悬于0.5%的羧甲基纤维素钠中灌胃给药。塞来昔布给药剂量为50mg/(kg·d),每只裸鼠给予0.2ml,每周连续给药7d;替吉奥给药剂量为10mg/(kg·d),每只裸鼠给予0.1ml,每周连续给药5d;联合给药组为上述剂量塞来昔布、替吉奥的联合;阴性对照组给予等体积的0.5%羧甲基纤维素钠。治疗过程中注意观察裸鼠的精神状态、饮食、活动、大小便情况,测量给药前后裸鼠体重变化,评价药物治疗的毒副作用。连续给药3周后颈椎脱臼处死裸鼠,取材。测量瘤重,计算抑瘤率。抑瘤率=(1-干预组肿瘤重量/对照组肿瘤重量)×100%。
1.2.3 各组COX-2、VEGF-C的表达及淋巴管密度(LVD)计数 取肿瘤组织,采用免疫组化SP法检测COX-2、VEGF-C的表达情况。枸橼酸盐抗原热修复,3% H2O2封闭内源性过氧化物酶活性,山羊血清封闭,分别滴加兔抗COX-2抗体(1:200)、兔抗VEGF-C抗体(1:100)、叙利亚仓鼠抗小鼠Podoplanin抗体(1:200),4℃冰箱过夜,滴加生物素标记的羊抗兔二抗工作液,一抗为Podoplanin时滴加生物素标记的羊抗叙利亚仓鼠二抗(1:50),滴加辣根酶标记的链霉亲和素,DAB显色,苏木素复染,盐酸乙醇分化,碳酸锂返蓝,梯度乙醇脱水,二甲苯透明,中性树胶封片。光学显微镜下拍照。阳性结果的判断及计算:COX-2、VEGF-C阳性染色定位于肿瘤细胞胞质,为棕黄色染色。每张切片在200倍光镜下随机选取5个视野,利用Image-Pro Plus 6.0图像分析软件测量各组肿瘤组织中阳性表达的平均光密度值。
淋巴管密度计数:以Podoplanin标记淋巴管,阳性染色定位于淋巴内皮细胞胞质,为棕黄色染色。以棕黄色染色的单个内皮细胞、细胞簇或者结构不相连的单个淋巴管作为一个淋巴管进行计数,每张切片先在低倍镜(×40倍)下找到淋巴管密集区域即热点区,然后在高倍镜(×200倍)下随机计数5个视野内的淋巴管数,计算平均值。
1.3 统计学处理 应用SPSS 17.0软件进行统计分析,计量资料以s表示,组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,治疗前后裸鼠体重比较采用配对t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 裸鼠移植瘤模型的建立及药物毒副作用的评价 接种后第18天,26只裸鼠肿瘤最大径≥5mm,5只裸鼠未成瘤,成瘤率为83.9%,随着肿瘤体积增大,部分肿瘤表面出现破溃、结痂。治疗过程中,裸鼠一般状况可,未见明显不良反应,各组裸鼠并未出现明显的恶性消耗表现,治疗结束后各组裸鼠体重均较治疗前增加(P<0.05,表1)。
表1 治疗前后各组裸鼠的体重比较(g,s,n=6)Tab.1 The weight change of different groups after treatment(g, n=6)
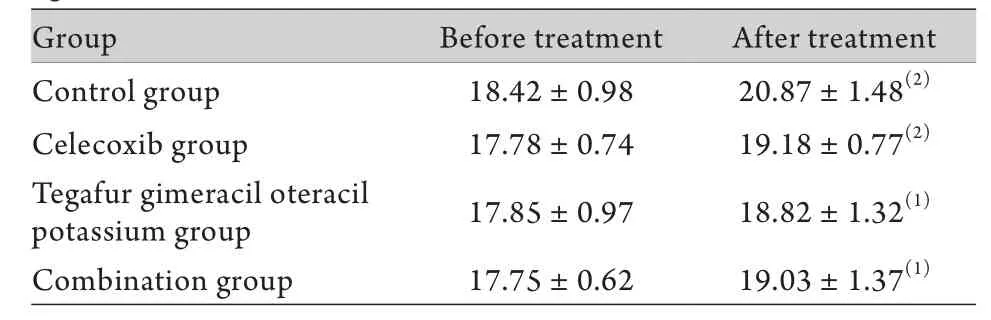
表1 治疗前后各组裸鼠的体重比较(g,s,n=6)Tab.1 The weight change of different groups after treatment(g, n=6)
(1)P<0.05, (2)P<0.01 compared with before treatment
Group Before treatment After treatment Control group 18.42±0.98 20.87±1.48(2)Celecoxib group 17.78±0.74 19.18±0.77(2)Tegafur gimeracil oteracil potassium group 17.85±0.97 18.82±1.32(1)Combination group 17.75±0.62 19.03±1.37(1)
2.2 塞来昔布、替吉奥对各组瘤重的影响 药物干预组肿瘤生长较对照组缓慢,取材后,各组移植瘤重量分别为:阴性对照组2.14±0.79g、塞来昔布组1.44±0.50g、替吉奥组1.11±0.34g、联合给药组0.44±0.27g。各药物干预组瘤重明显低于阴性对照组(P<0.05),塞来昔布组与替吉奥组瘤重比较差异无统计学意义(P>0.05),联合给药组瘤重低于塞来昔布组、替吉奥组(P<0.05)。塞来昔布组、替吉奥组、联合给药组抑瘤率分别为32.71%、48.13%、79.44%,由金正均法可知,两药合用后产生明显的协同作用,q>1.15。q=EA+B/(EA+EB-EA×EB),EA+B为A、B两药联用后的效应,EA、EB分别为两药单用的效应。
2.3 塞来昔布、替吉奥对胃癌裸鼠皮下移植瘤COX-2、VEGF-C表达的影响 免疫组化结果显示,COX-2、VEGF-C表达于肿瘤细胞胞质,呈棕黄色染色。塞来昔布组、联合给药组COX-2、VEGF-C的表达明显低于阴性对照组、替吉奥组(P<0.05),替吉奥组与阴性对照组比较差异无统计学意义(P>0.05),塞来昔布组与联合给药组比较亦无明显差异(P>0.05,表2,图1、2)。
表2 各组肿瘤组织中COX-2、VEGF-C蛋白表达的光密度值s,n=6)Tab.2 Mean optical density of COX-2, VEGF-C protein expression in tumor tissue of different groups ±s, n=6)
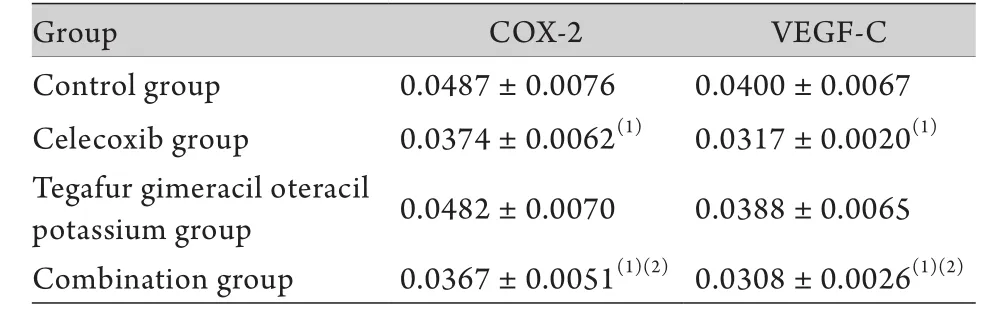
表2 各组肿瘤组织中COX-2、VEGF-C蛋白表达的光密度值s,n=6)Tab.2 Mean optical density of COX-2, VEGF-C protein expression in tumor tissue of different groups ±s, n=6)
(1)P<0.05 compared with control group; (2)P<0.05 compared with tegafur gimeracil oteracil potassium group
Group COX-2 VEGF-C Control group 0.0487±0.0076 0.0400±0.0067 Celecoxib group 0.0374±0.0062(1) 0.0317±0.0020(1)Tegafur gimeracil oteracil potassium group 0.0482±0.0070 0.0388±0.0065 Combination group 0.0367±0.0051(1)(2)0.0308±0.0026(1)(2)
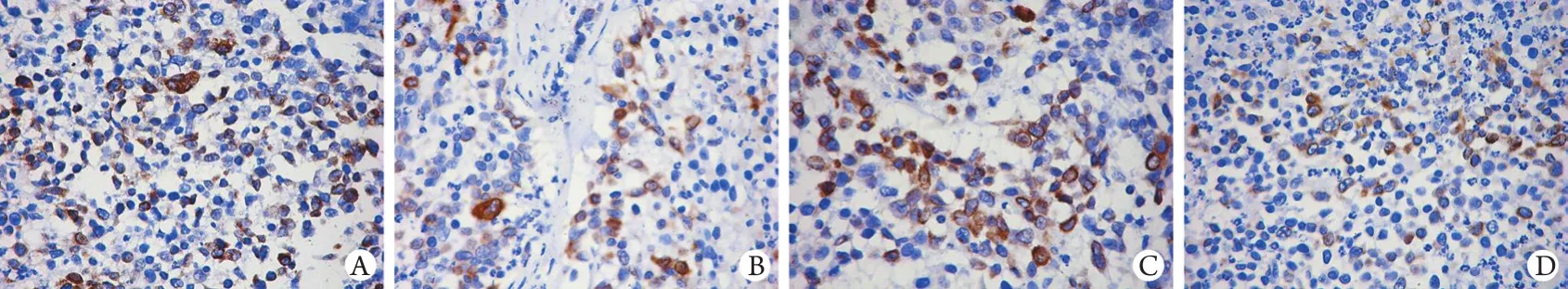
图1 胃癌裸鼠皮下移植瘤组织中COX-2的表达(免疫组化染色×200)Fig. 1 COX-2 expression in subcutaneous xenograft tumor of gastric cancer in nude mice (Immunohistochemistry staining ×200)
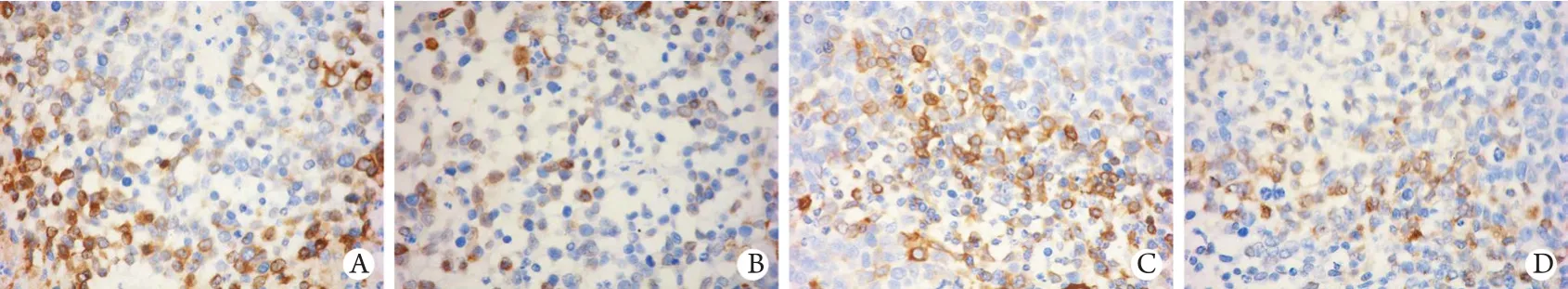
图2 胃癌裸鼠皮下移植瘤组织中VEGF-C的表达(免疫组化染色×200)Fig. 2 VEGF-C expression in subcutaneous xenograft tumor of gastric cancer in nude mice (Immunohistochemistry staining ×200)
2.4 各组肿瘤组织中淋巴管密度计数 镜下观察淋巴管主要分布在肿瘤组织边缘,管腔大小不一,管壁较薄,由单层淋巴内皮细胞组成。镜下计数阴性对照组、塞来昔布组、替吉奥组、联合给药组淋巴管密度分别为8.60±1.52、4.60±1.14、8.00±1.58、3.80±1.30/HF。塞来昔布组、联合给药组淋巴管密度明显低于阴性对照组、替吉奥组(P<0.05),替吉奥组与阴性对照组比较无明显差异(P>0.05),联合给药组与塞来昔布组比较亦差异无统计学意义(P>0.05,图3)。
3 讨 论
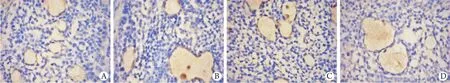
图3 胃癌裸鼠皮下移植瘤组织中淋巴管密度比较(免疫组化染色×200)Fig. 3 The lymphatic vessel density in subcutaneous xenograft tumor of gastric cancer in nude mice (Immunohistochemistry staining ×200)
根据不同实验需要,胃癌裸鼠皮下肿瘤细胞接种部位有不同的选择[7]。一般皮下接种部位多选择血供丰富、皮下游离空间大的地方,以利于肿瘤生长。本实验选择背部靠近右前肢并且靠近腋窝部位。本实验中接种细胞的数量参照徐晓萌等[8]的方法确定,保证足够的细胞数量。
塞来昔布由于选择性作用于COX-2,减轻了消化道不良反应,如胃肠黏膜的损伤、消化性溃疡等。替吉奥中含有的奥替拉西钾可减轻5-FU引起的胃肠道不良反应。Lai等[9]对11例伴有恶病质的头颈部恶性肿瘤、胃肠恶性肿瘤患者进行的随机对照Ⅱ期临床研究发现,与安慰剂组相比,服用塞来昔布能明显增加患者体重、体重指数,提高生活质量评分,且并未出现明显不良反应。本实验塞来昔布组、替吉奥组、联合给药组所用剂量并未引起明显的不良反应。
大量的临床前期研究表明,COX-2/PGE2信号通路在恶性肿瘤的发展中具有重要作用[10]。体内外研究发现,选择性COX-2抑制剂塞来昔布能够抑制多种肿瘤生长。Basu等[11]研究发现在乳腺癌自发性转移性鼠模型中,塞来昔布明显抑制了肿瘤的生长,可能的机制为塞来昔布通过下调Akt、Bcl-2的表达抑制肿瘤细胞增殖,同时上调促凋亡蛋白Bax的表达促进肿瘤细胞凋亡,下调VEGF的表达抑制肿瘤新生血管生成。替吉奥是5-FU的衍生物,其抗肿瘤作用机制为替加氟经肝脏微粒体细胞色素P450酶系作用转化为5-FU,5-FU在细胞内进一步转化为5-氟尿嘧啶脱氧核苷酸,抑制胸苷酸合酶,进而抑制DNA的合成,另外5-FU在体内可转化为5-氟尿嘧啶核苷,以伪代谢产物形式掺入RNA中,干扰蛋白质合成。商业化的替吉奥在日本已被批准用于胃癌、结直肠癌、非小细胞肺癌、乳腺癌、头颈部癌、胰腺癌、胆管癌的治疗。瘤重变化是评价肿瘤治疗效果的一个可靠指标。在本实验中,塞来昔布、替吉奥单独作用时不同程度地抑制了肿瘤生长,而联合给药组表现为协同作用。Zhang等[12]研究发现,在人结肠癌裸鼠皮下移植瘤模型中,塞来昔布联合5-FU有协同抗肿瘤作用,可能的机制为二者均可促进细胞色素C的释放,上调Caspase-9、Caspase-3的表达,促进细胞凋亡。
肿瘤淋巴管生成为从已经存在的淋巴管出芽、增殖形成新的淋巴管,或者从循环中的淋巴内皮祖细胞生成新的淋巴管。已有大量研究证实肿瘤淋巴管生成可促进肿瘤的淋巴管浸润与淋巴结转移。VEGF-C是最先发现的淋巴管生成因子,COX-2是近年来发现的新的淋巴管生成因子。对手术切除的胃癌标本进行的研究发现,COX-2的表达与VEGF-C的表达、淋巴管密度及淋巴结转移密切相关[13-14],推测COX-2通过上调VEGF-C的表达促进了淋巴管生成。Su等[15]研究发现VEGF-C是COX-2的一个主要下游基因,COX-2通过EP1和Her-2受体依赖途径上调VEGF-C的表达。Liu等[16]研究发现塞来昔布抑制了肺癌Anip973细胞VEGF-C的表达,而COX-2的主要代谢产物PGE2可上调肺癌AGZY83-a细胞VEGF-C的表达,并通过建立动物模型发现塞来昔布抑制VEGF-C的表达、淋巴管生成、淋巴结转移,而PGE2则发挥相反作用,因而推测COX-2通过其代谢产物PGE2与其受体EP1/EP4结合,促进了VEGF-C的表达。在本实验中塞来昔布可明显抑制COX-2、VEGF-C的表达,从而降低淋巴管密度,而替吉奥并无明显的抑制作用。可能的机制为塞来昔布通过下调COX-2的表达,进而抑制VEGF-C的表达,降低了淋巴管密度。塞来昔布联合替吉奥的抗肿瘤淋巴管生成作用,明显优于单用替吉奥组。
综上所述,塞来昔布、替吉奥单独作用均可明显抑制肿瘤生长,二者联合应用表现为协同作用,联合给药组并未出现明显的毒副作用。塞来昔布可能通过下调COX-2蛋白的表达,进而下调VEGF-C的表达,抑制肿瘤组织淋巴管生成。而替吉奥并无明显的抗肿瘤淋巴管生成的作用。塞来昔布联合替吉奥的抗肿瘤作用优于单用替吉奥组。
[1]Jemal A, Bray F, Center MM, et al. Global cancer statistics[J].CA Cancer J Clin, 2011, 61(2): 69-90.
[2]Wu DH, Wu BY, Wang MW, et al. Multivariate analysis on lymph node metastasis in early-stage gastric cancer[J]. Med J Chin PLA, 2006, 31(10): 941-943.[吴道宏, 吴本俨, 王孟薇, 等. 早期胃癌淋巴结转移多因素分析[J]. 解放军医学杂志, 2006,31(10): 941-943.]
[3]Kyzas PA, Stefanou D, Agnantis NJ. COX-2 expression correlates with VEGF-C and lymph node metastases in patients with head and neck squamous cell carcinoma[J]. Mod Pathol, 2005, 18(1):153-160.
[4]Zhang XH, Huang DP, Guo GL, et al. Coexpression of VEGF-C and COX-2 and its association with lymphangiogenesis in human breast cancer[J], BMC Cancer, 2008, 8: 4.
[5]Barnes NL, Warnberg F, Farnie G, et al. Cyclooxygenase-2 inhibition: effects on tumour growth, cell cycling and lymphangiogenesis in a xenograft model of breast cancer[J]. Br J Cancer, 2007, 96(4): 575-582.
[6]Ran S, Volk L, Hall K, et al. Lymphangiogenesis and lymphatic metastasis in breast cancer[J]. Pathophysiology, 2010, 17(4):229-251.
[7]Li BD, Fu ZX, Chen XH, et al. Reproduction and characterization of a nude mice model with xenografts of human gastric carcinoma with reconstruction of function of cellular immunity[J]. Med J Chin PLA, 2007, 32(2): 124-126.[李保东,付泽娴, 陈小贺, 等.荷人胃癌皮下移植瘤及细胞免疫功能重建的裸鼠模型构建及其特征[J]. 解放军医学杂志, 2007,32(2): 124-126.]
[8]Xu XM, Liu CL, Xie L. Effect of darbufelone on the growth of tumor xenograft with SGC-7901 grastric cancer cells in nude mouse[J]. World Sci Tech Res Dev, 2011, 33(4): 654-656. [徐晓萌, 刘纯伦, 谢黎. Darbufelone对胃癌SGC-7901细胞裸鼠移植瘤生长的影响[J]. 世界科技研究与发展, 2011, 33(4):654-656.]
[9]Lai V, George J, Richey L, et al. Results of a pilot study of the effects of celecoxib on cancer cachexia in patients with cancer of the head, neck, and gastrointestinal tract[J]. Head Neck, 2008,30(1): 67-74.
[10]Menter DG, Schilsky RL, DuBois RN. Cyclooxygenase-2 and cancer treatment: understanding the risk should be worth the reward[J]. Clin Cancer Res, 2010,16(5): 1384-1390.
[11]Basu GD, Pathangey LB, Tinder TL, et al. Cyclooxygenase-2 inhibitor induces apoptosis in breast cancer cells in an in vivo model of spontaneous metastatic breast cancer[J]. Mol Cancer Res, 2004, 2(11): 632-642.
[12]Zhang DQ, Guo Q, Zhu JH, et al. Increase of cyclooxygenase-2 inhibition with celecoxib combined with 5-FU enhances tumor cell apoptosis and antitumor efficacy in a subcutaneous implantation tumor model of human colon cancer[J]. World J Surg Oncol, 2013, 11: 16.
[13]Zhou HC, Zhang Y, Li JC. Detection of cyclooxygenase-2,vascular endothelial growth factor C and density of micro-lymph vessel in tissue of gastric carcinoma[J]. J Zhengzhou Univ (Med Sci), 2006, 41(6): 1131-1133.[ 周慧聪, 张艳, 李继昌. 胃癌组织中环氧合酶-2、血管内皮生长因子-C与 微淋巴管密度检测[J]. 郑州大学学报(医学版), 2006, 41(6): 1131-1133.]
[14]Zhang J, Ji J, Yuan F, et al. Cyclooxygenase-2 expression is associated with VEGF-C and lymph node metastases in gastric cancer patients[J]. Biomed Pharmacother, 2005, 59(Suppl 2):S285-S288.
[15]Su JL, Shih JY, Yen ML, et al. Cyclooxygenase-2 induces EP1- and HER-2/Neu-dependent vascular endothelial growth factor-C up-regulation: a novel mechanism of lymphangiogenesis in lung adenocarcinoma[J]. Cancer Res, 2004, 64(2): 554-564.
[16]Liu H, Yang Y, Xiao J, et al. COX-2-mediated regulation of VEGF-C in association with lymphangiogenesis and lymph node metastasis in lung cancer[J]. Anat Rec (Hoboken), 2010,293(11): 1838-1846.

