hHCN4基因修饰的大鼠BMSCs与心肌细胞共培养分化为心肌样细胞的实验研究
范杰,王高频
缓慢性心律失常(包括窦性心动过缓、病态窦房结综合征和房室传导阻滞等)是临床常见的一种心律失常,目前的治疗措施主要是植入电子心脏起搏器[1]。尽管电子心脏起搏器治疗缓慢性心律失常在技术上已较为成熟,但仍存在一些无法克服的缺陷[2-3]。因此,重建一个具有正常生理功能的生物心脏起搏器,以取代电子心脏起搏器治疗,是当今心脏电生理学界研究的热点之一[4-6]。本课题组前期研究已证实超级化环化核苷酸门控阳离子通道4(hHCN4)基因修饰的骨髓间充质干细胞(BMSCs)可在体外分化为心肌样细胞[7],本研究拟将hHCN4基因修饰的大鼠BMSCs细胞与乳鼠心肌细胞(CM)进行共培养,对其细胞连接功能及起搏功能进行观察,检测hHCN4基因修饰的大鼠BMSCs细胞能否与心肌细胞建立有效的电机械连接,旨在为进一步进行生物起搏治疗提供实验依据。
1 材料与方法
1.1 实验动物 出生1~2d的SPF级SD大鼠20只,成年SD大鼠3只(90~120g),雌雄不拘,由辽宁医学院实验中心提供。
1.2 主要试剂和仪器 DMEM高糖培养基、胰酶(美国Gibco公司);胎牛血清(美国Hyclone公司);小鼠抗大鼠缝隙连接蛋白43(Cx43)单克隆抗体(美国Chemicon公司);5-溴脱氧尿嘧啶核苷(5-BrdU)、山羊抗小鼠IgG-TRITC荧光二抗、山羊抗兔IgGFITC荧光二抗、DAPI(蓝色荧光)(北京博奥森公司)。倒置显微镜、荧光显微镜、透射电镜(日本Olympus公司);Western blotting电泳仪、电泳槽(美国EC公司);转膜仪(美国Bio-Rad公司);Labworks凝胶图像分析系统(美国UVP公司)。
1.3 实验方法
1.3.1 新生大鼠CM的分离培养 分离培养方法参见文献[7],前6d加入0.1mmol/L 5-Brdu抑制非心肌细胞生长。于共培养前1d将心肌细胞用50mg/ml DAPI标记过夜。
1.3.2 hHCN4基因修饰的BMSCs的构建 本课题组前期工作已完成,本实验选择转染5d后的BMSCs进行共培养。
1.3.3 BMSCs与CM共培养 选择转染hHCN4基因5d后的BMSCs,用0.125%胰蛋白酶消化数分钟至细胞变椭圆,终止消化,轻轻吹打使贴壁细胞脱落。CM与BMSCS按4:1比例以3×105/ml密度接种于放有玻片的6孔板中,置于37℃、5%CO2培养箱培养2~4d。分组:未与BMSCs共培养的CM(培养时间与其他组相同)设为空白对照组;未与CM共培养的hHCN4+BMSCs为共培养对照组;hHCN4-BMSCs与CM共培养设为HCN4-对照组;hHCN4+BMSCs与CM共培养组设为实验组。
1.3.4 倒置相差显微镜观察细胞的自发搏动频率共培养4d后,每组选择3个标本,每个标本计数3个高倍视野,每个视野选择2个自发搏动细胞,计数1min。分析每组细胞搏动频率及其差异。
1.3.5 荧光显微镜观察共培养的两类细胞 共培养前用DAPI对CM进行标记,在波长340nm激发光下,荧光显微镜下观察CM细胞呈蓝色,而BMSCs转染有GFP,在波长448nm激发光下呈绿色。共培养4d后用荧光显微镜观察共培养的细胞标本,以了解两种细胞是否可以共存。
1.3.6 Western blotting检测各组细胞Cx43的表达每瓶细胞洗去培养液后置于冰上,加入1ml细胞裂解液和10μl PMSF(10mg/ml),冰上裂解30min,4℃、12 000r/min离心5min后收集上清,BAC法测定蛋白含量,根据蛋白含量制作样品。每孔10μl样品加入适量缓冲液上样,经SDS-PAGE电泳后,将蛋白转移到PVDF膜上,取出PVDF膜,浸入封闭液置于摇床上慢摇1h以上。洗膜液略洗后加入杂交液,Cx-43(1:500)4℃杂交过夜。TBST缓冲液洗3次,每次5min,去除TBST,将含HRP标记的二抗加入离心管中,摇床上杂交1h。TBST缓冲液洗3次,每次5min。显色剂均匀滴在PVDF膜上,反应1~2min,上机检测。
1.3.7 透射电镜检测细胞缝隙连接情况 以细胞刮子刮取各组细胞,离心沉淀,弃去上清液后PBS冲洗;2.5%戊二醛固定,1%四氧化锇固定,梯度乙醇脱水,Epon812环氧树脂包埋,超薄切片机切片,透射电镜下观察拍照。
1.4 统计学处理 采用SPSS 19.0软件进行统计分析。计量资料以x±s表示,组间比较采用单因素方差分析,两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 共培养前的CM和BMSCs 倒置显微镜观察分离的CM 12h后贴壁生长,第2~3天细胞部分融合,第5天时可见细胞间相互交织成网,形成细胞簇,呈同步性自发搏动,频率80次/min左右(图1A)。DAPI标记的CM显示蓝色荧光(图1B)。BMSCs培养48h后可见散在梭形贴壁细胞,7d后细胞逐渐融合。传代后细胞逐渐纯化,第3代细胞呈形态均一、分布均匀的纺锤形。荧光显微镜观察发现转染hHCN4基因5d后70%左右的BMSCs带有绿色荧光(图1C)。
2.2 共培养后心肌细胞的自发搏动频率改变 倒置显微镜观察可见,共培养对照组细胞无自发搏动现象,空白对照组细胞搏动频率为81±17次/min,与HCN4-对照组(75±19次/min)比较差异无统计学意义(P>0.05)。实验组搏动频率(128±23次/min)明显高于其他3个对照组,差异有统计学意义(P<0.05)。
2.3 荧光显微镜观察hHCN4+BMSCs与CM的空间位置 CM与hHCN4+BMSCs共培养2d后,在荧光显微镜下观察发现有绿色荧光标记的细胞,为hHCN4+BMSCs,同时还有DAPI标记的蓝色心肌细胞核,两类细胞在位置上相毗邻(图2)。

图1 共培养前CM和BMSCs的形态(×200)Fig.1 Morphology of CM and BMSCs before co-culture (×200)
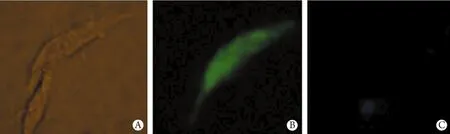
图2 共培养2d时的CM与BMSCs(×400)Fig.2 BMSCs co-cultured with CM at the second day (Fluorescence microscope ×400)
2.4 Western blotting检测各组细胞Cx43的表达Cx43在各组细胞的表达情况见图3。Western blotting检测相对光密度值显示,实验组Cx43表达(0.71±0.13)高于共培养对照组(0.16±0.10)和HCN4-对照组(0.36±0.09),差异有统计学意义(P<0.05),但与空白对照组(0.74±0.08)比较差异无统计学意义。
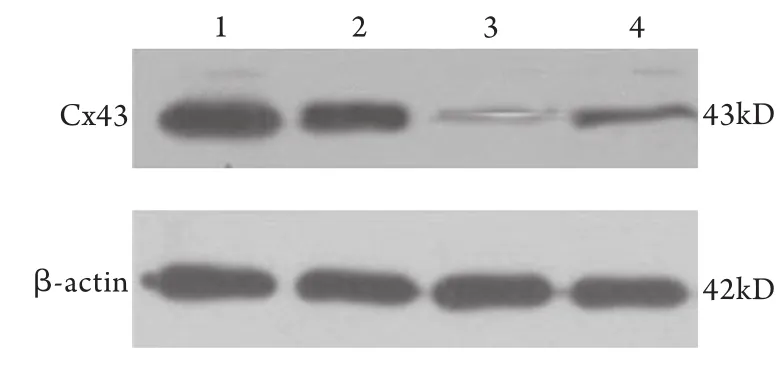
图3 Western blotting检测各组Cx43的表达Fig.3 Expression of Cx43 in each group detected by Western blotting
2.5 透射电镜观察缝隙连接情况 透射电镜观察发现,hHCN4+BMSCs共培养组BMSCs可与相邻CM间形成指状交错的连接,并可观察到相邻细胞膜边缘出现电子密度增高的结构,提示存在缝隙连接(图4)。
3 讨 论
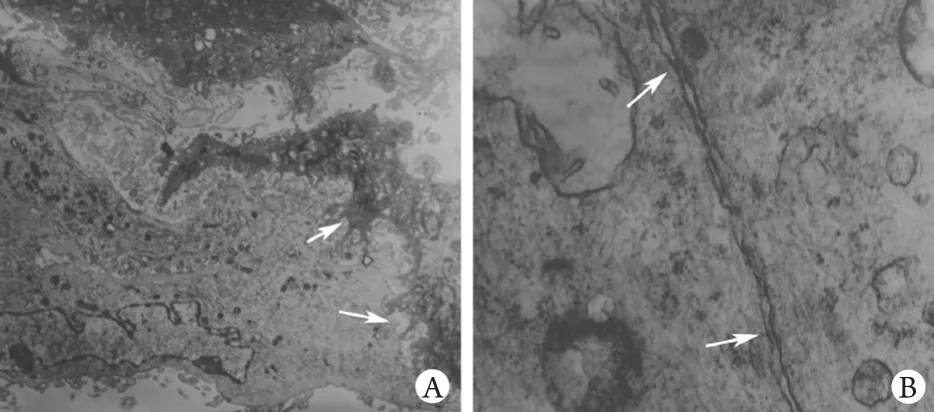
图4 透射电镜观察hHCN4+ BMSCs组细胞间缝隙连接Fig.4 Intercellular gap junctions in hHCN4+ BMSCs group(Transmission electron microscopy)
本课题组前期研究中,已成功将hHCN4基因通过腺病毒载体转染大鼠BMSCs,并获得了稳定表达hHCN4通道蛋白的细胞[7],但BMSCs不能自发搏动,因为其上没有产生动作电位所需的其他离子通道。为此本实验在前期研究的基础上,将成功转染hHCN4基因的BMSCs与CM共培养,希望两类细胞间能够形成有效的电机械连接,使hHCN4基因修饰的BMSCs上产生去极化电流并传递给与之连接的CM,诱发动作电位爆发,从而产生细胞的自发搏动。
近年来,有研究者采用条件培养和共培养的方法模拟体内微环境,结果证实CM与BMSCs直接接触在促进BMSCs向心肌样细胞分化中起着重要作用[8]。有学者提出这一现象是由于心肌细胞微环境中化学因素以及细胞间的牵拉力、电生理环境、直接接触及细胞基质所提供的信号刺激等原因,共同发挥了诱导分化作用。赵艳梅等[9]研究了不同诱导条件对大鼠BMSCs体外分化的影响,发现经5-Aza诱导或与CM共培养,均可使BMSCs转化为心肌样细胞并表达Cx43,且共培养的BMSCs分化为心肌细胞的能力比经5-Aza诱导者强。研究者认为BMSCs表面表达的缝隙连接蛋白(Cx)很可能在BMSCs定向分化为心肌样细胞的过程中起关键性作用。
心肌细胞间的电传导主要依靠缝隙连接来完成。窦房结在心脏电传导活动中起主导作用,其激动频率的维持和激动的传导都需要缝隙连接的作用[10]。Cx是构成细胞间缝隙连接的分子基础,在维持细胞间电传导方面起着重要作用[11]。心肌细胞中存在Cx43、Cx40和Cx45,其中最主要的是Cx43,不管在哪个发育阶段,其在心房和心室细胞中都有表达[12-15]。本研究结果显示,hHCN4+BMSCs与CM共培养组Cx43表达程度与空白对照组(CM)相当,呈阳性表达,这是形成缝隙连接的前提。本研究还发现共培养对照组和hHCN4-BMSCs对照组虽然也表达Cx43,但其表达量明显低于实验组,提示hHCN4基因的有效表达可促进缝隙连接蛋白的表达。与其他学者的研究结果[16]相比,我们认为基因修饰与共培养环境的双重作用更有利于BMSCs向心肌细胞分化的进程。
Cx43表达检测仅从蛋白水平证实了相邻的两类细胞间存在构成缝隙连接的物质基础,但是否能形成功能性的缝隙连接,还需要进行超微结构检测。本研究透射电镜结果显示实验组细胞可与相邻细胞间形成指状交错的连接,并可观察到相邻细胞膜边缘的电子密度增高的结构,提示了缝隙连接的存在。由于实验条件的限制,虽然没能利用电耦联法或荧光光漂白后恢复技术(FRAP)检测两类细胞间Cx43的传导功能,但国外多个研究已经证实解剖上相邻的两类细胞形成有效的缝隙连接就能实现细胞间的通讯[17-18]。另外本实验结果显示实验组细胞的自发搏动频率较对照组明显加快,这与Cx43的功能是分不开的,因此我们推断BMSCs与CM之间的Cx43能够发挥传导功能,BMSCs上产生的去极化电流传导给了与之连接的CM,使自发搏动频率显著增加。
综上所述,本研究通过hHCN4基因修饰的BMSCs与CM共培养,从分子水平和细胞水平同时对BMSCs进行诱导,在双重作用的影响下,BMSCs与CM形成了功能性缝隙连接,构成了具有自发起搏功能的合胞体,更接近生物起搏模型的要求,为进一步进行生物起搏治疗提供了实验依据。
[1]Tang YF, Xu JB, Li L, et al. permanent pacemaker implantation after cardiac surgery: anlysis of 64 cases[J]. Med J Chin PLA,2010, 35(10): 1248-1249, 1253. [唐杨烽, 徐激斌, 李莉, 等. 心脏术后永久性起搏器植入64例临床分析[J]. 解放军医学杂志, 2010, 35(10): 1248-1249, 1253.]
[2]Rozmus GD, Daubert YP, Huang DT, et al. Venous thrombosis and stenosis after implantation of pacemakers and defibrillators[J]. J Interv Card Electrophysiol, 2005, 13(1): 9-19.
[3]Bongiomi MQ, Di Cori A, Soldati E, et al. Iatrogenic risk of permanent pacemaker and defibrillator implantation[J]. G Ital Cardiol (Rome), 2009, 10(6): 395-406.
[4]Wu GH, Chen ZQ. Cardiac biological pacing therapy of Brodycardia[J]. Chin J Card Pacing Electrophysiol, 2007, 21(3):263-265. [吴关华, 陈章强. 缓慢性心律失常生物心脏起搏器治疗的研究进展[J]. 中国心脏起搏与心电生理杂志, 2007,21(3): 263-265.]
[5]Li BF, Liu RG, Zhu MX. Stem cells transplantation and cardiac biological pacing[J]. J Clin Rehabil Tissue Eng Res, 2009,13(36): 7151-7154. [李北方, 刘仁光, 朱明星. 干细胞移植与心脏生物起搏的研究现状[J]. 中国组织工程研究与临床康复, 2009, 13(36): 7151-7154.]
[6]Jiang W, Fa XE, Li XZ. Effects of lysate of sinoatrial cells on differentiation of rat bone marrow mesynchymal stem cells [J]. J Zhengzhou Univ (Med Sci), 2011, 46(1): 79-82. [蒋伟, 法宪恩,李晓召. 窦房结细胞裂解液对大鼠骨髓间充质干细胞的诱导分化作用[J]. 郑州大学学报(医学版), 2011, 46(1): 79-82.]
[7]Tong YN, Wang GP. In vitro transfection of rat bone marrow mesenchymal stem cells with recombinant adenovirus vector containing human HCN4 gene: An experimental study[J]. Acad J Chin PLA Med Sch, 2013, 34(4):382-385. [佟玉娜, 王高频.携带hHCN4基因重组腺病毒载体体外转染大鼠BMSCs的实验研究[J]. 解放军医学院学报, 2013, 34(4): 382-385.]
[8]Ma FF, Shen XL, Lin LF, et al. Primary culture of neonate rattus cardiocyte[J]. Chin J Cardiovasc Rehabil Med, 2009, 18(2):125-128. [马芳芳, 沈晓丽, 林立芳, 等. 新生大鼠心肌细胞的原代培养[J]. 心血管康复医学杂志, 2009, 18(2): 125-128.]
[9]Zhao YM, Zhong GQ, Ke HH. Effects of different conditions on rat bone marrow mesenchymal stem cells differentiating into cardiomyocytes in vitro[J]. Basic Clin Med, 2010, 30(6): 561-565. [赵艳梅, 钟国强, 柯红红. 体外不同诱导条件对大鼠骨髓间充质干细胞分化为心肌细胞的影响[J]. 基础医学与临床, 2010, 30(6): 561-565.]
[10]Kleber AG, Rudy Y. Basic mechanisms of cardiac impulse propagation and associated arrhythmias[J]. Physiol Rev, 2004,84(2): 431-488.
[11]Zhou S. Connexin and electrical conduction properties of sinoatrial node cells[J]. Chin J Card Pacing Electrophysiol,2004, 18(5): 390-391. [周圣. 窦房结细胞缝隙连接蛋白与电传导特性的研究进展[J]. 中国心脏起搏与心电生理杂志,2004, 18(5): 390-391.]
[12]Coppen SR, Kaba RA, Halliday D, et al. Comparison of connexin expression patterns in the developing mouse heart and human foetal heart[J]. Mol Cell Biochem, 2003, 242(1/2): 121-127.
[13]Rackau M, Kreuz MM, Prane M, et al. Gating properties of heterotypic gap junction channels formed of connexins 40, 43,and 45[J]. Biophys J, 2007, 92(6): 1952-1965.
[14]Huang J, Song ZY, Zhang Q. Expression of connexin in sinoatrial node cells and atrial muscle cells in neonatal rats[J]. Chin J Evid Based Cardiovasc Med, 2012, 4(1): 56-58. [黄骥, 宋治远, 张倩.乳鼠窦房结细胞与心房肌细胞缝隙连接蛋白的表达研究[J]. 中国循证心血管医学杂志, 2012, 4(1): 56-58.]
[15]Xu ZP, Zhang GM, Guo ZK, et al. Differential expression of Cx43, Cx45 in rat heart[J]. Chin J Anat, 2003, 26(5): 500. [徐振平, 张光谋, 郭志坤, 等. 大鼠心脏Cx43、Cx45表达的差异[J]. 解剖学杂志, 2003, 26(5): 500.]
[16]Chen SY, Li MW. Advance in research of bone marrow mesenchymal stem cells differentiating into cardiomyocytes[J].Chin Trop Med, 2011, 11(1): 123-125. [陈善义, 李岷雯. 骨髓间充质干细胞分化为心肌细胞的研究进展[J]. 中国热带医学, 2011, 11(1):123-125.]
[17]Potapova I, Plotnikov A, Lu Z. Human mesenchymal stem c ells as a gene delivery system to create cardiac pacemakers[J]. Circ Res, 2004, 94(7): 952-959.
[18]Valiunas V, Doronin S, Valiuniene L. Human mesenchymal stem cells make cardiac connexins and form functional gap junctions[J]. J Physiol, 2004, 555(3): 617-626.

