3.0T磁共振波谱成像在婴幼儿脑白质发育评价中的应用研究
徐文丽,马贺骥,胡铁成,徐基磐,王倩,谭威,高德双
磁共振波谱(MRS)技术的发展使无创性检测活体组织器官的能量代谢、生化改变及特定化合物定量分析成为可能[1-2]。颅脑发育过程中,脑组织尤其是脑白质的结构、功能不断完善,至2岁左右基本成熟,因而,婴幼儿脑发育的变化过程已引起国内外学者的极大关注[3-4]。目前已有许多关于年龄因素对正常脑质发育影响的MRI研究,但鲜见应用MRS对正常婴幼儿脑白质代谢进行观察的报道[5-6]。本文应用3.0T磁共振仪多体素1H-MRS观察180名2岁以内的健康婴幼儿侧脑室旁白质的常见代谢物峰下面积及比值,以期为正常脑发育及脑内异常代谢提供临床诊断依据。
1 材料与方法
1.1 样本收集与分组 纳入辽宁医学院附属第一医院180名健康婴幼儿,年龄0~2岁,共分成6组,每组30名。第1组为出生~3个月,第2组为4~6个月,第3组为7~9个月,第4组为10~12个月,第5组为13~18个月,第6组为19~24个月。入选标准:一般体检显示无异常;除其他部位MRI检查显示无神经系统疾病且无相关病史。
1.2 检查方法 采用德国Siemens Magnetom Verio 3.0T磁共振成像仪,头颅正交线圈。1H-MRS扫描前常规行头颅轴位T1WI、T2WI、T2FLAIR,矢状位T1WI及冠状位T1WI。1H-MRS选用化学位移成像序列(chemical shift imaging sequence,CSI)。感兴趣区(region of interest,ROI)包括侧脑室旁脑白质的正常脑组织解剖区域,大小为6cm×6cm。最小测量体素为1cm3(1.0cm×1.0cm×1.0cm)。TR 1500ms,TE 135ms,层厚10mm,视野16cm×16cm,激励次数3,成像时间417s。扫描程序自动完成接收/发射增益调节、体素内匀场、水抑制,匀场效果达到半高全宽(FWHM)≤8Hz,水抑制≥98%水平。
1.3 波谱后处理 采用Siemens Magnetom Verio工作站对采集的波谱数据进行后处理,获得正常脑组织1H-MRS曲线,不同的化合物在强磁场作用下产生不同的化学位移,通常以磁场频率的百万分之一(ppm)表示。测量侧脑室旁白质的N-乙酰天门冬氨酸(NAA,2.02ppm)、胆碱(Cho,3.20ppm)、肌酸(Cr,3.03ppm)峰下面积,计算NAA/Cho、NAA/Cr、Cho/Cr的值。
1.4 统计学处理 采用SPSS 17.0软件进行统计分析。对数据行方差齐性检验,方差不齐者转换数据。代谢物峰下面积及比值均以s表示,不同年龄组间比较采用单因素方差分析,与年龄的相关性采用Spearman相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 侧脑室旁白质波谱及代谢物峰下面积 出生后25d的新生儿,侧脑室旁白质的波谱代谢物中,Cho为主峰,其次为Cr,NAA峰最低(图1)。随着年龄增加,NAA峰逐渐增高,Cho峰逐渐减低,Cr变化不明显,在出生后6个月时,NAA峰与Cho峰接近,Cr峰最低(图2)。随后NAA峰继续升高,至2岁时,NAA峰已经成为脑室旁白质波谱代谢物的主峰,其次为Cho峰,Cr峰最低(图3)。本研究纳入的180例正常婴幼儿侧脑室旁白质波谱代谢物中,第1组NAA峰下面积最低,均值为14.72,第6组NAA峰下面积最高,均值为18.80,随着年龄增加,峰下面积均值增加。第1组Cho峰下面积最高,均值为20.46,第6组Cho峰下面积最低,均值为17.59,随着年龄增加,峰下面积均值减低。第1组Cr峰下面积最低,均值为10.20,第2至第6组数值变化不明显(表1)。
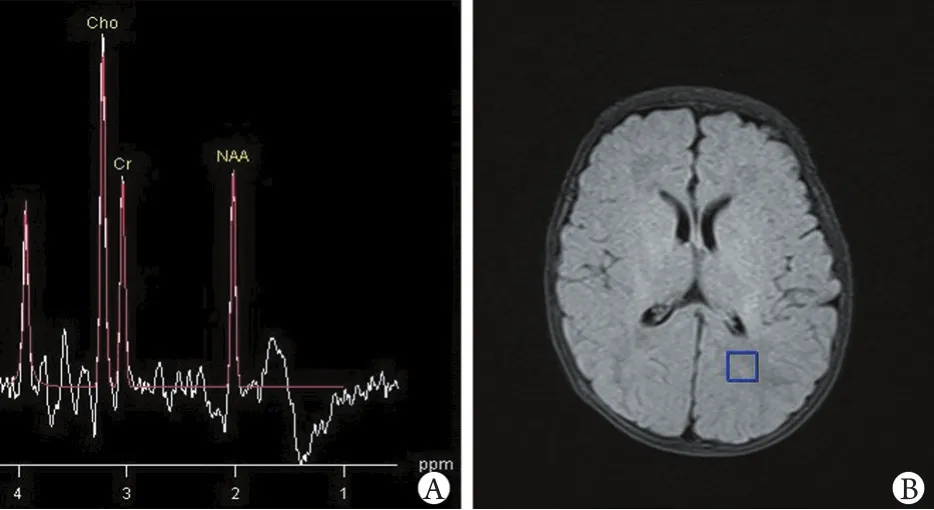
图1 25d新生儿脑室旁白质波谱Fig.1 Spectrum of paraventricular white maはer of a neonate aged 25 days. A is the spectrum of paraventricular white maはer, spectrum of Cho is the main peak, NAA is the second, Cr is the lowest; B is the anatomy of the axial picture of region of interest (ROI)
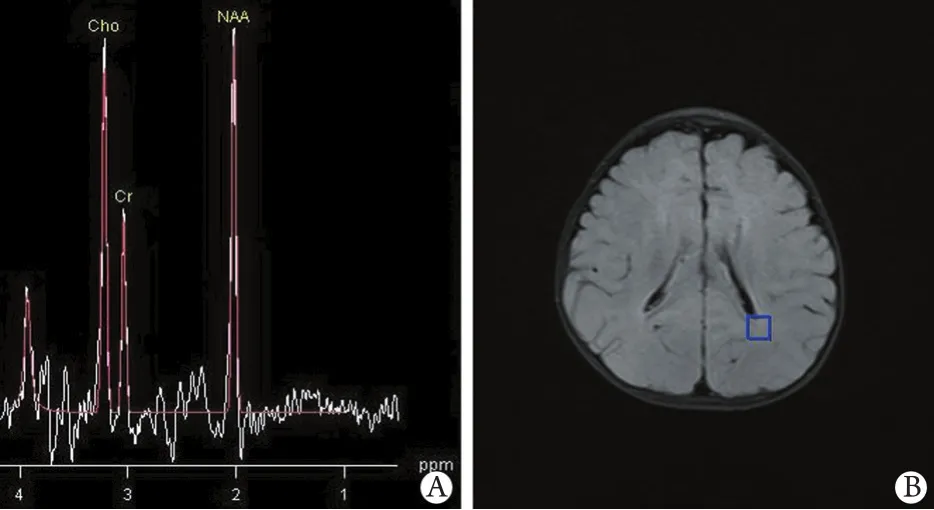
图2 6个月婴儿脑室旁白质波谱Fig.2 Spectrum of paraventricular white matter of an infant aged 6 months. A is the spectrum of paraventricular white matters, spectrum peak of Cho and NAA are similar, and Cr is lower; B is the anatomy of the axial picture of ROI
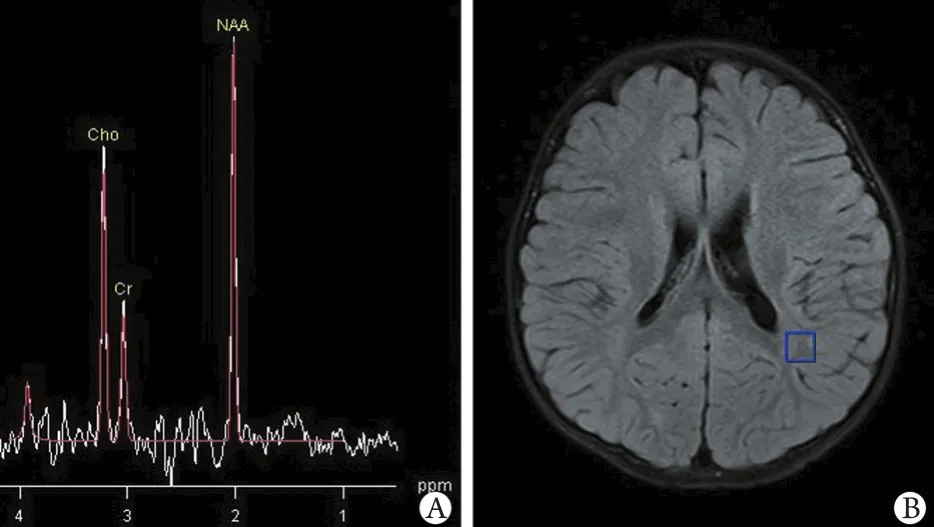
图3 24个月幼儿脑室旁白质波谱Fig.3 Spectrum of paraventricular white matter of a young child aged 24 months. A is the spectrum of paraventricular white matter, spectrum of NAA is the main peak, Cho is the second,Cr is the lowest. B is the anatomy of the axial picture of ROI
2.2 侧脑室旁白质波谱代谢物的峰下面积比值单因素方差分析显示,不同年龄组侧脑室旁白质NAA/Cr、Cho/Cr、NAA/Cho比值差异有统计学意义(P<0.05),其中第2组NAA/Cr、NAA/Cho明显高于第1组,Cho/Cr明显低于第1组(表2)。相关分析显示,侧脑室旁白质NAA/Cho及NAA/Cr与年龄呈正相关(r=0.741,r=0.625,P<0.05),Cho/Cr与年龄呈负相关(r=–0.552,P<0.05)。
表1 各组侧脑室旁白质脑代谢物的峰下面积s,n=30)Tab.1 Peak areas of different metabolites in paraventricular white matter in each group s, n=30)
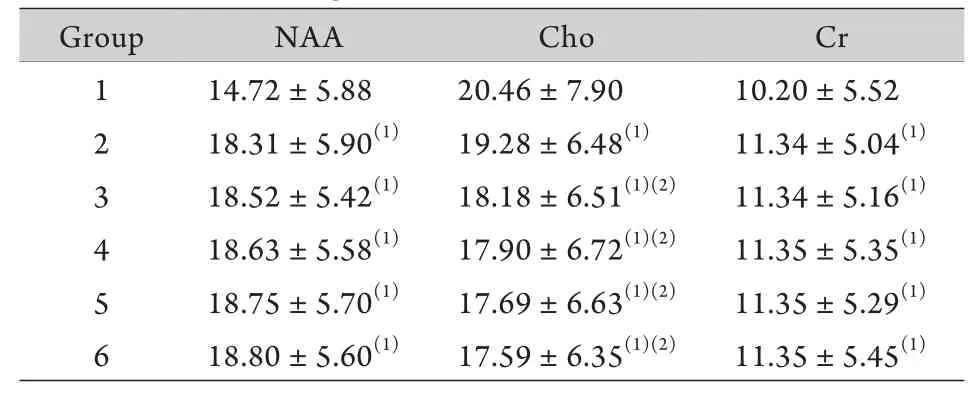
表1 各组侧脑室旁白质脑代谢物的峰下面积s,n=30)Tab.1 Peak areas of different metabolites in paraventricular white matter in each group s, n=30)
(1)P<0.05 compared with group 1; (2)P<0.05 compared with group 2
Group NAA Cho Cr 1 14.72±5.88 20.46±7.90 10.20±5.52 2 18.31±5.90(1) 19.28±6.48(1) 11.34±5.04(1)3 18.52±5.42(1) 18.18±6.51(1)(2) 11.34±5.16(1)4 18.63±5.58(1) 17.90±6.72(1)(2) 11.35±5.35(1)5 18.75±5.70(1) 17.69±6.63(1)(2) 11.35±5.29(1)6 18.80±5.60(1) 17.59±6.35(1)(2) 11.35±5.45(1)
表2 各组侧脑室旁白质脑代谢物峰下面积比值(,n=30)Tab.2 Ratios of peak areas of different metabolites in paraventricular white matter in each group s, n=30)
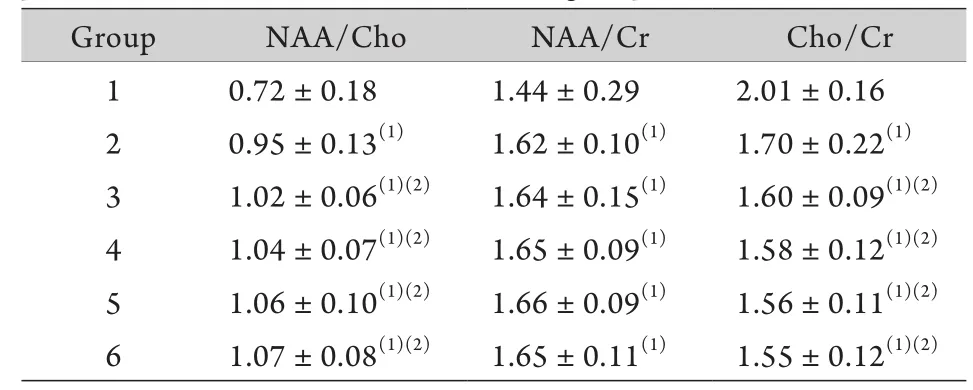
表2 各组侧脑室旁白质脑代谢物峰下面积比值(,n=30)Tab.2 Ratios of peak areas of different metabolites in paraventricular white matter in each group s, n=30)
(1)P<0.05 compared with group 1; (2)P<0.05 compared with group 2
Group NAA/Cho NAA/Cr Cho/Cr 1 0.72±0.18 1.44±0.29 2.01±0.16 2 0.95±0.13(1) 1.62±0.10(1) 1.70±0.22(1)3 1.02±0.06(1)(2) 1.64±0.15(1) 1.60±0.09(1)(2)4 1.04±0.07(1)(2) 1.65±0.09(1) 1.58±0.12(1)(2)5 1.06±0.10(1)(2) 1.66±0.09(1) 1.56±0.11(1)(2)6 1.07±0.08(1)(2) 1.65±0.11(1) 1.55±0.12(1)(2)
3 讨 论
MRS研究始于20世纪80年代,在MRI形态学诊断的基础上,利用化学位移和J-耦合两种物理现象,可无创性地获得人体器官组织内生化代谢方面的信息。随着MRS技术的不断进步,其在婴幼儿脑组织代谢中的研究应用成为可能。3.0T磁共振扫描仪具有更大的化学位移,使MRS个体峰值检出率增强,且每种代谢产物获得的信号增加,更易从背景噪声中分出,从而提高了检测代谢异常的能力[7]。
婴幼儿脑白质具有髓鞘发育不完善、含水量多等特点,未髓鞘化的脑白质在常规MRI的T1WI上呈低信号,T2WI上呈高信号,与脑水肿、白质软化等的MRI表现相似,易导致假阳性诊断。婴幼儿时期很多疾病可导致脑内白质的损伤,其中新生儿缺氧缺血脑病(hypoxic-ischemic encephalopathy,HIE)极易造成脑室旁白质特别是后角旁白质的坏死、软化[8],肿瘤、感染、中毒、梗死、代谢疾病、脑白质病等均可伴发脑白质的代谢异常,但由于小儿脑的特殊性,在MRI传统图像上易与正常脑白质发育相混淆而被漏诊。另外胎儿期或围生期的各种不利因素引起的脑白质发育不良、发育迟缓等亦好发于侧脑室后角旁白质,目前尚无确切的诊断依据。因此探讨正常婴幼儿脑白质发育中脑内代谢物的含量及变化规律,可以为上述疾病的诊断提供依据,具有非常重要的临床意义。
NAA位于2.02ppm,主要由NAA和N-乙酰天门冬谷氨酸盐(NAAG)组成,在脑发育过程中不仅见于神经元,也可见于Ⅱ型星形细胞的原始细胞和未成熟少突胶质细胞,是髓鞘形成中脂肪酸合成乙酰基的供体,因此成为未发育神经组织的标志。Cr位于3.03ppm,是高能磷酸化合物的储备以及ATP和ADP的缓冲剂,标志着脑组织能量代谢。Cho位于3.20ppm,包括磷酸胆碱、磷脂酰胆碱及磷酸甘油胆碱,是神经递质乙酰胆碱的前体,也是细胞膜磷脂代谢的成分之一,参与细胞膜的合成与代谢。Moore[9]认为脑内代谢物变化最显著的时期是在生后的2年内,完全达到成人水平约在4岁。
本研究发现随年龄增加侧脑室旁白质中NAA逐渐增高,Cho逐渐降低,在2岁时趋于稳定,Cr 3个月内升高,4个月后趋于稳定。侧脑室旁脑白质各代谢物比值在不同年龄组间差异有统计学意义(P<0.05)。为了使在不同场强的磁场中获得的结果具有可比性,通常使用一个参照物,将被检测的代谢物共振频率与参照物的共振频率相比,从而获得化学位移的相对值。本研究显示侧脑室旁白质的NAA/Cho、NAA/Cr与年龄呈正相关,Cho/Cr与年龄呈负相关。神经胶质细胞是神经系统尤其是发育期的脑白质内最主要的细胞类型,新生儿期脑白质中胶质细胞轴突、树突及髓鞘发育不完善,NAA含量较低,随着突触修剪、重组髓鞘形成等变化,NAA水平逐渐升高,至2岁时稳定,与文献报道一致[10]。本研究结果显示脑内Cr出生时含量较少,在生后3个月内增长并于4个月后趋于稳定,与Cecil、Hüppi等报道一致[11-12]。NAA/Cho随着时间的变化逐渐升高。Cho峰在脑发育早期主要代表形成细胞膜和髓鞘所需的高浓度底物。Cho含量在生后2年内逐渐降低,在2岁时稳定。NAA/Cho随着两种化合物的变化逐渐升高,于6个月左右NAA、Cho峰发生逆转,Cho峰为出生时的脑内波谱的最高峰,随后Cho峰逐渐减低,Cho/Cr逐渐减低。相关文献报道Cho随着髓鞘化过程逐渐降低,髓鞘化主要发生于妊娠中期到2岁末阶段[11]。有学者认为,Cho含量降低可能是由于其在髓鞘形成过程中转变为MRS所不能发现的髓鞘大分子结构。本研究观察了侧脑室旁白质各代谢物的比值,发现生后3个月内NAA/Cr快速升高,随后逐渐升高,Cho/Cr降低最快,之后逐渐降低,至2岁末进入平台期,与脑内髓鞘发育过程一致,与国外研究结果一致[11]。
综上所述,本研究结果显示,出生后不同时期侧脑室旁白质的代谢物比值不同,且呈现出一定的规律性,与国内外研究结果一致[11,13]。国内相关研究报道基底节区、丘脑中NAA/Cho比值于出生前后上升最快[13],本研究则显示侧脑室旁白质的NAA/Cho比值在出生后前3个月内增长最快,之后逐渐增长。本研究较完整地探讨了脑白质的常见代谢物比值的演变,对之前相关研究的部位及代谢物比值方面进行了补充。
本研究的不足在于单个体素容积小,信号强度较低,采集次数较多,序列扫描时间相对单体素较长,且需要较高的磁场均匀性。
本研究应用3.0T多体素MRS对正常婴儿脑白质发育进行了探讨,结果显示不同年龄的婴幼儿脑内代谢物比值不同,且与年龄相关,为正常婴幼儿脑发育及相关疾病的诊断及鉴别诊断提供一定的影像学依据。
[1]Lin AQ, Shou JX, Li XY. Study of acute cerebral infraction using proton magnetic resonance spectroscopy[J]. J Zhengzhou Univ(Med Sci), 2012, 47(4): 560-563. [林爱琴, 寿记新, 李雪元.急性脑梗死患者氢质子磁共振波谱分析[J]. 郑州大学学报(医学版), 2012, 47(4): 560-563.]
[2]Di Costanzo A, Trojsi F, Tosetti M, et al. High-field proton MRS of human brain[J]. Eur J Radiol, 2003, 48(2): 146-153.
[3]Stiles J, Jernigan TL. The basics of brain development[J].Neuropsychol Rev, 2010, 20(4): 327-348.
[4]Brown TT, Jernigan TL. Brain development during the preschool years[J]. Neuropsychol Rev, 2012, 22(4): 313-333.
[5]Vigneron DB. Magnetic resonance spectroscopic imaging of human brain development[J]. Neuroimaging Clin N Am, 2006,16(1): 75-85.
[6]Inder TE, Huppi PS. In vivo studies of brain development by magnetic resonance techniques[J]. MRDD Reserch Rev, 2000,6(1): 59-67.
[7]Kim JH, Chang KH, Na DG, et al. 3T1H-MR spectroscopy in grading of cerebral gliomas: comparison of short and intermediate echo time sequences[J]. AJNR Am J Neuroradiol,2006, 27(7): 1412-1418.
[8]Han YK, Yang YJ, Shao XM, et al. Neonatal hypoxic ischemic encephalopathy[M]. 2nd Ed. Beijing: People's Medical Publishing House, 2010. 110-111. [韩玉昆, 杨于嘉, 邵肖梅,等. 新生儿缺血缺氧脑病[M]. 2版. 北京: 人民卫生出版社,2010. 110-111.]
[9]Moore GJ. Proton magnetic resonance spectroscopy in pediatric neuroradiology[J]. Pediatr Radiol, 1998, 28(11): 805-814.
[10]Li MR, Li YH.1H-MRS of the normal neonatal brain[J]. Int J Med Radiol, 2011, 34(6): 522-525. [李美蓉, 李玉华. 正常新生儿脑组织1H-MRS研究[J]. 国际医学放射学杂志, 2011,34(6): 522-525.]
[11]Cecil KM, Jones BV. Magnetic resonance spectroscopy of the pediatric brain[J]. Top Magn Reson Imaging, 2001, 12(6): 435-452.
[12]Hüppi PS. MR imaging and spectroscopy of brain development[J]. Magn Reson Imaging Clin N Am, 2001, 9(1):1-17.
[13]Zhang J, Zhao X, Zhang XA, et al. Study of proton magnetic resonance spectroscopy in normal brain development of infants and young children[J]. Clin J Radiol, 2010, 29(4): 510-514. [张君, 赵鑫, 张小安, 等. 正常婴幼儿脑组织发育的1H-MRS研究[J]. 临床放射学杂志, 2010, 29(4): 510-514.]

