胰岛素强化治疗对高血糖肝损伤大鼠的治疗效果观察
马俊勋,赵晓东,杜楠,杨丽萍,苏琴,闫柏刚,杨雪娇,李东惠,党伟,张宪,姚咏明
近年来创伤患者逐渐增多,严重创伤应激性高血糖因被视为预后不良的预警指标越来越受到关注[1]。临床上已有证据显示胰岛素强化治疗可有效减少创伤后并发症的发生,降低伤残及病死率[2],但动物实验仍处于探索阶段,尚无合适的动物模型来研究胰岛素强化治疗在严重创伤中的作用及具体机制。本实验就建立高血糖创伤大鼠模型及胰岛素强化治疗对其肝脏的保护作用进行了探讨。
1 材料与方法
1.1 实验动物及主要试剂 Wistar大鼠购于军事医学科学院实验动物中心,均为雄性,8~12周龄,体重120±20g,清洁级饲养。注射用链脲佐菌素(STZ)、D-半乳糖胺(D-gal,美国Sigma公司),速眠新Ⅱ(北京军事医学科学院)。
1.2 方法
1.2.1 动物模型建立及分组 糖尿病模型制备:大鼠禁食12h,按55mg/kg体重腹腔注射STZ,3d后测尾静脉血糖>13.9mmol/L为糖尿病模型造模成功。肝损伤模型制备:将上述成模高血糖大鼠一次性腹腔注射D-gal(450mg/kg),肝损伤标准为迅速激发肝损伤,肝酶活性水平至少升高至正常范围上限的2倍以上。将成模大鼠随机分成A、B两组,A组为胰岛素强化治疗组(强化治疗组,n=30),B组为血糖相对控制组(常规治疗组,n=30)。两组大鼠均每日4次喂食,饮水不限。A组采用每日4次皮下注射,即早、中、晚喂食前注射普通胰岛素,晚21:30注射中效胰岛素,控制血糖在6~8mmol/L。B组根据每日3餐后的即时血糖注射普通胰岛素,控制血糖在9~12mmol/L。血糖检测采用美国强生血糖仪(检测尾静脉血糖)。两组大鼠在肝损伤后均喂养1周。
1.2.2 一般情况观察 观察大鼠食欲、行为、毛发及死亡情况。
1.2.3 血生化检测及病理观察 分别于肝损伤模型制备前和制备后1、3、5、7d将两组存活大鼠各处死5只(常规治疗组在造模后7d仅存活4只),经腹主动脉抽血,采用全自动生化分析仪检测丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(T-Bil)、白蛋白(ALB)、总蛋白(TP)、碱性磷酸酶(ALP)含量。取1、3、5、7d处死大鼠肝脏右叶处组织,以10%中性甲醛液固定12~48h,制作病理切片,取第7天大鼠肝组织行组织电镜观察。制作正常大鼠肝脏病理切片作为对照。
1.3 统计学处理 采用SPSS 13.0软件进行统计分析,计量资料以表示,经方差齐性检验后两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠造模后一般情况及胰岛素治疗后死亡情况观察 注射STZ造模3d后,大鼠尾静脉测血糖均>13.9mmol/L。随后腹腔注射D-gal,大鼠逐渐出现懒动,进食、进水减少,反抗力度减弱,精神疲惫,毛发站立,步态不稳等现象,部分大鼠出现尿量减少,尿色变黄,大便次数增多,且不成形,呈稀糊样。造模成功后两组大鼠中仅强化治疗组死亡2只。给予胰岛素治疗后,常规治疗组死亡6只(其中第1天4只,第2、7天各1只)。与常规治疗组相比,强化治疗组大鼠相同时间段懒动、进食水、反抗力度、步态及二便等情况明显改善,大鼠死亡数量明显减少,共死亡3只(其中第1天1只,第2、5天各1只)。两组大鼠病死率差异有统计学意义(P<0.01)。
2.2 胰岛素强化治疗后创伤高血糖大鼠肝功能变化模型制备后第1天,常规治疗组与强化治疗组大鼠肝功能指标差异无统计学意义(P>0.05)。第3天与常规治疗组比较,强化治疗组肝功能开始降低,第5、7天肝功能明显降低,至第7天基本接近正常,而常规治疗组虽较前有所下降,但仍高于正常,两者差异有统计学意义(P<0.05或P<0.01,表1)。
2.3 胰岛素强化治疗后高血糖大鼠肝脏的病理变化 正常大鼠肝脏呈红褐色,有光泽,质软,表面光滑。常规治疗组大鼠各时间点肝脏均代偿性增大,有出血。强化治疗组各时间点肝脏稍增大,表面有少许出血点。正常肝脏常规HE染色见肝小叶结构完整,肝细胞多为单核,肝细胞索排列整齐,肝板呈条索状,围绕中央静脉呈放射状排列,肝细胞呈多边形,核大而圆,位于肝细胞中央;肝窦内及汇管区可见少量淋巴细胞浸润,无纤维组织增生(图1A)。肝损伤模型常规病理切片见肝小叶结构破坏,肝细胞变性、糖原消失、局灶性炎性浸润,部分肝细胞破裂,汇管区大量炎性细胞浸润(图1B)。常规治疗组HE染色与肝损伤模型病理所见基本一致,第1、3天时肝细胞变性坏死,炎性细胞浸润,以汇管区显著,至第7天时炎性细胞有所减少,出现少许增生的新生肝细胞(图1C-F)。强化治疗组HE染色见肝小叶破坏较轻,肝小叶完整,肝细胞水肿减轻,第1天病理切片显示肝细胞变性坏死稍减少,炎性细胞浸润与常规治疗组基本一致,第3、5天肝细胞变性坏死较前明显减少,少量炎性细胞浸润,开始出现新生肝细胞,第7天时肝脏基本恢复正常,炎性细胞消失(图1G-J)。
2.4 透射电镜观察 正常大鼠肝细胞体积大小正常,排列紧密;肝细胞核呈圆形或卵圆形,大多单核,核内以常染色质为主,染色质均匀分布,核膜完整;胞质中粗面内质网发达,常分布于线粒体附近,滑面内质网较少,线粒体丰富,内嵴清楚;次级溶酶体偶见,以髓样结构为主;胞质中有时可见脂滴,形状接近圆形或卵圆形(图2A)。常规治疗组可见肝细胞体积增大,胞质疏松,细胞器分散,胞质中脂滴较多;粗面内质网扩张,部分核蛋白体从膜上脱落;线粒体肿胀,嵴断裂或崩解,部分外膜破损;部分胞质中出现呈髓样结构的次级溶酶体(图2B)。强化治疗组肝细胞体积正常,细胞核染色质较均匀分布,部分核膜不完整;细胞质中各细胞器无明显变化,线粒体和粗面内质网体积数量均正常,偶可见初级溶酶体(图2C)。
表1 肝损伤大鼠胰岛素强化治疗后肝功能变化s, n=5)Tab.1 Liver function changes after intensive insulin therapy in wound rats ±s, n=5)
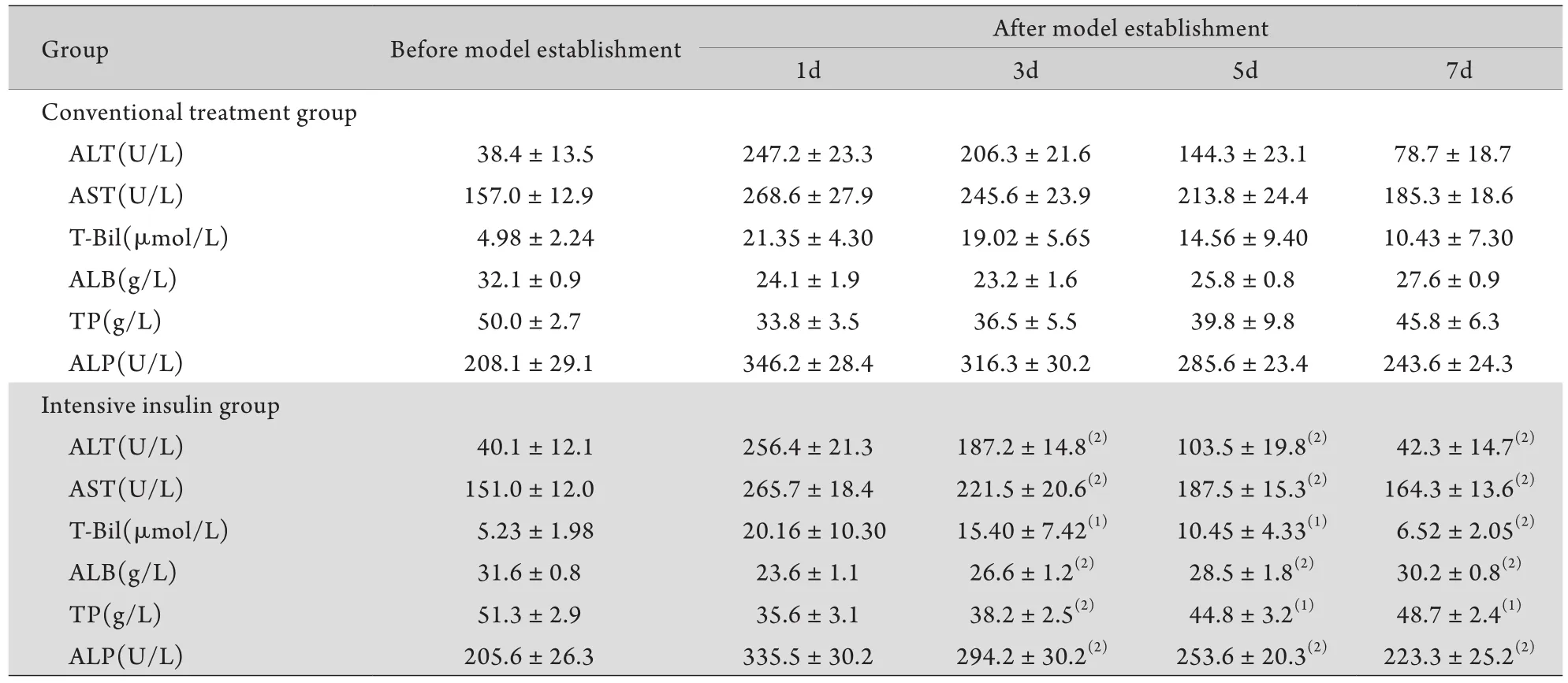
表1 肝损伤大鼠胰岛素强化治疗后肝功能变化s, n=5)Tab.1 Liver function changes after intensive insulin therapy in wound rats ±s, n=5)
(1)P<0.05, (2)P<0.01 compared with conventional treatment group
Group Before model establishment After model establishment 1d 3d 5d 7d Conventional treatment group ALT(U/L) 38.4±13.5 247.2±23.3 206.3±21.6 144.3±23.1 78.7±18.7 AST(U/L) 157.0±12.9 268.6±27.9 245.6±23.9 213.8±24.4 185.3±18.6 T-Bil(μmol/L) 4.98±2.24 21.35±4.30 19.02±5.65 14.56±9.40 10.43±7.30 ALB(g/L) 32.1±0.9 24.1±1.9 23.2±1.6 25.8±0.8 27.6±0.9 TP(g/L) 50.0±2.7 33.8±3.5 36.5±5.5 39.8±9.8 45.8±6.3 ALP(U/L) 208.1±29.1 346.2±28.4 316.3±30.2 285.6±23.4 243.6±24.3 Intensive insulin group ALT(U/L) 40.1±12.1 256.4±21.3 187.2±14.8(2) 103.5±19.8(2) 42.3±14.7(2)AST(U/L) 151.0±12.0 265.7±18.4 221.5±20.6(2) 187.5±15.3(2) 164.3±13.6(2)T-Bil(μmol/L) 5.23±1.98 20.16±10.30 15.40±7.42(1) 10.45±4.33(1) 6.52±2.05(2)ALB(g/L) 31.6±0.8 23.6±1.1 26.6±1.2(2) 28.5±1.8(2) 30.2±0.8(2)TP(g/L) 51.3±2.9 35.6±3.1 38.2±2.5(2) 44.8±3.2(1) 48.7±2.4(1)ALP(U/L) 205.6±26.3 335.5±30.2 294.2±30.2(2) 253.6±20.3(2) 223.3±25.2(2)
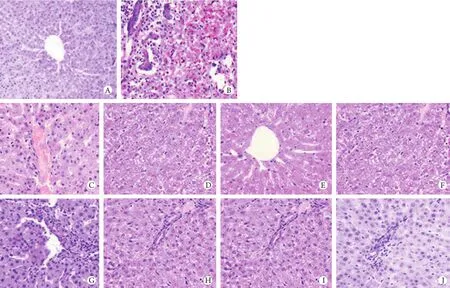
图1 大鼠肝组织病理变化观察(HE)Fig.1 Changes of hepatic pathology (HE)
3 讨 论
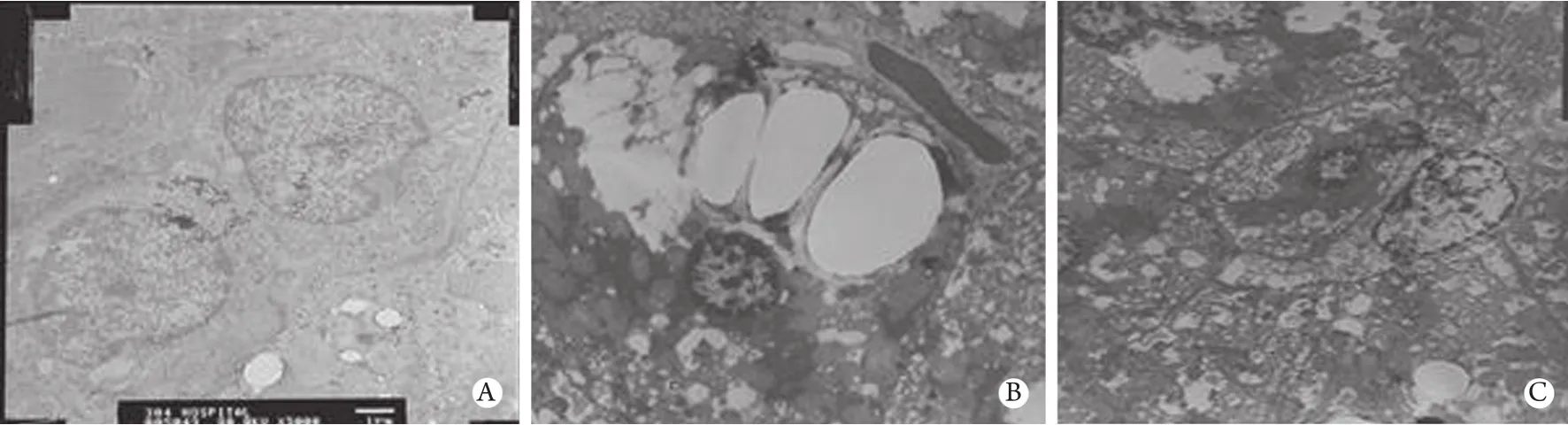
图2 肝细胞透射电镜观察(×5000)Fig.2 Observation of hepatic cells by transmission electron microscope(×5000)
严重创伤患者多因感染[3]、多脏器衰竭[4]等死亡,其中凝血系统紊乱、内皮细胞损伤均与肝脏损伤相关,严重者将发生肝衰竭,导致一系列临床后果。因此,在动物实验中,需要选择一个好的肝脏损伤动物模型,以帮助解决临床无法实现的药物筛选、基础研究、新技术应用等难题。STZ是一种广谱抗菌素,具有抗菌、抗肿瘤活性,以及致糖尿病的副作用,对动物的胰岛细胞具有高度选择毒性作用[5-9],是目前广泛采用的糖尿病动物模型化学诱导剂[10]。有研究指出,大鼠尾静脉注射STZ的成模率可达90%[11]。因腹腔注射较尾静脉注射简捷、准确、快速,现多采用腹腔注射法。本实验经STZ腹腔注射后,大鼠血糖均大于13.9mmol/L,成功造模,且病死率极低。
目前常用的肝损伤模型包括化学性、免疫性、酒精性肝损伤动物模型以及外科手术动物模型[12-21]等。参照国内外文献,本实验采取D-gal腹腔注射制备大鼠肝损伤模型。虽然D-gal作为肝毒剂已被公认,但其造成肝损伤的剂量国内外报道差别较大(100~2300mg/kg)。刘霞等[22]对此模型进行了改进,给予一次性腹腔注射450mg/kg D-gal,制成的急性肝损伤模型具有肝损伤指标明确,病变恒定,重复性好,器官选择性强,周期短,给药适量,动物存活率高等特点。
本课题组查阅文献未发现稳定的严重创伤应激性高血糖动物模型,预实验制备的创伤性休克大鼠模型血糖不理想,仅有20%的大鼠血糖较正常高,且未达到标准,大鼠病死率也较高,故本研究先制备大鼠高血糖模型,再行肝损伤模型制备,取得了较满意的结果。实验大鼠全部造模成功,造模成功后两组大鼠中仅强化治疗组死亡2只。造模成功后给予胰岛素治疗,其中常规治疗组共死亡6只,强化治疗组死亡3只,两组病死率差异有统计学意义(P<0.01)。
本研究中大鼠肝损伤后出现了较为显著的肝功能障碍,表现为ALT、AST、T-Bil升高,ALB、TP降低,ALP升高。与常规治疗比较,胰岛素强化治疗可增加ALB、TP含量、降低ALP水平,明显保护损伤肝脏,且随着时间推移,保护功能加强,至第7天时,强化治疗组大鼠肝功能已基本恢复正常。而常规治疗组肝功能虽较治疗前有所降低,但仍明显高于强化治疗组,表明血糖相对控制后肝脏仍有明显损伤,而胰岛素强化治疗有效降低血糖后,能使受损肝脏得以修复,避免肝衰竭的发生。
肝脏病理大体标本显示,强化治疗组大鼠肝脏基本与正常肝脏一致,有光泽,质软,表面光滑,仅有少许出血点。常规治疗组肝脏则明显增大,色泽暗黑,质地稍硬,有多处出血。HE染色显示常规治疗组肝细胞变性坏死,炎性细胞浸润,以门管区显著,肝小叶破坏。强化治疗组肝小叶完整,肝细胞水肿轻,可见新生肝细胞,至第7天时肝脏基本恢复正常,炎性细胞消失。肝组织透射电镜观察结果与上述一致。
综上所述,肝损伤后肝功能异常,伴随病理改变和肝细胞超微结构变化,给予胰岛素强化治疗后,肝功能、病理及电镜观察均明显改善,提示胰岛素强化治疗控制应激性高血糖后,能降低包括肝衰竭在内的多器官功能衰竭。
[1]Hao DF, Chai JK, Shen CA, et al. Combined use of recombinant human growth hormone and intensive insulin therapy in the treatment of severely burned patients[J]. Med J Chin PLA, 2007,32(12): 1217-1219. [郝岱峰, 柴家科, 申传安, 等. 胰岛素强化治疗与重组人生长激素在危重烧伤救治中的联合应用[J].解放军医学杂志, 2007, 32(12): 1217-1219.]
[2]Zhang SL, Li QW, Fan XH, et al. Effects of intensive insulin therapy on the activity of nuclear factor kappa B in PBMC of the patients with critical illness complicated by hyperglycemia[J].Med J Chin PLA, 2008, 33(2): 207-209. [张胜兰, 李乾望, 范西红, 等. 胰岛素强化治疗对危重症合并高血糖患者外周血单核细胞NF-κB活性的影响[J]. 解放军医学杂志, 2008,33(2): 207-209.]
[3]Huang J, Bai X, Zhang K, et al. Value of leucocyte count and C-reactive protein on bacterial infection of traumatic patients[J]. J Zhengzhou Univ (Med Sci), 2011, 46(5): 800-801. [黄津, 白雪,张凯, 等. 白细胞计数和C-反应蛋白对创伤患者细菌感染的诊断价值[J]. 郑州大学学报(医学版), 2011, 46(5): 800-801.]
[4]Liu HY, Pei H, Pang W, et al. Risk factors analysis of mortality in patients with multiple organ dysfunction syndrome after abdominal trauma[J]. J Zhengzhou Univ (Med Sci), 2009, 44(5):1052-1055. [刘海燕, 裴辉, 庞伟, 等. 腹部创伤合并多器官功能障碍综合征患者病死危险因素分析[J]. 郑州大学学报(医学版), 2009, 44(5):1052-1055.]
[5]Guo XJ, Zou YH, Wu L, et al. Factors affecting the diabetic models induced by streptozocin in SD and wistar rats[J]. Acta Lab Anim Sci Sinica, 2008, 16(4): 301-304. [郭学军, 邹移海, 吴凌,等. 链脲佐菌素诱导SD和Wistar大鼠糖尿病模型的影响因素[J]. 中国实验动物学报, 2008, 16(4): 301-304.]
[6]Liu XZ, Xiao H. Study on diabetic model in rats induced by streptozotocin[J]. J Jingzhou Med Coll, 2001, 22(4): 11-14. [刘学政, 萧鸿. 链脲佐菌素致糖尿病大鼠模型的研究[J]. 锦州医学院学报, 2001, 22(4): 11-14.]
[7]Wu QH, Gu WW, Yuan J. Observation of diabetes rat induced by streptozotocin[J]. Lab Anim Comp Med, 2006, 26(4): 247-248.[吴清洪, 顾为望, 袁进. 链脲佐菌素诱导1型糖尿病大鼠体征观察[J]. 实验动物与比较医学, 2006, 26(4): 247-248.]
[8]Liu FH, Guo HG, Lou Q, et al. Primary observation on hyperglycemic models in mongolian gerbils induced by different dosage of streptozotocin[J]. Lab Anim Comp Med, 2010, 30(5):335-339. [刘锋华, 郭红刚, 楼琦, 等. 不同剂量链脲佐菌素诱发长爪沙鼠高血糖模型的初步观察[J]. 实验动物与比较医学, 2010, 30(5): 335-339.]
[9]Zhang J, Wu JF, Zheng HE, et al. Experimental study on diabetic model of rats induced by streptozotocin[J]. J Hebei North Univ(Med Ed), 2006, 23(4): 6-8. [张静, 吴靖芳, 郑慧娥, 等.链脲佐菌素致大鼠糖尿病模型的实验研究[J]. 河北北方学院学报(医学版), 2006, 23(4): 6-8.]
[10]Rakieten N, Rakieten ML, Nadkarni MV. Studies on the diabetogenic action of streptozotocin(NSC-37917)[J]. Cancer Chemother Rep, 1963, 29: 91-98.
[11]Huang B, Liu XZ, Pang DB. Study on diabetic model in rats induced by Streotozotocin in different ways[J]. J Jingzhou Med Coll, 2003, 24(1): 19-21. [黄波, 刘学政, 庞东渤. 不同途径注射链脲佐菌素致大鼠糖尿病模型的研究[J]. 锦州医学院学报, 2003, 24(1): 19-21.]
[12]Zhang XW, Geng XL, Huang LH, et al. Contrast experiment of rat and mice liver injury induced by carbon tetrachloride[J].Basic Med Sci Clin, 2003, 23(3): 351-352. [张孝卫, 耿秀兰, 黄丽华, 等. 四氯化碳致大鼠、小鼠肝损伤的对比实验[J]. 基础医学与临床, 2003, 23(3): 351-352.]
[13]Nakama T, Hirono S, Moriuchi A, et al. Etoposide prevents apoptosis in mouse liver with D-galactosamine/lipopolysaccharide-induced fulminant hepatic failure resulting in reduction of lethality[J]. Hepatology, 2001, 33(6): 1441-1450.
[14]Gu CH, Zhu BL, Xu J, et al. Study of mice hepatic injury indeced by D-galactosamine[J]. Occup Health, 2009, 25(22): 2364-2366. [顾呈华, 朱宝立, 徐军, 等. D-半乳糖诱导小鼠肝损伤模型的方法研究[J]. 职业与健康, 2009, 25(22): 2364-2366. ]
[15]Macrides TA, Naylor LM, Kalafatis N, et al. Hepatoprotective effects of the shark bile salt 5beta-scymnol on acetaminopheninduced liver damage in mice[J]. Fundam Appl Toxicol, 1996,33(1): 31-37.
[16]Yang SC, Yang CH, Ma XF, et al. An experimental study of acute immune liver injury model established by intraperitoneal injection of BCG and LPS on mouse[J]. Lab Anim Sci, 2008,4(8): 1-4. [杨舒淳, 杨昌华, 马小凡, 等. 小鼠腹腔注射卡介苗加脂多糖建立急性免疫性肝损伤的实验研究[J]. 实验动物科学, 2008, 4(8): 1-4.]
[17]Nicoletti F, Beltrami B, Raschi E, et al. Protection from concanavalin A (Con A)-induced T cell-dependent hepatic lesions and modulation of cytokine release in mice by sodium fusidate[J]. Clin ExpImmunol, 1997, 110(3): 479-484.
[18]Tong Y, Yan XD. Research of acute liver injury induced by carbon tetrachloride[J]. Chin J Food Hyg, 2000, 12(6): 10-11. [童英,闫向东. 四氯化碳急性肝损伤敏感指标的研究[J]. 中国食品卫生杂志, 2000, 12(6): 10-11.]
[19]Fourneau I, Pirenne J, Roskams T, et al. An improved model of acute liver failure based on transient ischemia of the liver[J].Arch Surg, 2000, 135(10): 1183-1189.
[20]Awad SS, Hemmila MR, Soldes OS, et al. A novel stable reproducible model of hepatic failure in canines[J]. J Surg Res,2000, 94(2): 167-171.
[21]Niu Z. Report of acute hepatic failure rat medel induced by D-galactosamine[J]. J Chin Med, 1981, 61(6): 350. [钮振. D-氨基半乳糖形成大鼠急性肝衰竭的初步报告[J]. 中华医学杂志, 1981, 61(6): 350.]
[22]Liu X, Wang TL, Zhao JB, et al. Rat model of liver injury induced by D-galactosamine[J]. J China-Japan Friendship Hosp, 1996,10(4): 305-308. [刘霞, 王泰龄, 赵静波, 等. D-半乳糖胺致大鼠急性肝损伤模型制作的改进[J]. 中日友好医院学报,1996, 10(4): 305-308.]

