急性冠脉综合征患者高密度脂蛋白亚组分的抗炎、抗氧化功能研究
谭迎,田迪,赖文岩,郭志刚
流行病学调查和动物实验表明,血浆高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平与心血管疾病发生风险呈高度负相关关系[1]。然而,近年来已有大量研究证实HDL-C水平高低并不能准确代表高密度脂蛋白(high-density lipoprotein,HDL)的整体功能,HDL-C水平作为HDL功能的度量标准以及冠心病发病风险的预测指标存在明显的局限性,对HDL质(HDL功能)的关注较HDL量(HDL-C水平)的关注更为重要。最新的基础和临床研究发现,在急性期反应、慢性炎症以及一些代谢性疾病中,HDL的抗动脉粥样硬化(atherosclerosis,AS)作用减弱,甚至出现致AS作用[2]。急性冠脉综合征(acute coronary syndrome,ACS)发生时,患者机体处于一种特殊炎症及氧化应激环境中,如急性心肌梗死患者体内促炎因子趋化因子配体-16(cxc chemokine ligand,CXCL16)较慢性AS患者明显升高[3],这种微环境的改变可能导致HDL结构和功能发生改变,从而使其失去抗AS作用。由此,我们推测ACS的发生可能导致HDL发生失功能改变,从而失去正常抗AS作用。本研究通过超高速密度梯度离心分离提取HDL亚组分,比较ACS患者及健康对照人群HDL亚组分的抗氧化功能及抗炎指标,明确ACS患者HDL亚组分是否发生失功能性改变,从而为AS及冠心病的防治提供新的思路。
1 资料与方法
1.1 研究对象 纳入2011年1月-2012年1月在南方医院心内科住院的40例ACS患者,作为ACS组。其中,男27例,女13例,年龄51.5±6.2岁。纳入标准:符合不稳定性心绞痛的临床表现,冠脉造影示至少有一支血管狭窄>50%,心肌酶谱及肌钙蛋白升高和(或)心电图有动态改变,确诊为ACS。排除标准:未控制平稳的高血压、糖尿病、肝肾功能异常、甲状腺功能异常、肿瘤、自身免疫性疾病、任何急性或慢性炎症性疾病、甘油三酯≥5mmol/L及体重指数(BMI)≥30kg/m2、近6周内服用调脂药物及中成药。另外,将同期在我院体检的40例健康体检者列入对照组。其中,男27例,女13例,年龄49.2±5.0岁。对照组无冠心病及高脂血症病史,且除外高血压、糖尿病、肝肾功能异常、甲状腺功能异常、肿瘤、自身免疫性疾病、任何急性或慢性炎症性疾病及血脂代谢异常相关疾病。本研究获得伦理委员会批准,所有入选者均为自愿参加并签署知情同意书。
1.2 方法
1.2.1 血脂及超敏C反应蛋白(hsCRP)检测 抽取两组人群清晨空腹静脉血5ml,静置30min后离心取血清,置于-80℃冰箱保存备用。采用酶学终点比色法在全自动生化分析仪上检测血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)及HDL-C浓度;采用透射比浊法检测血清hsCRP浓度。
1.2.2 HDL亚组分的分离提取 采用Karlsson等[4]两步非连续性超高速密度梯度离心方法分离提取HDL亚组分。EDTA抗凝全血20ml,离心后收集血浆并加入EDTA(1mg/ml)和蔗糖(终浓度0.5%)以防HDL氧化和凝集。用0.3816g/ml固体溴化钾调整血浆密度至1.24g/ml,取4ml置于规格为8.9ml的离心管底部,缓慢加入溴化钾/PBS缓冲液(0.0834g/ml,密度1.063g/ml),用考马斯亮蓝着色蛋白(此试管作为分离收集HDL的参考)。超高速离心机(Beckman L-80,Ti90转子固定转角)290 000×g,15℃离心4h[离心后离心管上层为极低密度脂蛋白(VLDL)和低密度脂蛋白(LDL),中层为HDL2和HDL3]。用注射器穿刺离心管分别抽取HDL2和HDL3,置两离心管中,再分别缓慢加入溴化钾/PBS溶液(0.3816g/ml,密度至1.24g/ml),290 000×g,15℃离心2h(HDL2和HDL3均漂浮于离心管上层),分别收集上层液体。将两种液体在含200μmol/L EDTA的PBS液中透析48h,超滤除菌,4℃保存。
1.2.3 HDL亚组分对氧磷酶-1(paraoxonase-1,PON1)活性测定 采用Farid等[5]的乙酸苯酯法检测PON1活性。取反应缓冲液 (CaCl22mmol/L,Tris-HCl 0.1mol/L,pH8.0)1.3ml,加入5mmol/L的乙酸苯酯150μl,于25℃预温20min后,加入1:10倍稀释的HDL亚组分60μg(稀释液为反应缓冲液)反应90s,用0.5mol/L EDTA 100μl终止反应。采用分光光度计于270nm波长处测定吸光度(A)值。同时设立血清对照和底物对照。PON1活性=(A×f×FV×103)/(t×SV×L×ε)。其中A为净吸光度值,f为标本稀释倍数,FV为反应终体积,t为反应时间,SV为样品体积,L为光径,ε为摩尔消光系数,270nm波长时乙酸苯酯的ε=1310L/mol。酶的活性单位定义为:每分钟催化1μmol乙酸苯酯水解所需的酶量为1U。
1.2.4 HDL亚组分脂氢过氧化物(lipid hydroperoxides,LOOH)含量检测[6]采用二甲苯酚橙显色实验法检测。取HDL2或HDL3溶液90μl,加10μl硝酸三甲苯酯(TPP,10mmol/L)或甲醇混匀,37℃反应30min;加入FOX反应液[250μmol/L硫酸亚铁、100μmol/L 二甲酚橙、25mmol/L H2SO4、4mmol/L 2, 6-二叔丁基对甲酚(BHT)溶于90%甲醇中]900μl,混匀,室温反应30min;室温下12 000×g离心5min,取上清液测A560值,以加与不加TPP时的A560值之差计算LOOH含量。
1.2.5 HDL亚组分炎症指数检测[7]采用非细胞学法检测。将2,7-二氢二氯荧光黄双乙酸钠(DCFHDA)溶于新鲜甲醇(终浓度2mg/ml),室温下避光孵化30min,制成2,7-二氢二氯荧光黄(DCFH)溶液;将10μl 1-棕榈酰-2-(5,6-环氧异前列腺素E2)锡甘油-3-磷酸胆碱(PEIPC)溶液(终浓度为50μg/ml)和含HDL2或HDL3的上清液(先用胆固醇试剂盒测定胆固醇量,胆固醇终浓度为10μg/ml)90μl在黑聚苯乙烯微盘中混合,37℃烤箱孵化1h;再在微盘的每个孔中加入10μl浓度为0.2mg/ml的DCFH溶液混合,37℃烤箱中孵化2h;用荧光分析仪分析荧光强度,如数值小于1,则判断HDL颗粒有抗炎作用;如数值大于1,则有促炎作用(HDL缺乏时,将PEIPC氧化DCFH所形成的荧光强度标准化为数值1)。
1.3 统计学处理 采用SPSS 13.0软件进行统计分析。计量资料以s表示,检验各组变量正态分布情况,非正态分布的变量经对数转换后再分析,采用F检验进行方差齐性检验,两样本均数比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组基本临床资料比较 与对照组比较,ACS组血清LDL-C水平明显升高,差异具有统计学意义(P<0.01);此外,ACS组血清hsCRP浓度亦较正常对照组明显升高(P<0.01);而两组年龄、TC、TG及HDL-C水平比较无明显差异(P>0.05,表1)。
2.2 两组HDL亚组分PON1活性、LOOH含量及炎症指数比较 ACS组HDL亚组分PON1活性与对照组比较均明显下降,差异有统计学意义(P<0.001);而ACS组LOOH含量则较对照组明显升高,差异具有统计学意义(P<0.001)。ACS组亚组分炎症指数与对照组比较均明显升高,差异有统计学意义(P<0.001)。与同组内HDL2相比,ACS组及对照组HDL3的LOOH水平均明显升高,差异具有统计学意义(P<0.05或P<0.001)。对照组内HDL3炎症指数较HDL2明显升高,差异有统计学意义(P<0.001);而ACS组内HDL2和HDL3炎症指数比较,差异无统计学意义(表2)。
表1 ACS组与对照组基本临床资料比较(Tab. 1 Comparison of basic clinical data between ACS group and control group (
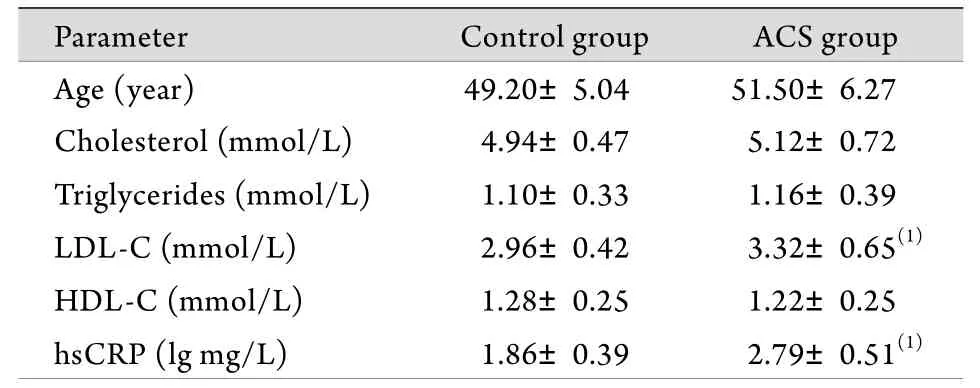
表1 ACS组与对照组基本临床资料比较(Tab. 1 Comparison of basic clinical data between ACS group and control group (
LDL-C. Low-density lipoprotein cholesterol; HDL-C. Highdensity lipoprotein cholesterol; hsCRP. High-sensitivity C-reactive protein; (1)P<0.01 compared with control group
Parameter Control group ACS group Age (year) 49.20±5.04 51.50±6.27 Cholesterol (mmol/L) 4.94±0.47 5.12±0.72 Triglycerides (mmol/L) 1.10±0.33 1.16±0.39 LDL-C (mmol/L) 2.96±0.42 3.32±0.65(1)HDL-C (mmol/L) 1.28±0.25 1.22±0.25 hsCRP (lg mg/L) 1.86±0.39 2.79±0.51(1)

表2 两组HDL亚组分PON1活性、LOOH含量及炎症指数的比较Tab. 2 Comparison of HDL subclasses--PON1 activity, LOOH levels and in fl ammatory index between ACS group and control group
3 讨 论
HDL作为多功能的蛋白复合体,其结构和组成成分的改变直接关系到HDL颗粒的整体功能。当体内微环境改变时,可通过改变HDL的组成成分和结构影响HDL的功能。体外实验发现,氧化损伤可损害HDL主要组成蛋白载脂蛋白A-I(apolipoprotein A-I,apoA-I)的逆胆固醇转运功能[8]。有报道,从冠心病患者血浆分离出的HDL中髓过氧化物酶的两种产物(氯酪氨酸和硝基酪氨酸)均明显升高,提示氧化损伤可能与HDL失功能改变相关[9]。
PON1活性和LOOH是评估HDL抗氧化功能的两个重要指标。PON1作为HDL的组成部分,直接参与脂蛋白中过氧化物的水解,防止过氧化物在LDL中聚集,甚至减少氧化型低密度脂蛋白中溶血磷脂的量,进而抑制氧化型低密度脂蛋白的生物活性,发挥血管保护作用[10]。有研究表明,脂质过氧化损伤参与了AS的病理生理过程[8,11]。脂质过氧化物LOOH作为机体氧化应激发生时的早期生物学指标,亦可反映HDL的抗氧化功能。本研究结果显示,与对照组相比,ACS组患者HDL亚组分PON1活性明显下降(P<0.001),而LOOH水平则较对照组明显升高(P<0.001),ACS组患者HDL亚组分不仅抗氧化功能明显减弱,甚至可能具有促氧化作用,提示ACS的发生可损害HDL功能甚至使其转变为具有致AS作用的颗粒。
HDL通过抑制LDL氧化而减轻斑块内的炎症反应,以发挥其抗AS作用。高密度脂蛋白炎症指数(high-density lipoprotein in fl ammatory index,HII)可反映HDL的抗炎功能,HII<1时提示HDL具有抗炎作用,>1时则有促炎作用[1]。研究发现,在慢性炎症状态,如系统性红斑狼疮和风湿性关节炎发生时,AS发生率升高,并与HII相关[12]。本研究证实,在ACS患者,HDL亚组分转变成具有促炎作用的颗粒,这可能与ACS发生时各种炎性刺激有关,本研究ACS组血清hsCRP浓度亦较对照组明显升高(P<0.001),间接提示炎症可能参与了HDL亚组分的失功能改变。炎症反应的加剧可加速AS的进展,推测失功能促炎促氧化HDL颗粒的产生可能是加剧AS进展的一个重要机制。
此外,我们还发现,尽管在ACS组HDL亚组分失去了其正常的抗氧化功能并转变为具有促炎作用的颗粒,但ACS组和对照组的HDL-C水平并无明显差异(P>0.05),提示HDL功能可独立于HDL-C水平成为预测AS发生风险的又一重要指标,同时进一步证实HDL-C水平在预测AS及CAD发生风险时存在局限性。
HDL亚组分主要由HDL2和HDL3组成,HDL3逐渐成熟成为HDL2,HDL2颗粒较HDL3体积更大但密度则较小,包含有更多的apoA-I,大量研究证实HDL2较HDL3具有更好的心血管保护作用,但也有一些专家认为,两者具有同等程度的心血管保护作用[13]。本研究分别对ACS组及对照组内HDL2和HDL3功能进行了比较,证实不论是对照组还是ACS组,LOOH水平在HDL2中均较HDL3中低,且对照组HDL2炎症指数亦较HDL3下降,差异具有统计学意义;ACS组HDL2和HDL3炎症指数差异虽无统计学意义,但HDL2炎症指数与HDL3比较有降低趋势。结果提示,与HDL3相比,HDL2可能具有更强的抗炎、抗氧化功能,从而可发挥更好的心血管保护作用。
综上所述,本研究证实ACS患者HDL亚组分发生了失功能改变,由具有抗炎、抗氧化作用的颗粒转变成为具有促炎促氧化作用的颗粒,这种亚组分的产生可能是AS及冠心病加剧的一个新机制;同时,还发现HDL2较HDL3可能具有更好的心血管保护作用。HDL-C水平在预测AS及CAD发生风险时存在局限性,HDL功能的评估有望独立于HDL-C水平成为预测AS发生风险的又一重要指标甚至可发挥更好的预测作用。
[1]Patel PJ, Khera AV, Jafri K, et al. The anti-oxidative capacity of high-density lipoprotein is reduced in acute coronary syndrome but not in stable coronary artery disease[J]. J Am Coll Cardiol,2011, 58(20): 2068-2075.
[2]Ansell BJ, Watson KE, Fogelman AM, et al. High-density lipoprotein function recent advances[J]. J Am Coll Cardiol,2005, 46(10): 1792-1798.
[3]Lehrke M, Millington SC, Lefterova M, et al. CXCL16 is a marker of in fl ammation, atherosclerosis, and acute coronary syndromes in humans[J]. J Am Coll Cardiol, 2007, 49(4): 442-449.
[4]Karlsson H, Leanderson P, Tagesson C, et al. Lipoproteomics II: mapping of proteins in high-density lipoprotein using twodimensional gel electrophoresis and mass spectrometry[J].Proteomics, 2005, 5(5): 1431-1445.
[5]Farid AS, Nakahara K, Murakami N, et al.Decreased serum paraoxonase-1 activity during intestinal nematode(Nippostrongylus brasiliensis) infection in rats[J]. Am J Trop Med Hyg, 2008, 78(5): 770-776.
[6]Nourooz-Zadeh J, Tajaddini-Sarmadi J, Wolff SP. Measurement of plasma hydroperoxide concentrations by the ferrous oxidationoxylenol orange assay in conjunction with triphenylphosphin[J].Anal Biochem, 1994, 220(2): 403-409.
[7]Ansell BJ, Navab M, Hama S, et al. Inflammatory/antiinflammatory properties of high-density lipoprotein distinguish patients from control subjects better than highdensity lipoprotein cholesterol levels and are favorably affected by simvastatin treatment[J]. Circulation, 2003, 108(22):P2751-P2756.
[8]Lin ZC, Zhang M. Role of myeloperoxidase and polymorphism in coronary artery disease and acute coronary sysdromes[J].Acta Acad Med CPAPF, 2010, 19(3): 220-225. [林章超, 张梅.髓过氧化物酶及其基因多态性在冠心病和急性冠脉综合征中的作用[J]. 武警医学院学报, 2010, 19(3): 220-225.]
[9]Heinecke JW. The HDL proteome: a marker--and perhaps mediator--of coronary artery disease[J]. J Lipid Res, 2009,50(Suppl): S167-S171.
[10]Fuhrman B, Gantman A, Aviram M. Paraoxonase 1 (PON1)deficiency in mice is associated with reduced expression of macrophage SR-BI and consequently the loss of HDL cytoprotection against apoptosis [J]. Atherosclerosis, 2010,211(1): 61-68.
[11]Hao DQ, Han WJ, Liu HL. Analysis of visfatin and adiponectin in patients with acute coronary syndrome[J]. J Zhengzhou Univ(Med Sci), 2012, 47(3): 373-376. [郝冬琴, 韩文杰, 刘恒亮. 急性冠脉综合征患者血清内脂素和脂联素水平分析[J]. 郑州大学学报(医学版), 2012, 47(3): 373-376.]
[12]McMahon M, Grossman J, FitzGerald J, et al. Proin fl ammatory high-density lipoprotein as a biomarker for atherosclerosis in patients with systemic lupus erythematosus and rheumatoid arthritis[J]. Arthritis Rheum, 2006, 54(8): 2541-2549.
[13]Eren E, Yilmaz N, Aydin O. High density lipoprotein and it's dysfunction[J]. Open Biochem J, 2012, (6): 78-93.

