环境低温对失血性休克猪血流动力学及氧动力学的影响
张雪峰,张成,高广荣,蒋会勇,吕晨光,张宝磊,谢名双,张智丽,余筣
失血性休克(hemorrhagic shock,HS)无论在平时还是战时都是造成伤病员死亡的主要原因,其救治也一直是战创伤外科研究的重点。在我国东北及高海拔地区的冬季,室外温度常在0℃以下,在这种环境下一旦发生HS,伤病员就要面对休克和低温的双重考验。但是目前,环境低温对HS的影响,临床研究和动物实验的结论尚不统一。大量回顾性临床资料表明环境低温是造成HS患者预后不良的主要原因[1],虽然也有动物实验支持这一结论[2-3],但更多的研究发现低温环境暴露非但没有加重HS的病情,反而改善了HS的预后[4-5]。为了对这一矛盾现象做出合理解释,本研究观察模拟低温环境对HS猪血流动力学、氧动力学、核心体温及预后的影响。
1 材料与方法
1.1 主要仪器及材料 S/5多功能监护仪(芬兰Datex-Ohmeda);Vigilance心排量监护仪(美国Edwards Systems Technology);Bayer Rapidlab 865型血气分析仪(德国拜耳公司);中心静脉导管及肺动脉漂浮导管(美国爱德华生命科学公司);压力传感器(新加坡 Biosensors International PET. Ltd);SD/SC-376BP型低温冷柜(浙江星星公司);巴马香猪[合格证号SYXK(军)2007-001,黑龙江省双鸭山市实创科技小型猪养殖中心]。
1.2 麻醉方法及动物准备 清洁级健康成年巴马香猪32只,雌雄不拘,体重17~25kg,实验前12h禁食,自由饮水。采用氯胺酮20mg/kg及阿托品0.5mg肌内注射诱导麻醉,1.5%~2.0%异氟醚面罩吸入5min后行气管内插管,呼吸机辅助呼吸。调整呼吸频率为14~16次/min,潮气量为10ml/kg,设定FiO2为25%,FiN2为75%,此模式可维持PO2在100mmHg左右,PCO2在40mmHg左右。在无菌条件下于右侧颈部切开,显露右侧颈外静脉,插入肺动脉导管,用于监测肺动脉温度、肺动脉压和混合静脉血氧浓度;右侧腹股沟区切开,显露右侧股动、静脉,分别插入深静脉导管,用于放血、监测血压和中心静脉压等;直肠内放置温敏电极用于监测直肠温度。外科操作一般在90min内可完成,手术过程中通过保温毯及灯泡加温维持猪核心体温在38.5~39.5℃。操作结束后调整吸入醚浓度在1.0%~1.5%以保证猪不躁动(以四肢无扭动为标准),稳定60min后开始基础检测及模型建立。
1.3 失血性休克模型的建立 采用定容性失血性休克模型,通过股静脉在15min内匀速放出40%血量(按30ml/kg体重计算),放血开始前进行基础检测,记为休克0min。当平均动脉压(MAP)降到50mmHg时将吸入醚浓度调整到1.0%,MAP降到40mmHg时调整到0.5%,MAP降到30mmHg以下时调整到0.2%,放血结束后5min为便于观察组间差异将吸入醚浓度调整到1.0%。在动物出现躁动等应激表现时给予吗啡15mg静脉注射,吗啡剂量饱和后可给予维库溴铵0.2mg/kg静脉注射。实验过程中所有动物不进行液体复苏,观察终点为休克后240min或动物死亡。
1.4 动物分组及干预 32只巴马香猪随机分为4组(n=8)。①正常对照组(C组):置管后不建立休克模型,在室温(22℃)下观察;②室温休克组(A组):模型建立后置于室温下观察;③低温休克组(H组):模型建立后置于-10℃环境下观察;④保温休克组(F组):模型建立后置于室温下观察并维持肺动脉温度为38.5~39.5℃。
1.5 检测指标及方法 休克模型建立前(0min)、休克模型建立后60min内每15min及其后的每30min记录或检测1次肺动脉温度(Tp)、直肠温度(Tr)、心率(HR)、MAP、肺动脉压(PAP)、肺动脉楔压(PAWP)、中心静脉压(CVP)、心输出量(CO)、血红蛋白(Hb)、混合静脉血氧饱和度(SvO2)及动脉血气分析结果。氧动力学指标按下列公式换算:氧摄取率(O2ER)=VO2/DO2=(CaO2-CvO2)/CaO2×100%;氧供指数(DO2I)=CaO2×CI×10;氧耗指数(VO2I)=(CaO2-CvO2)×10×CI。其中VO2=(CaO2-CvO2)×CI,DO2=CaO2×CI,CaO2=1.38×Hb×SaO2,CvO2=1.38×Hb×SvO2,CI=CO/体表面积。
1.6 统计学处理 采用SPSS 11.0软件进行统计分析,数据结果以x±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t法,生存分析采用Kaplan-Meier法,P<0.05为差异有统计学意义。
2 结 果
2.1 核心体温变化 正常对照组虽未建立HS模型,但Tp在休克后15min就下降至36℃并在观察期间一直维持在35~36℃。室温休克组的Tp变化趋势与正常对照组相似,两组各时间点比较无显著差异(P>0.05)。低温休克组Tp在前120min内与正常对照组和室温休克组比较无显著差异(P>0.05),但从休克后120min开始明显下降,与室温休克组和正常对照组比较差异有统计学意义(P<0.05);与保温休克组比较,正常对照组、室温休克组、低温休克组Tp明显下降(P<0.05,图1)。Tr与Tp的变化趋势相同(数据未提供)。
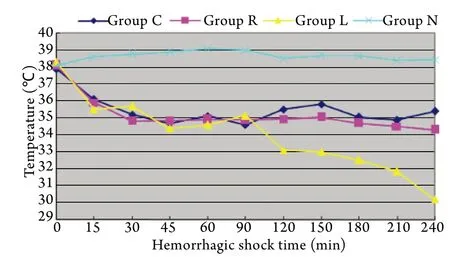
图1 休克后不同时间点各组肺动脉温度变化Fig. 1 Pulmonary arterial temperature at different hemorrhagic shock time
2.2 血气分析指标变化 建模前后各时间点各组的PO2、PCO2及pH值比较差异均无统计学意义(P>0.05)。保温休克组乳酸水平仅在休克后240min显著高于低温休克组(P<0.05),其他时间点与室温休克组和低温休克组比较差异无统计学意义(表1)。
2.3 血流动力学变化 建模后3个休克组的HR从100次/min左右迅速上升至160~180次/min,并始终维持在较高水平,与对照组比较差异有统计学意义(P<0.05)。室温休克组和低温休克组的HR在各时间点差异均无统计学意义(P>0.05);在前90min内保温休克组HR的变化趋势与室温休克组和低温休克组相同(P>0.05),但从休克后90min开始与室温休克组差别逐渐明显(P<0.05)。3个休克组各时间点的MAP及MPAP变化差异均无统计学意义(P>0.05,表1)。
表1 休克后不同时间点各组HR、MPAP、MAP、乳酸、DO2I、VO2I及O2ER的变化Tab. 1 Changes of HR, MPAP, MAP, lactate, DO2I, VO2I and O2ER at different hemorrhagic shock time in 4 groups
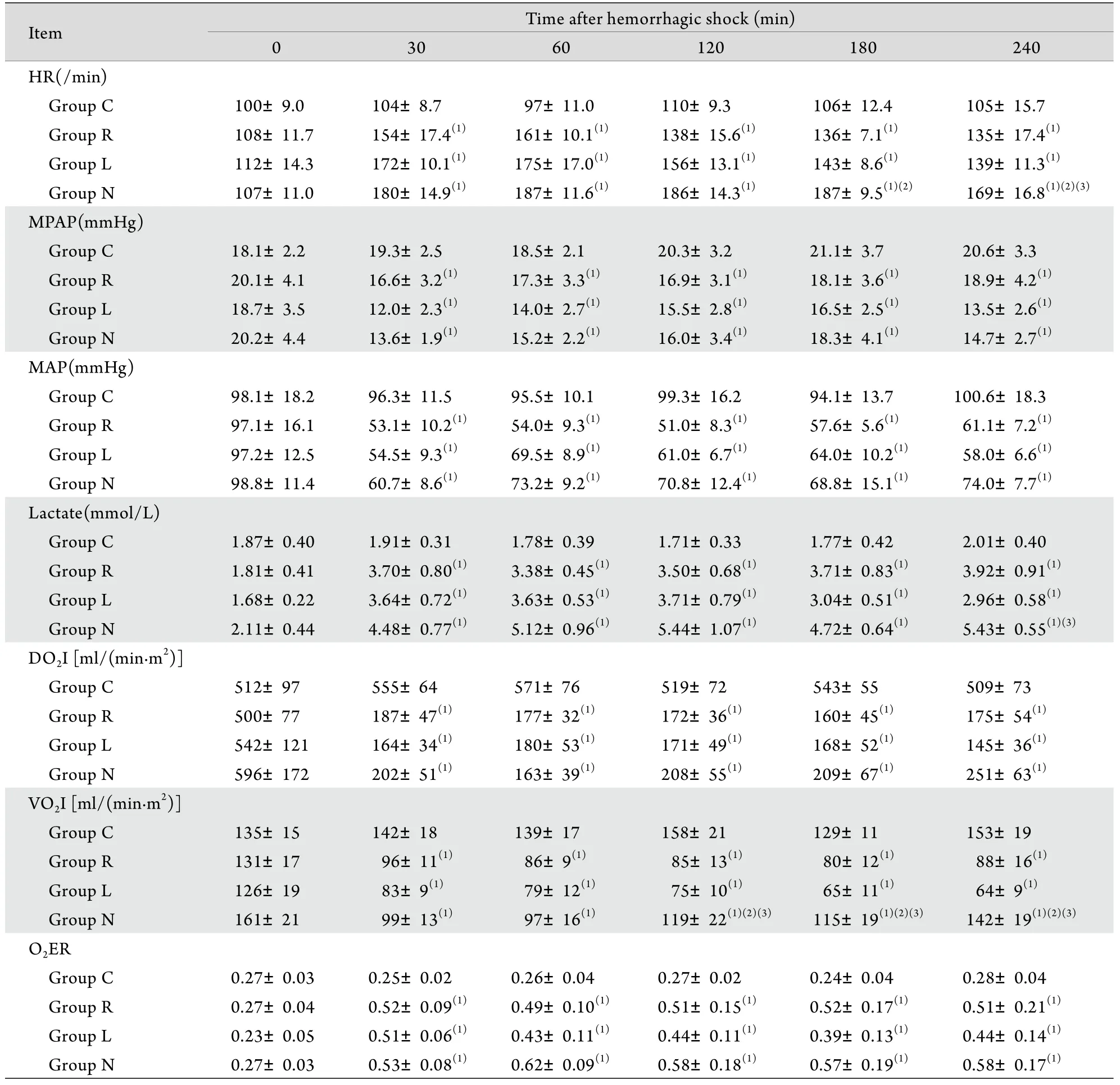
表1 休克后不同时间点各组HR、MPAP、MAP、乳酸、DO2I、VO2I及O2ER的变化Tab. 1 Changes of HR, MPAP, MAP, lactate, DO2I, VO2I and O2ER at different hemorrhagic shock time in 4 groups
Group C. Control group; Group R. Shock under room temperature; Group L. Shock under low ambient temperature; Group N. Shock under normal body temperature. (1)P<0.05 compared with group C; (2)P<0.05 compared with group R; (3)P<0.05 compared with group L
30 60 120 180 240 HR(/min)Group C 100±9.0 104±8.7 97±11.0 110±9.3 106±12.4 105±15.7 Group R 108±11.7 154±17.4(1) 161±10.1(1) 138±15.6(1) 136±7.1(1) 135±17.4(1)Group L 112±14.3 172±10.1(1) 175±17.0(1) 156±13.1(1) 143±8.6(1) 139±11.3(1)Group N 107±11.0 180±14.9(1) 187±11.6(1) 186±14.3(1) 187±9.5(1)(2) 169±16.8(1)(2)(3)MPAP(mmHg)Group C 18.1±2.2 19.3±2.5 18.5±2.1 20.3±3.2 21.1±3.7 20.6±3.3 Group R 20.1±4.1 16.6±3.2(1) 17.3±3.3(1) 16.9±3.1(1) 18.1±3.6(1) 18.9±4.2(1)Group L 18.7±3.5 12.0±2.3(1) 14.0±2.7(1) 15.5±2.8(1) 16.5±2.5(1) 13.5±2.6(1)Group N 20.2±4.4 13.6±1.9(1) 15.2±2.2(1) 16.0±3.4(1) 18.3±4.1(1) 14.7±2.7(1)MAP(mmHg)Group C 98.1±18.2 96.3±11.5 95.5±10.1 99.3±16.2 94.1±13.7 100.6±18.3 Group R 97.1±16.1 53.1±10.2(1) 54.0±9.3(1) 51.0±8.3(1) 57.6±5.6(1) 61.1±7.2(1)Group L 97.2±12.5 54.5±9.3(1) 69.5±8.9(1) 61.0±6.7(1) 64.0±10.2(1) 58.0±6.6(1)Group N 98.8±11.4 60.7±8.6(1) 73.2±9.2(1) 70.8±12.4(1) 68.8±15.1(1) 74.0±7.7(1)Lactate(mmol/L)Group C 1.87±0.40 1.91±0.31 1.78±0.39 1.71±0.33 1.77±0.42 2.01±0.40 Group R 1.81±0.41 3.70±0.80(1) 3.38±0.45(1) 3.50±0.68(1) 3.71±0.83(1) 3.92±0.91(1)Group L 1.68±0.22 3.64±0.72(1) 3.63±0.53(1) 3.71±0.79(1) 3.04±0.51(1) 2.96±0.58(1)Group N 2.11±0.44 4.48±0.77(1) 5.12±0.96(1) 5.44±1.07(1) 4.72±0.64(1) 5.43±0.55(1)(3)DO2I [ml/(min·m2)]Group C 512±97 555±64 571±76 519±72 543±55 509±73 Group R 500±77 187±47(1) 177±32(1) 172±36(1) 160±45(1) 175±54(1)Group L 542±121 164±34(1) 180±53(1) 171±49(1) 168±52(1) 145±36(1)Group N 596±172 202±51(1) 163±39(1) 208±55(1) 209±67(1) 251±63(1)VO2I [ml/(min·m2)]Group C 135±15 142±18 139±17 158±21 129±11 153±19 Group R 131±17 96±11(1) 86±9(1) 85±13(1) 80±12(1) 88±16(1)Group L 126±19 83±9(1) 79±12(1) 75±10(1) 65±11(1) 64±9(1)Group N 161±21 99±13(1) 97±16(1) 119±22(1)(2)(3) 115±19(1)(2)(3) 142±19(1)(2)(3)O2ER Group C 0.27±0.03 0.25±0.02 0.26±0.04 0.27±0.02 0.24±0.04 0.28±0.04 Group R 0.27±0.04 0.52±0.09(1) 0.49±0.10(1) 0.51±0.15(1) 0.52±0.17(1) 0.51±0.21(1)Group L 0.23±0.05 0.51±0.06(1) 0.43±0.11(1) 0.44±0.11(1) 0.39±0.13(1) 0.44±0.14(1)Group N 0.27±0.03 0.53±0.08(1) 0.62±0.09(1) 0.58±0.18(1) 0.57±0.19(1) 0.58±0.17(1)Item Time after hemorrhagic shock (min)0
2.4 氧动力学变化 建模后3个休克组的DO2I均从正常水平[500ml/(min·m2)]迅速下降至200ml/(min·m2)左右,并始终维持在该水平,3组间比较差异无统计学意义,但均明显低于对照组(P<0.05)。同样,3个休克组的VO2I在建模后也明显下降,并维持在较低水平,与对照组比较差异有统计学意义(P<0.05),其中低温休克组与室温休克组各时间点比较差异均无统计学意义(P>0.05),而从休克后90min开始保温休克组VO2I逐渐升高,低温休克组和室温休克组比较差异显著,但仍明显低于对照组(P<0.05)。建模后3个休克组的O2ER迅速升高,与对照组比较差异显著(P<0.05),但3组间比较无明显差异(P>0.05,表1)。
2.5 生存率变化 观察期间室温休克组和低温休克组均无动物死亡,而保温休克组有4只动物分别于45、60、120、180min死亡,Kaplan-Meier生存分析显示保温休克组与其他3组比较差异显著(P=0.025)。
3 讨 论
在野外及战场条件下,HS患者经常遇到低温等不利的救治条件。据报道,美军在阿富汗战场上经常要在低于0℃的环境下经4~6h才能将伤病员从受伤地送达战地医院[6],因此研究环境低温对HS自然病程的影响具有重要意义。猪在体温调控机制及心血管系统对HS反应等方面与人相似,常用于研究HS对血流动力学的影响,故本实验采用定容性猪HS模型。
本研究发现,环境低温虽然使HS猪的核心温度进行性下降,且在休克120min后更为明显,但其血流动力学、血气分析、氧动力学指标及预后与室温休克组比较均无明显差异,某些指标甚至还有改善的趋势。相反,保温休克组虽然核心温度正常,且血气指标、MAP、MPAP、DO2I及O2ER与室温休克组比较均无明显差异,但其HR、VO2I、乳酸及预后均较室温休克组明显恶化。O2ER虽未表现出统计学差异,但保温休克组始终保持在高水平,而低温休克组却降低明显。上述数据显示,环境低温对HS有益,加温保护对HS有害。
虽然本研究结果显示环境低温对HS有益,与文献报道[4-5]类似,但进一步分析发现麻醉过程对实验产生了重要影响,可能是造成本研究结果与临床观念矛盾的根本原因。正常对照组猪虽未建立HS模型,但核心温度亦明显下降,Tp在休克后15min就迅速下降到36℃,在观察期间一直维持在35℃左右,平均降幅达4.0℃,其核心温度下降的幅度和时相与室温休克组比较无明显差异,表明室温休克组猪的核心温度下降并非休克本身造成,而是由麻醉引起的外周血管扩张和体温调节中枢抑制所致。按照Bergstein等[7]的观点,40%血容量丧失可能还不足以引起核心温度下降。George等[4]和Wu等[5]在HS研究中也发现体表降温法迅速降低核心温度的实质是麻醉产生的诱导性低温,体表降温只不过加快了降温速度。另外,虽然低温休克组的核心温度下降比室温休克组更明显,后期两者相差平均达3.0℃,但各项指标并没有表现出恶化趋势,考虑除诱导性低温的保护作用外,麻醉条件下肌松剂对寒冷反应的抑制也是重要原因。一般情况下,机体核心温度下降后可出现剧烈的寒战反应。既往研究已证实机体寒战反应的发生80%是由于核心温度下降造成的,体表温度下降只发挥20%的作用[8]。本研究中低温休克组虽然体温较低,但并未观察到任何一只实验猪出现寒战反应,考虑是由于寒战反应受抑在造成机体产热减少、核心温度下降的同时,也必然降低了能量损耗,增加了组织细胞对损伤的耐受性。因此,我们虽然得出环境低温对HS有益的结果,但应充分考虑麻醉因素的影响。
同样,虽然本研究结果显示维持核心温度正常可导致HS猪死亡率明显增加,但并不能因此否定保温措施对HS的保护作用。休克时机体为保证重要脏器的灌注及核心温度正常,通常四肢及末梢循环的血液供应会减少,导致体表温度下降,这是机体的一种代偿机制,但国内外在动物实验过程中均采用灯泡加温及保温毯保温等措施维持核心温度稳定,这些保温措施是从外向内的,体表温度升高必然导致末梢血管大量开放、扩张,循环血容量被重新分布,对正常动物可能影响不大,但对HS猪则会破坏已有的代偿机制,其结果必然是有效循环血容量锐减,休克加重,死亡率增加。因此保温休克组的情况只是实验条件下的特例,其结果并不能反映HS时的真实情况。
本研究结果揭示了诱导性低温对HS的作用,表明动物实验结果与临床认知之间存在一定矛盾。目前虽然越来越多的研究表明HS时自发性低温和诱导性低温有着本质区别:自发性低温是因无氧代谢及能量产生不足引起的,其结果是ATP耗竭,出现低温、酸中毒及凝血障碍恶性三联征[9];而通过人为方法实现的诱导性低温可使ATP得以保存,细胞耐受应激能力增强[10-11]。但实际工作中很难将二者区别开来,尤其是开展诱导性低温时,仍有很多实际问题尚未解决。
本研究虽未得出低温环境对HS有害的结论,但发现麻醉是影响实验结果的重要因素之一。目前国内用猪作为实验动物研究HS的单位较少,但国外研究HS的病理生理改变多采用麻醉下猪HS模型,我们认为这种模型不能反映HS时内环境改变的真实情况,以此为平台进行的研究不能得出科学的结论,应该建立一种更贴近临床实际的动物模型。
[1]Shafi S, Elliott AC, Gentilello L. Is hypothermia simply a marker of shock and injury severity or an independent risk factor for mortality in trauma patients? Analysis of a large national trauma registry[J]. J Trauma, 2005, 59(5): 1081-1085.
[2]Lu SM, Lu QJ, Liu JC, et al. The effects of immersion in seawater of different temperature on the hemodynamics of traumatohemorrhagic shock rats[J]. Med J Chin PLA, 2004, 29(12):1020-1022. [陆松敏, 卢青军, 刘建仓, 等. 不同温度海水浸泡对创伤合并失血性休克大鼠血流动力学的影响[J]. 解放军医学杂志, 2004, 29(12): 1020-1022.]
[3]Shang LQ, Wang W, Yu JY, et al. Effects of hypothermia on the survival of seawater-immersed rabbits with open abdominal wound and effect of early rewarming[J]. Med J Chin PLA, 2010,35(12): 1496-1498.[尚立群, 王伟, 虞积耀, 等. 低温对兔海水浸泡腹部开放伤生存率的影响及早期复温的作用观察[J].解放军医学杂志, 2010, 35(12): 1496-1498.]
[4]George ME, Mulier KE, Beilman GJ. Hypothermia is associated with improved outcomes in a porcine model of hemorrhagic shock[J]. J Trauma, 2010, 68(3): 662-668.
[5]Wu X, Kochanek PM, Cochran K, et al. Mild hypothermia improves survival after prolonged, traumatic hemorrhagic shock in pigs[J]. J Trauma, 2005, 59(2): 291-299.
[6]Bilski TR, Baker BC, Grove JR, et al. Battlefield casualties treated at Camp Rhino, Afghanistan: lessons learned[J]. J Trauma, 2003,54(5): 814-821.
[7]Bergstein JM, Slakey DP, Wallace JR, et al. Traumatic hypothermia is related to hypotension, not resuscitation[J]. Ann Emerg Med, 1996, 27(1): 39-42.
[8]Cheng C, Matsukawa T, Sessler DI, et al. Increasing mean skin temperature linearly reduces the core-temperature thresholds for vasoconstriction and shivering in humans[J]. Anesthesiology,1995, 82(5): 1160-1168.
[9]Moore EE. Staged laparotomy for the hypothermia, acidosis, and coagulopathy syndrome[J]. Am J Surg, 1996, 172(5): 405-410.
[10]Fan ZX, Li YP, Qin J, et al. Effects of pre-arrest and post-arrest therapeutic hypothermia on post-resuscitation myocardium in rabbits[J]. Med J Chin PLA, 2012, 37(6): 592-597.[范振兴, 李银平, 秦俭, 等. 治疗性低温及其诱导时机对兔复苏后心肌的影响[J]. 解放军医学杂志, 2012, 37(6): 592-597.]
[11]Seekamp A, van Griensven M, Hildebrandt F, et al. Adenosinetriphosphate in trauma-related and elective hypothermia[J]. J Trauma, 1999, 47(4): 673-683.

