去甲肾上腺素在觉醒肽促醒酒精性昏迷大鼠中的作用
王天昊,樊双义,闫洁,陈远,马朋林
多年来,受限于对觉醒系统的认识,昏迷治疗的研究未取得重大突破。觉醒肽(orexins)的发现使人们对睡眠/觉醒的认识进入了新阶段,也为昏迷的治疗提供了广阔前景。研究发现,虽然分泌orexins的神经元仅位于下丘脑外侧区(LHA),但其神经纤维却可投射到网状上行激动系统包括蓝斑在内的广泛区域,更重要的是该核内神经元属去甲肾上腺素能(NA)神经元[1-2]。因此,Ohno等[3]推 测orexins可能作用于肾上腺能神经系统,通过促进去甲肾上腺素的释放来发挥对睡眠/觉醒的调节作用。
酒精性昏迷是临床上常见的昏迷类型,因易导致严重呼吸循环抑制而受到广泛关注。贾晓军等[4]的研究证实,脑室注射orexin-A可缩短酒精性昏迷大鼠的昏迷时间,且存在剂量-效应依赖关系,提示orexin-A对酒精性昏迷起促醒作用。然而,orexin-A促醒机制是否与肾上腺素能神经系统的激活相关尚无定论。本实验通过向酒精性昏迷大鼠模型脑室内注入特异性去甲肾上腺素受体阻断剂,以翻正反射(LORR)持续时间和大鼠皮层脑电δ波作为评价指标,探讨orexin-A对酒精性昏迷的促醒作用与去甲肾上腺素系统的关系。
1 材料与方法
1.1 实验动物及分组 健康成年雌性SPF级SD大鼠24只(由第三军医大学实验动物中心提供),体重200±30g。按随机数字排序分组法,将大鼠分为对照组、觉醒肽(orexin-A)组、阻断剂哌唑嗪(prazosin)组及prazosin+orexin-A组4组。
1.2 主要溶液配置 人工脑脊液(ar tif icial cerebrospinal fluid,ACSF)中各种离子成分及其浓度(mmol/L)分别为:NaCl 126.0,KCl 2.5,CaCl22.0,MgCl22.0,NaH2PO41.25,NaHCO326.0,葡萄糖10.0。采用ACSF溶解配制成4nmol/5μl、4nmol/10μl两种浓度的orexin-A溶液,配置剂量参考文献[5-6]。取无水乙醇以生理盐水稀释配制成32%乙醇溶液。采用新鲜ACSF配制成63μg/5μl、63μg/10μl两种浓度的Prazosin溶液。
1.3 酒精昏迷大鼠模型的建立及意识状态分级参照El Ya coubi等[7]的方法建立酒精昏迷大鼠模型。大鼠腹腔注射32%乙醇溶液(14ml/kg)。大鼠意识状态分为6级,分别为:Ⅰ级,笼内活动如常;Ⅱ级,笼内活动减少;Ⅲ级,笼内活动减少并运动失调;Ⅳ级,背部位于笼底部时能滚动(LORR存在),但不能站立;Ⅴ级,LORR消失,但对疼痛刺激有肢体回缩反应;Ⅵ级,对任何刺激无反应。其中Ⅴ、Ⅵ级被认为是昏迷状态[8]。本实验以LORR作为昏迷的判断标准。
1.4 脑电皮层电极及侧脑室套管安放 以4%戊巴比妥钠腹腔注射麻醉大鼠(30mg/kg),将大鼠头部固定,安装电极。额叶电极:前囟前2mm,中线左旁开2mm;顶叶双电极:前囟后6mm,中线旁开左、右4mm,深度以触及硬脑膜为度(0.7~1.0mm)。参照Paxinos-Watson图谱埋置自制侧脑室金属套管。部位:前囟后1.5mm,中线旁1.5mm,深度3.0mm,套管直径0.8mm。电极安放后,动物饲养2周。进行皮层脑电图(ECoG)记录时,将记录导线与脑皮层电极相连,接入RM6240多道生理信号采集处理系统。记录脑电图,以δ波所占脑电波比例多少作为昏迷深度的判断指标。随着昏迷深度增加,δ波所占脑电波的百分比增加。将给药前δ波所占的百分比标准化为1,根据δ波百分比变化判断给药是否加深或减轻昏迷。
1.5 给药方式 大鼠LORR消失后,各组均通过侧脑室埋置的金属套管微注射实验药物。对照组脑室注入10μl ACSF;orexin-A组脑室注入10μl orexin-A(4nmol/10μl);prazosin组脑室注入去甲肾上腺素α1受体阻断剂prazosin(63μg/5μl);prazosin+orexin-A组脑室注入prazosin(63μg/5μl)后再注入orexin-A 5μl(4nmol/5μl)。
1.6 统计学处理 采用SPSS 13.0软件进行统计分析,所有计量资料以x±s表示,组间比较采用单因素方差分析,组间不同时间点比较采用重复测量的方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 侧脑室不同给药对酒精性昏迷大鼠LORR持续时间的影响 与对照组比较,给予orexin-A后LORR持续时间明显缩短(2.9±0.3 vs 1.85±0.35,P<0.01);给予prazosin后,LORR持续时间明显延长(2.9±0.3 vs 4.55±0.55,P<0.01);在预先给予prazosin处理后再给予orexin-A,与对照组比较LORR持续时间无明显缩短(2.9±0.3 vs 3.05±0.45,P>0.05),与orexin-A组比较LORR持续时间明显延长(P<0.01,图1)。

图1 侧脑室不同给药对酒精昏迷大鼠LORR持续时间的影响Fig.1 Effects of different administration into lateral cerebral ventricle on the duration of LORR of alcohol coma rats
2.2 侧脑室给药后不同时间对酒精性昏迷大鼠ECoG中δ波比例的影响 随着给药时间延长,对照组δ波相对百分比逐渐下降。与对照组比较,给予orexin-A后大鼠δ波相对百分比下降速率显著加快(P<0.01); 给予prazosin的大鼠,5min后δ波相对百分比明显升高(96.46±6.55 vs 122.82±9.18,P<0.01);先给予prazosin预处理,再给予orexin-A,δ波相对百分比与对照组比较无明显差异(P>0.05),但与orexin-A组比较差异有统计学意义(P<0.01,图2)。
3 讨 论
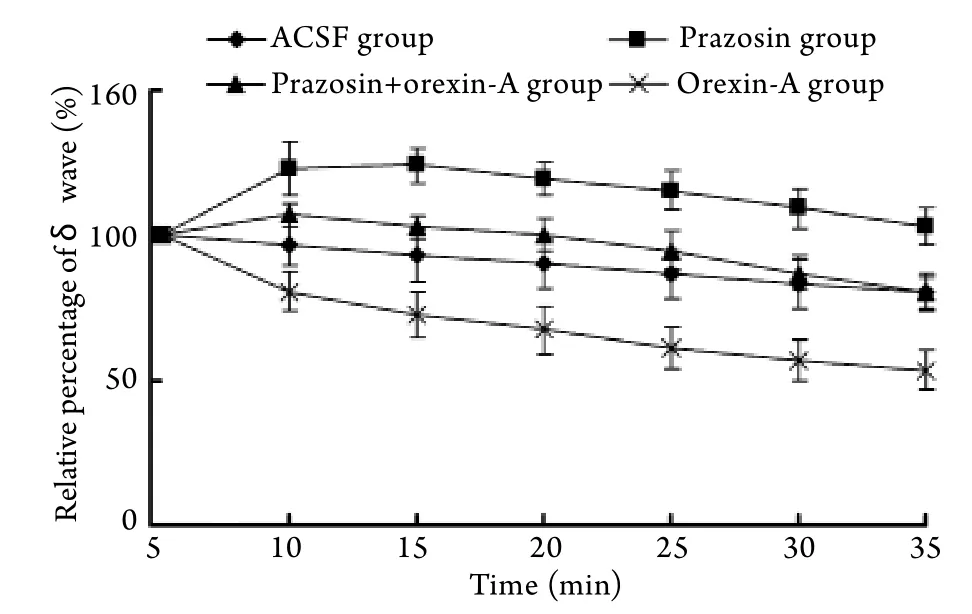
图2 侧脑室给药后不同时间对酒精昏迷大鼠ECoG中δ波比例的影响Fig.2 Effect of different time after administration into lateral ventricle on the ratio of δ of ECoG of alcohol coma rats
昏迷是觉醒系统结构受损或功能受抑所致[9],昏迷的促醒治疗是临床和基础研究的热点。传统观点认为觉醒系统即指脑干上行网状激活系统,目前观点认为,存在于下丘脑的orexins在觉醒系统中起启动作用,直接调节和影响着上行网状激活系统的功能,被称为机体的“觉醒启动区”[9-10],是调节睡眠和觉醒的关键神经元。贾晓军等[4]前期研究发现orexins不仅可调节睡眠觉醒,还可对昏迷起促醒作用,但其机制还需进一步研究。
去甲肾上腺素是传统的兴奋性神经递质,NA神经元主要存在于低位脑干,其中蓝斑的NA相对集中,同时也是重要的觉醒区域。蓝斑神经元放电及去甲肾上腺素的释放在觉醒时最大,慢波睡眠时降低,快眼动相(rapid eye movement,REM)睡眠时最小。研究发现,具有遗传性多巴胺到去甲肾上腺素转化缺陷的小鼠,其NA受体的激活作用减弱,会导致睡眠时间延长并且在应激状态下不易唤醒[11]。orexins神经元(大鼠约3000个,人约50 000个)仅分布于下丘脑外侧区,但orexins神经元纤维却可投射到上行激动系统的广泛区域。在orexins发现之前人们已经发现大脑内的许多神经递质与睡眠或觉醒相关,如单胺能(去甲肾上腺素、组胺、5-羟色胺)等兴奋性神经递质,腺苷、P物质、GABA等抑制性神经递质等[12],但它们如何相互作用以促进觉醒或睡眠尚未阐明。orexins的发现使人们重新认识了这些递质及其与orexins的关系。
近期研究发现,orexins的觉醒机制与传统的兴奋性单胺能神经递质相关[3]。Bourgin等[13]发现,在蓝斑中局部应用orexin-A,可剂量依赖性抑制REM睡眠、增加觉醒,并可使蓝斑的NA神经元放电频率增加。同时,orexins受体OX1R大量表达于富含NA神经元的蓝斑。Kushikata等[14]对orexin A减少大鼠的实验发现,皮层下去甲肾上腺素系统主要参与了orexin A的促觉醒功能。上述研究均证明orexin对觉醒的促醒作用机制与NA系统有关。
本研究通过运用两种经典的监测手段——LORR持续时间和皮层脑电图来评判实验大鼠的意识状态[15],以探讨orexins对酒精性昏迷这一临床常见昏迷的促醒机制是否也与兴奋单胺能神经系统(如去甲肾上腺素)相关。其中,皮层脑电图可直接在大脑皮层区域连续监测皮层脑电活动状况,其振幅比头皮脑电图大10倍,灵敏度高。昏迷时皮层脑区电活动频率明显减慢、δ波所占比例增加。采用向侧脑室内给予去甲肾上腺素α1受体阻断剂prazosin阻断NA系统的激活,观察其对orexin-A逆转酒精性昏迷作用的影响,结果显示,与给予orexin-A的促醒作用相反,给予prazosin的大鼠与对照组相比,5min后δ波相对百分比明显升高,并持续30min以上,LORR持续时间亦显著延长,提示阻断去甲肾上 腺素递质的作用可显著加深昏迷的程度。进一步研究发现,先给予prazosin预处理再给予orexin-A,与对照组相比,δ波比例并没有因orexin-A而降低,LORR持续时间亦并未因orexin-A的兴奋性作用而缩短,即orexin-A的兴奋作用被prazosin阻断。此结果提示NA系统的激活是orexin-A对酒精性昏迷大鼠促醒的重要机制之一。
综上所述,orexin-A对酒精性昏迷大鼠有良好的促醒作用。但是目前暂无临床可用的orexin-A,且价格昂贵,本研究证实其促醒作用机制为临床寻找新的促醒药物提供了线索。
[1]Kotagal S. The emerging role of hypocretin (orexin-a) in the developing central nervous system[J]. Sleep, 2012, 35(2): 171-172.
[2]Marcus JN, Aschkenasi CJ, Lee CE. Differential expression of orexin receptors 1 and 2 in the rat brain[J]. J Comp Neurol,2001, 435(1): 6-25.
[3]Ohno K, Sakurai T. Orexin neuronal circuitry: role in the regulation of sleep and wakefulness[J]. Front Neuroendocrinol,2008, 29(1): 70-87.
[4]Jia XJ, Wang YF, Hu ZA. Arousal effects of orexin-A on coma induced by acute alcohol intoxication in rats[J]. Acta Acad Med Mil Tertiae, 2006, 28(8): 750-752. [贾晓军, 王艳芳, 胡志安.Orexin-A对急性乙醇中毒昏迷大鼠的实验性促醒疗效研究[J]. 第三军医大学学报, 2006, 28(8): 750-752.]
[5]Kushikata T, Hirota K, Yoshida H, et al. Orexinergic neurons and barbiturate anesthesia[J]. Neuroscience, 2003, 121(4): 855-863.
[6]Shigemoto Y, Fujii Y, Shinomiya K. Participation of histaminergic H1 and noradrenergic alpha 1 receptors in orexin A-induced wakefulness in rats[J]. Brain Res, 2004, 1023(1): 121-125.
[7]El Yacoubi M, Ledent C, Parmentier M, et al. Caffeine reduces hypnotic effects of alcohol through adenosine A2A receptor blockade[J]. Neuropharmacology, 2003, 45(7): 977-985.
[8]Stephens JR, Levy RH. Effects of valproate and citrulline on ammonium-induced encephalopathy[J]. Epilepsia, 1994, 35(1):164-171.
[9]Jones BE. Arousal systems[J]. Front Biosci, 2003, 8(5): 438-451.
[10]Aran A, Shors I, Lin L, et al. CSF levels of hypocretin-1(Orexin-A) peak during early infancy in humans[J]. Sleep, 2012,35(2): 187-191.
[11]Miller DB, Callaghan JP. The pharmacology of wakefulness[J].Metabolism, 2006, 55(12): 13-19.
[12]Chen JW, Gao ZH, Xiao LN, et al. Effects of amino acids and vitamins on the ultrastructure of the hypothalamus and neurotransmitter in exhausted rats[J]. Med J Chin PLA, 2012,37(1): 20-22. [陈剑伟, 高朝辉, 肖立宁, 等. 氨基酸维生素制剂对力竭疲劳大鼠下丘脑超微结构及神经递质的影响[J].解放军医学杂志, 2012, 37(1): 20-22.]
[13]Bourgin P, Huitrón-Résendiz S, Spier AD, et al. Hypocretin-1 modulates rapid eye movement sleep through activation of locus coeruleus neurons[J]. J Neurosci, 2000, 20(20): 7760-7765.
[14]Kushikata T, Hirota K, Yoshida H, et al. Orexinergic neurons and barbiturate anesthesia[J]. Neuroscience, 2003, 121(4): 855-863.
[15]Vyazovskiy VV, Kopp C, Bosch G. The GABAA receptor agonist THIP alters the EEG in waking and sleep of mice[J].Neuropharmacology, 2005, 48(5): 617-626.

