石杉碱甲对急性低压低氧模型大鼠海马神经元凋亡的影响
史清海,韩茹,伏建峰,魏静,葛迪,冉继华,刘正祥
人员急进高原导致的急性缺氧性脑损伤表现 为感知能力、学习与记忆能力等大脑认知能力下降,以及对动作的协调性、准确性的影响[1-2]。研究表明,急性低压、低氧可导致大鼠大脑海马神经元细胞凋亡,并最终导致大鼠学习与记忆等认知能力下降[3-4]。细胞凋亡是由特定基因调控的,Bcl-2家族在细胞凋亡过程中发挥着重要作用,其中Bcl-2和Bax被认为是抑制和促进细胞凋亡最重要的调控基因。石杉碱甲(huperzine A)能增强中枢胆碱能神经功能,临床用于改善老年痴呆患者的健忘症状,除此之外还能提高神经元抗氧化、抗兴奋性氨基酸毒性等作用[5]。尽管石杉碱甲在病理条件下能够发挥多种作用,但其在急性低压、低氧环境下对大脑海马神经元细胞凋亡的影响仍不明确。本研究通过观察石杉碱甲对急性低压、低氧模型大鼠海马神经元细胞凋亡及凋亡相关蛋白Bcl-2和Bax表达的影响,探讨石杉碱甲对急性低压、低氧模型大鼠的神经保护作用。
1 材料与方法
1.1 主要试剂及仪器 FLYDWC-IA型低压氧动物实验舱(中航工业公司),Morris水迷宫MT-200(成都泰盟),Nikon80i荧光显微镜(日本尼康),双垂直电泳仪DG-24DN、半干电转膜仪DYCZ-40C(北京六一仪器厂),荧光细胞凋亡检测试剂盒(Promega DeadEnd™ Fluorometric TUNEL System)、Bax兔多抗IgG(SC-526)、Bcl-2兔多抗IgG(SC-783)、GAPDH(FL-335)兔多抗IgG(SC-25778)及Goat antirabbit IgG-HRP(SC-2004)均为美国Santa Cruz公司产品,ECL化学发光试剂盒(美国Pierce SuperSignal®)。
1.2 实验动物分组及给药 健康雄性SD大鼠48只(购于新疆医科大学实验动物中心),体重240~280g,随机均分为4组:平原组(对照组)、平原给药组、高海拔组(模拟6000m海拔)、高海拔给药组。石杉碱甲片剂(批号100401,规格50μg/片)由河南竹林众生制药股份有限公司提供。将药片研磨粉碎,加入适量双蒸水配制成混悬液(10mg/ml)备用。平原给药组和高海拔给药组大鼠在正式模拟低压、低氧实验前1d,按照0.1mg/kg体重剂量灌胃给药,直到模拟急性低压、低氧饲养结束为止。
1.3 模拟急性低压、低氧饲养条件 将模拟低压、低氧组大鼠置于高原环境模拟舱内,以40m/s的速度分别升至6000m,气压稳定在354±2mmHg,24h自然昼夜交替,并不间断地以5.5L/min的速度注入新鲜空气以提供饲养动物所需氧气,同时排出二氧化碳,舱内温度维持在24±2℃,湿度30%~40%,大鼠自由进食水。高海拔组和高海拔给药组连续低压、低氧饲养7d,期间每天减压给药1次,随后立即放回模拟舱。模拟急性低压、低氧饲养结束后,4组大鼠分为两部分分别进行Morris水迷宫实验和海马组织病理及凋亡因子检测。
1.4 Morris水迷宫实验 模拟急性低压、低氧饲养7d后,4个实验组每组随机选取6只大鼠(共计24只)进行水迷宫实验,测试方法如下。①定位导航测试:用于检测大鼠对水迷宫学习记忆的获取能力。每天训练4次,分别从4个不同的入水点将大鼠面向池壁放入水中,平台总位于对侧象限,如果大鼠在60s内未找到平台,则逃避潜伏期记为60s,需将其引至平台,大鼠站立于平台10s后,将大鼠从平台上取下来休息60s,按顺序由下一象限入水进行下一次实验。观察并记录5d训练期间大鼠每次寻找平台所需的逃避潜伏期(s)。②空间探索实验:用于检测大鼠学会寻找平台后,对平台空间位置记忆的保持能力。第5天定位导航测试完毕后,撤除平台,选择第3象限池壁中点作为入水点,将大鼠面向池壁放入水中,测试其在60s内跨过目标象限平台,即原平台相应位置的次数(次)和原平台所在象限滞留时间(s)[6]。
1.5 TUNEL法检测海马神经元凋亡情况 模拟急性低压、低氧饲养7d后,4个实验组剩余大鼠(未进行水迷宫实验的大鼠)共计24只,用1%戊巴比妥钠(40mg/kg)腹腔注射麻醉,开胸暴露心脏,4℃生理盐水100ml心脏灌注,继续用4%多聚甲醛PBS液(4℃,pH7.4)300ml灌注内固定,待大鼠四肢及肝脏等发白变硬后迅速断头取出脑组织并完全分离出海马组织。每只大鼠一半海马组织置于4%多聚甲醛/25%蔗糖溶液(4℃)固定过夜,另一半进行脑组织匀浆处理。海马组织石蜡包埋,冠状连续切片(5μm),以TUNEL法原位检测各组大鼠海马CA1区凋亡细胞,操作过程严格按照TUNEL检测试剂盒说明书进行,荧光显微镜观察,TUNEL染色阳性细胞可见细胞呈亮绿色荧光。每只大鼠取5张切片,在400×显微镜下重点观察海马CA1区,采用显微图像分析系统采集图像,每张切片随机计数5个视野,记录单位视野中的阳性细胞数,取其平均值进行统计分析。
1.6 海马组织中Bcl-2、Bax蛋白的表达 海马组织称重后剪切成细小碎片,置于1ml匀浆器球状部位,按照每20mg组织加入200μl裂解液的比例加入裂解液[50mmol/L Tris(pH7.5)、150mmol/L NaCl、1mmol/L PMSF、1μg/ml Aprotinin、1μg/ml Leupeptin、1%NP-40、0.5%脱氧胆酸钠],冰上上下移动匀浆棒至匀浆液均一,置冰上裂解30min,用移液器移至1.5ml离心管中,4℃、12 000r/min离心10min,取上清分装于0.5ml离心管中并置于-20℃保存备用。BCA法检测上清中蛋白质浓度。100℃变性10min,上样量20μg,12% SDS-PAGE分离后转膜;5%脱脂奶粉常温封闭2h,TBST洗涤3次,分别与1:1000稀释的Bax、Bcl-2及GAPDH抗体反应;室温培育1h,洗涤3次,再加入1:5000稀释的二抗,室温培育1h,洗涤3次;ECL化学发光显色,X线胶片曝光,显影,定影,Gel-Pro Analyzer 4.0软件进行灰度分析。以兔抗鼠GAPDH作为内参。
1.7 统计学处理 采用SPSS 16.0软件进行统计学分析,数据以表示,多组间比较采用单因素方差分析,两两比较采用q检验(SNK),P<0.05为差异有统计学意义。
2 结 果
2.1 Morris水迷宫实验 在定位导航实验中,各组大鼠逃避潜伏期随训练时间推移逐渐缩短,但在每一时间点,高海拔组大鼠的逃避潜伏期均较平原组延长,差异有统计学意义(P<0.05),即需要花费更长时间才能找到平台。而与高海拔组相比,每一时间点高海拔给药组大鼠的逃避潜伏期均缩短(P<0.05),与平原组比较差异无统计学意义(P>0.05,图1)。在空间探索实验中,与平原组相比,高海拔组大鼠60s内穿越平台次数和目标象限滞留时间明显减少(P<0.05)。与高海拔组相比,高海拔给药组60s内穿越平台次数明显增多(P<0.05),目标象限滞留时间明显延长(P<0.05),与平原组比较差异无统计学意义(P>0.05,图2、3)。
2.2 海马组织细胞凋亡计数 与平原组相比,高海拔及高海拔给药组大鼠海马CA1区神经元细胞凋亡数量均明显增加(P<0.05)。而与高海拔组相比,高海拔给药组大鼠海马CA1区神经元细胞凋亡数量明显减少(P<0.05)。平原给药组与平原组比较差异无统计学意义(P>0.05,图4)。
2.3 海马组织细胞凋亡因子及抗凋亡因子表达 与平原组相比,高海拔组大鼠海马组织中促凋亡因子Bax的表达明显增加(P<0.05),抗凋亡因子Bcl-2表达明显降低(P<0.05)。与高海拔组相比,高海拔给药组大鼠海马组织中Bax表达降低(P<0.05),Bcl-2表达增高(P<0.05)。平原给药组与平原组比较差异无统计学意义(P>0.05,图5)。

图1 各组大鼠找到平台所用时间(逃避潜伏期)变化Fig.1 Changes of time reaching the target platform (escape latency) in experimental rats

图2 各组大鼠60s内穿越平台次数Fig.2 Times of crossing the former platform of rats within 60s

图3 各组大鼠目标象限滞留时间Fig.3 Time spent in the target quadrant of rats
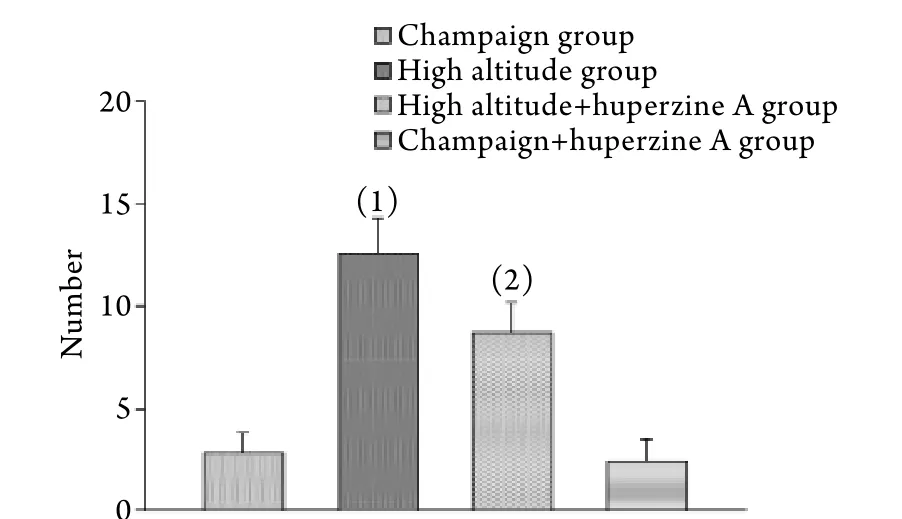
图4 大鼠海马CA1区凋亡细胞计数Fig.4 Number of apoptotic cells in CA1 region of rat's hippocampus
3 讨 论
高原环境具有低气压、低氧、高寒等特征,会对人体生理状况产生严重影响[7-9],行为学测试已证实,急进高原人群智力、学习、记忆尤其是瞬时记忆和短时记忆等认知功能均受到明显损害[10-11],但是这种大脑认知功能损害的机制目前尚不清楚。石杉碱甲是从中药千层塔中提取的一种生物碱,临床用于改善老年痴呆患者的健忘症状[5-7,10,12],此外它在提高神经细胞抗氧化活性、抗细胞凋亡及兴奋性氨基酸毒性等作用方面也有报道[13]。但石杉碱甲在急性低压、低氧环境下对大脑海马神经元细胞凋亡的影响仍不明确。

图5 Western blotting检测大鼠海马组织中Bax、Bcl-2蛋白的表达Fig.5 Expression of Bax and Bcl-2 in rat's hippocampus tissue
本研究模拟急性低压、低氧应激诱导大鼠急性高原损伤,Morris水迷宫测试结果显示,经石杉碱甲给药后,大鼠逃避潜伏期明显缩短,60s内穿越平台次数明显增多,目标象限滞留时间明显延长,表明石杉碱甲能够改善模型大鼠的空间学习与记忆能力;TUNEL法原位检测及Western blotting结果显示,经石杉碱甲给药后,大鼠海马CA1区神经元细胞凋亡数量明显减少,海马组织中促凋亡因子Bax表达明显降低,抗凋亡因子Bcl-2表达明显升高,表明石杉碱甲能够提高模型大鼠海马神经元细胞对抗细胞凋亡,降低细胞凋亡水平。以上实验结果表明,石杉碱甲对急性低压、低氧导致的大鼠大脑海马神经元细胞凋亡具有缓解作用,同时还可改善模型大鼠的空间学习与记忆能力。
高原环境对人脑的认知损伤现象是客观存在的,必须研究有效、可靠的认知增强药物,以缓解恶劣环境对大脑认知功能的损伤。本研究评价的药物石杉碱甲在动物模型中获得了良好效果,具有良好的应用价值,值得进一步深入研究。
[1]Virues-Ortega J, Garrido E, Javierre C, et al. Human behaviour and development under high-altitude conditions[J]. Dev Sci,2006, 9(4): 400-410.
[2]Zhou QQ, Yang SY, Yuan ZC, et al. A research in diagnostic criteria of high altitude de-adaptation for plateau migrants returning to the plains: a multicenter, randomized controlled trial[J]. Med J Chin PLA, 2012, 37(2): 146-155. [周其全, 杨生岳, 袁振才, 等. 高原移居人群返回平原后高原脱适应症的诊断标准:多中心、随机对照研究[J]. 解放军医学杂志,2012, 37(2): 146-155. ]
[3]Maiti P, Singh SB, Mallick B, et al. High altitude memory impairment is due to neuronal apoptosis in hippocampus, cortex and striatum[J]. J Chem Neuroanat, 2008, 36(3-4): 227-238.
[4]Yang QY, Li Q, Wang XY, et al. Survey of sleep quality and cognition function of serviceman with high altitude polycythemia[J]. Zhengzhou Univ (Med Sci), 2011, 46(3): 476-477. [杨全玉, 李强, 王向阳, 等. 高原性红细胞增多症官兵睡眠质量和认知功能调查[J]. 郑州大学学报(医学版), 2011,46(3): 476-477.]
[5]Ha GT, Wong RK, Zhang Y. Huperzine A as potential treatment of Alzheimer's disease: an assessment on chemistry,pharmacology, and clinical studies[J]. Chem Biodivers, 2011,8(7): 1189-1204.
[6]Shi QH, Fu JF, Ge D, et al. Acute hypobaric hypoxia stress induces cognitive impairment in rats[J]. Med J Natl Defend Forces Northwest Chin, 2012, 33(1): 4-7. [史清海, 伏建峰, 葛迪, 等. 急性低压低氧应激导致大鼠认知功能损伤的研究[J]. 西北国防医学杂志, 2012, 33(1): 4-7.]
[7]Li SZ, Gao YQ, Liu HD, et al. Mountain sickness[M]. Beijing:People's Medical Press, 2006. 32. [李素芝, 高钰琪, 刘厚东, 等.高原疾病学[M]. 北京:人民卫生出版社, 2006. 32. ]
[8]Yang DZ, Zhou QQ, Li SZ, et al. Intestinal mucosal barrier dysfunction injury induced by altitude hypoxia in rats and the protective effect of glutamine[J]. Med J Chin PLA, 2011, 36(3):301-306. [杨定周, 周其全, 李素芝, 等. 高原缺氧致大鼠肠黏膜屏障功能损伤及谷氨酰胺的保护作用观察[J]. 解放军医学杂志, 2011, 36(3): 301-306. ]
[9]Wu TY. Chronic mountain sickness on the Qinghai-Tibet plateau[J]. Chin J Pract Intern Med, 2012, 32(5): 321-323. [吴天一. 我国青藏高原慢性高原病研究的最新进展[J]. 中国实用内科杂志, 2012, 32(5): 321-323.]
[10]Han GL. The study on the effects of high altitude hypoxia on human cognitive function[J]. J High Alt Med, 2009, 19(4): 62-64. [韩国玲. 高原低氧对人体认知功能影响的研究[J]. 高原医学杂志, 2009, 19(4):62-64. ]
[11]Wei ZH, Zi YH, Dong ZW, et al. Analysis on the deadaptation symptoms of plain region migrants back from different high altitude regions[J]. Med J Chin PLA, 2012, 37(12): 1151-1154.[魏征华, 资云海, 董志伟, 等. 高原移居者返回平原的高原脱适应症发生率比较[J]. 解放军医学杂志, 2012, 37(12):1151-1154.
[12]Wang BS, Wang H, Wei ZH, et al. Efficacy and safety of natural acetylcholinesterase inhibitor huperzine A in the treatment of Alzheimer's disease: an updated meta-analysis[J]. J Neural Transm, 2009, 116(4):457-465.
[13]Zheng CY, Zhang HY, Tang XC. Huperzine A attenuates mitochondrial dysfunction after middle cerebral artery occlusion in rats[J]. J Neurosci Res, 2008, 86(11):2432-2440.

