肝硬化门脉高压患者经颈静脉肝内门腔分流术后肝功能随访及疗效评估
童玉云,王家平,朱清亮,李迎春,闫 东,杨 青,姜 华
肝硬化门脉高压导致食管胃底曲张静脉破裂出血是上消化道出血的主要原因,常因出血量大而危及生命。对于食管胃底曲张静脉破裂出血,目前内科药物治疗、三腔两囊管压迫治疗、内镜下曲张静脉套扎或硬化曲张静脉等治疗大多效果不佳,易再次出血;外科断流术或各种分流术对患者损伤大且病死率较高。经皮穿刺门静脉途径栓塞食管胃底曲张静脉,同样也有良好的治疗效果[1],但不能消除门脉高压的原动力——门脉高压症,出血复发率高。经颈静脉肝内门腔分流术(transjugular intrahepatic portosystemic shunt,TIPS)比经内镜下食管曲张静脉套扎(endoscopic variceal ligation,EVL)能更有效的阻止食管胃底曲张静脉破裂出血[2]。自Rosch等在1969年首先进行了TIPS实验研究以来,TIPS已逐步应用于临床并成为微创治疗门脉高压及其并发症的重要手段之一。TIPS是通过介入方法在肝实质内建立门脉与下腔静脉分流通道,将以往门腔肝外分流改为肝内门腔分流,这样既有效降低门静脉压力,消除门脉血液淤滞状态,预防门脉血栓及胃黏膜淤血发生,又由于分流道<12 mm属于一种“限制性分流”而降低肝性脑病的发生;若在此基础上栓塞曲张静脉,则可起到分流加断流的双重作用,治疗效果优于外科分流和EVL[3-5]。TIPS作为治疗晚期肝硬化门脉高压症的一种新手段,近年来通过技术改进、材料更新和多种方法联合应用,使其在治疗门脉高压,尤其是急性大出血中起到越来越重要的作用。
1 材料和方法
1.1 临床资料
收集2008年10月至2012年2月因肝硬化失代偿期门静脉高压伴食管胃底静脉曲张破裂出血或(和)难治性腹水、脾功能亢进住院患者82例,进行TIPS及曲张静脉栓塞和(或)脾动脉栓塞术。患者一般临床资料见表1,其中13例为急诊行TIPS。有4例在TIPS前5~8个月曾行断流加脾切除术,12例曾作EVL治疗1~2次,2例注射鱼肝油酸钠硬化治疗。患者术前内镜检查发现食管、胃底静脉呈中、重度曲张,52例具RC红色症,其中16例重度曲张。MRI或(和)256排CT检查均诊断为肝硬化门脉高压症伴食管胃底静脉曲张、脾肿大。
1.2 手术方法
按Seldinger法穿刺右颈内静脉成功后,用10 F导管扩张器扩张颈静脉穿刺口,在导丝引导下送入RUPS-100套管至下腔静脉,透视下调整长鞘,将导丝和5 F导管送入肝静脉,行肝静脉造影(图1a),证实为可行分流的肝静脉后,在导丝引导下将金属导向套管,厚壁5 F穿刺直头导管一同送入该静脉,确定穿刺位置后送入穿刺针,从肝静脉经肝实质向门脉主要分支方向穿刺,穿刺深度一般为3~4 cm(具体深度根据肝硬化程度和肝脏大小估计)。穿刺后拔出穿刺针,用注射器负压吸引下缓慢退穿刺导管,有回血时注入非离子型对比剂,以了解其是否为可行分流的门静脉。若可行,则送入超滑导丝于肠系膜上静脉或脾静脉内,并送穿刺导管于门静脉分支内,换入加硬交换导丝,沿加硬导丝将RUPS-100长鞘一同送入门脉主干并留鞘于门脉内,经超硬导丝送5 F直头多侧孔导管于脾静脉主干内,用测量管进行门脉测压后,注入非离子型对比剂,按流率8 ml/s、总量24 ml、压力300 PSI行门静脉造影,了解门脉主干及分支血流情况和曲张静脉情况(图1b)。若曲张静脉明显,则经交换导丝送超滑4 F Cobra导管至曲张静脉(如胃冠状、胃短静脉)内,用弹簧圈栓塞曲张静脉,换入加硬导丝并沿导丝送直径6~8 mm球囊扩张肝静脉与门静脉之间的肝实质分流道,球囊直径一般小于置入支架直径1~2 mm。根据造影图像、体表解剖和球囊扩张时门静脉和肝静脉的压迹做好支架拟放置位置的标记(图1c、1d),在导丝引导下置入支架释放系统,准确定位后释放支架 (图1e)。之后再行门脉造影及测压(图1f),观察肝内门脉分支和侧支情况、支架位置及分流情况,若门脉压下降不满意或支架有狭窄,可再用球囊扩张。然后再测量门脉主干、支架内、右心房内压力。术毕拔出10 F鞘等,加压包扎穿刺点。术后使用广谱抗生素2~3 d,肝素抗凝治疗7~10 d,后口服抗凝药物6~12个月(凝血功能差的患者酌情减量)并定期检测出凝血时间。
1.3观察指标
观察患者术前、术后基本血生化(红细胞、血小板)、肝功能(天冬氨酸转氨酶、丙氨酸转氨酶、白蛋白、总胆红素、总胆汁酸、胆碱酯酶)、肾功能(肌酐、尿素氮)和凝血(凝血酶原时间、国际标准化比值)指标。
1.4 临床随访
术后 2 ~ 4 周、3、6、12、18、24 个月进行超声、CT、MRI、直接门脉造影和临床随访,并复查肝功能、血常规和凝血指标。
1.5 统计学分析
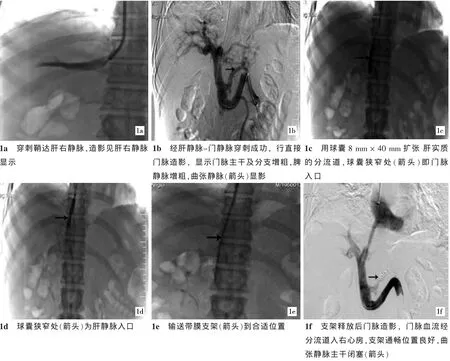
图1 肝硬化并门脉高压、食管胃底静脉曲张破裂出血治疗过程
2 结果
2.1 TIPS治疗结果
本组82例患者全部成功置入支架建立分流道,技术成功率为100%。因呕血为主进行治疗的患者,症状得到及时控制;有2例术后2 d因剧烈呕吐引起贲门撕裂出现呕血。8例术前难治性腹水患者中,1例术后1周腹水吸收,6例术后7~14 d得到不同程度的缓解,1例消退不明显。34例呕血且合并少~中量腹水患者,术后14 d内,5例腹水消失,16例腹水得到不同程度吸收,13例腹水消退不明显。2例术后7~14 d出现肝性脑病。
2.2 随访结果
从表1可见,与术前相比,术后6、12个月的红细胞计数差异有统计学意义(P<0.05),其他时间段差异均无统计学意义(P>0.05);术后 2周、3、12个月的总胆红素差异有统计学意义 (P<0.05),其他时间段差异均无统计学意义 (P>0.05);术后2周、3、6、12个月的总胆汁酸差异有统计学意义(P<0.05),其他时间段差异均无统计学意义(P>0.05);术后2周的胆碱酯酶差异有统计学意义(P<0.05),其他时间段差异均无统计学意义(P>0.05);术后3、6、12个月的凝血酶原时间差异有统计学意义(P<0.05),其他时间段差异均无统计学意义(P>0.05)。2.3 术后患者死亡情况
本组病例中,死亡16例,年龄43~77岁,男13例,占 81%,女 3例,占 19%;术前 Child-Puch A级1例,占6%,因肺部感染致呼吸衰竭死亡;B级6例,占37.5%,1例因肝功能衰竭死亡,1例因酒后车祸死亡,4例因肝性脑病死亡;C级9例,占56.5%,1例因肺部感染死亡,1例因多器官功能衰竭死亡,3例因肝功能衰竭死亡,4例因肝性脑病死亡。
3 讨论
3.1 TIPS术后对肝功能的影响
肝脏血供2/3来自门静脉,1/3来自肝动脉。有诸多学者认为,TIPS术中分流道的建立,降低了门脉血流向肝脏的灌注,长期会影响肝功能。目前,对于TIPS术后肝功能变化观察的文献报道较少。Hauenstein 等[6]、Harrod-Kim 等[7]和 Angermayr 等[8]认为,由于门脉分流使门脉灌注肝脏血流减少,肝细胞营养来源减少;门脉分流导致肝内门脉血流逆流,部分肝动脉血无效分流,也会导致肝脏灌注减少,使肝细胞代谢功能减低及肝细胞缺氧坏死。而部分学者认为TIPS对肝脏有损害,可能导致肝功能衰竭,在严重肝肾功能不全时应属禁忌证[9-11]。本研究通过为期1年的肝功能主要指标的回顾性分析观察TIPS对肝功能的影响。研究发现,术后1周肝功能多数指标发生变化,肝功能受损。术后2~4周、3、6、12个月的肝功能指标变化无统计学意义。此外,血清白蛋白术后均上升,可能的原因为:门静脉高压解除后,肠道淤血减轻,吸收功能增加,同时患者的食欲也增加,所以白蛋白能显著增加。造成上述结果的原因我们分析有以下几点:① 术后1周肝功能下降的原因为术中穿刺对肝脏的机械损害及肝脏门静脉压力下降肝脏血供减少,肝细胞缺血缺氧造成肝功能近期损害;由于分流道的建立,术后肝血流动力学变化大,由术前门脉、肝动脉双重供血变为门脉供血减少、肝动脉供血尚未形成足够代偿的情况下,短期内肝功能受影响大。提示术后短期内肝功能损害主要可能是因为术中穿刺机械损害及肝脏血流灌注减少而引起。②由于机体自身调节肝内血管扩张,侧支循环开放以及动静脉短路开放逐渐增加肝细胞供血供氧能力。薛挥等[11]报道TIPS术后NO显著升高。NO具有扩张血管、减轻肝损伤、对抗氧自由基的作用。③TIPS术能有效降低门静脉压力,减轻门静脉系统淤血,恢复肝脏的Starling平衡,肝淋巴生成减少,随着门静脉血流经肝内分流道直接进入肝静脉及下腔静脉,心输出量增加及外周阻力下降,体循环血流重新分布,机体有效循环量和肝血流量也可显著提高,使肝功能部分恢复。④由于TIPS术降低了门脉压力,逐渐恢复了激素的动态平衡,使肝功能进一步改善。⑤正常情况下,门脉与肝动脉之间的血供存在此消彼长的关系。通过所谓“肝动脉缓冲效应”[12]保持肝供血量的相对恒定。术后门腔大量分流,肝由门脉、肝动脉双重供血转为主要由肝动脉供血,从而使肝脏血流灌注保持术前、后的恒定。邓旦等[13]报道TIPS术后肝动脉阻力指数较术前降低。⑥TIPS术后由于分流虽可致肝门静脉血供减少,但本组我们均行侧支血管栓塞,栓后门脉压力能上升2~3 mmHg,这样就能增强肝门静脉血灌注量和压力,抵偿分流道所致的缺血。总之,TIPS术后能降低门脉压力控制出血,对肝功能近期有损伤,但肝功能在术后2~4周后可恢复到术前水平。因此,我们认为TIPS对中、远期肝功能不会造成明显的损伤。
表1 79例患者术前、术后各时间段的肝功能、凝血指标 ±s)
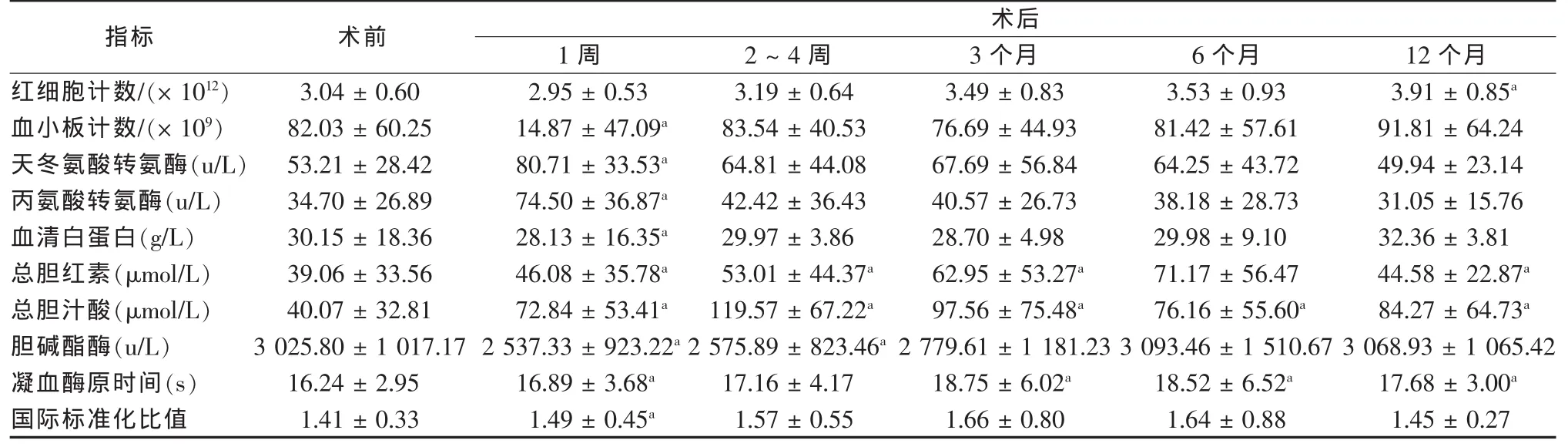
表1 79例患者术前、术后各时间段的肝功能、凝血指标 ±s)
注:a与术前相比P<0.05
指标 术前术后1周 2~4周 3个月 6个月 12个月红细胞计数/(×1012) 3.04±0.60 2.95±0.53 3.19±0.64 3.49±0.83 3.53±0.93 3.91±0.85a血小板计数/(×109) 82.03±60.25 14.87±47.09a 83.54±40.53 76.69±44.93 81.42±57.61 91.81±64.24天冬氨酸转氨酶(u/L) 53.21±28.42 80.71±33.53a 64.81±44.08 67.69±56.84 64.25±43.72 49.94±23.14丙氨酸转氨酶(u/L) 34.70±26.89 74.50±36.87a 42.42±36.43 40.57±26.73 38.18±28.73 31.05±15.76血清白蛋白(g/L) 30.15±18.36 28.13±16.35a 29.97±3.86 28.70±4.98 29.98±9.10 32.36±3.81总胆红素(μmol/L) 39.06±33.56 46.08±35.78a 53.01±44.37a 62.95±53.27a 71.17±56.47 44.58±22.87a总胆汁酸(μmol/L) 40.07±32.81 72.84±53.41a 119.57±67.22a 97.56±75.48a 76.16±55.60a 84.27±64.73a胆碱酯酶(u/L) 3 025.80±1 017.17 2 537.33±923.22a2 575.89±823.46a2 779.61±1 181.23 3 093.46±1 510.67 3 068.93±1 065.42凝血酶原时间(s) 16.24±2.95 16.89±3.68a 17.16±4.17 18.75±6.02a 18.52±6.52a 17.68±3.00a国际标准化比值 1.41±0.33 1.49±0.45a 1.57±0.55 1.66±0.80 1.64±0.88 1.45±0.27
3.2 TIPS术对血流动力学的影响
门静脉高压所致的脾功能亢进的机制之一是门脉高压导致脾静脉血流减慢,脾脏淤血,长期淤血造成脾脏增大;血液在脾脏内停留时间过长,导致血小板、白细胞、红细胞过量被破坏。TIPS术后门脉压力明显降低,脾脏淤血状况得到改善,血液中有形成分的破坏也应明显减少。本组研究了术后1、2 ~ 4 周、3、6、12个月的红细胞、血小板变化,差异都无统计学意义,红细胞基本趋势为增多、血小板基本趋势为减少。提示TIPS术后一定程度上降低了门脉压力,但对脾功能亢进并无明显改善,但也无加重。Jabbour等[14]的研究也提示TIPS对于肝硬化门静脉高压性脾功能亢进无明显改善作用。我们分析估计有以下原因:①TIPS术后门脉压力减低,门脉系统淤血减轻、腹水吸收,导致循环系统血液增多,从而抵消了术后门脉压力减低带来的效果。②虽然术后门脉压力较术前门脉高压适度减低,但并没有减到能改善脾功能亢进的范围。③脾脏增大后可能纤维化,要使其自然缩小需较长时间。外科脾切除虽然对脾功能亢进有明显疗效,但明显减低患者机体的免疫功能和预防感染的能力,而且容易形成门静脉血栓。部分脾栓塞术纠正脾功能亢进疗效肯定[15]。鉴于以上结果,我们建议对术前脾功能明显亢进的患者适当进行脾栓塞。
综上所述,我们认为:①TIPS术后因医源性机械损伤及门脉分流,短期内可致肝功能受损。但中、远期来看,对肝功能影响较小。②TIPS术对外周血象无明显影响,脾功能亢进所致血象改变无加重趋势。③肝性脑病是TIPS术后死亡的主要原因,肝功能越差,死亡率越高。
[1]王 青,兰春虎,赵 玲,等.经皮经肝门静脉栓塞食管胃底静脉治疗门脉高压性上消化道出血 [J].介入放射学杂志,2006,15: 44-45.
[2]Tripathi D,Lui HF,Helmy A,et al.Randomised cotrolled trial of long term portographic follow up versus variceal band ligation following transjugular intrahepatic portosystemic stent shunt for preventing oesophageal variceal rebleeding [J].Gut,2004,53:431-437.
[3]Rosemurgy AS,Zervos EE,Goode SE,et al.Differential effects on portal and effective hepatic blood flow.A comparison between transjugular intrahepatic portosystemic shunt and small-diameter H-gaft portacaval shunt[J].Ann Surg,1997,225: 601-607.
[4]Stanley AJ,Jalan R,Forrest EH,et al.Longterm follow up of transjugular intrahepatic portosystemic stent shunt (TIPSS) for the treatment of portal hypertension: resultS in 130 patient[J].Gut,1996,39: 479-485.
[5]Rosemurgy AS,Zervos EE,Bloomston M,et al.Post-shunt resource consumption favors small-diameter prosthetic H-graft portacaval shunt over TIPS for patients with poor hepatic reserve[J].Ann Surg,2003,237: 820-825.
[6]Hauenstein KH,Haag K,Ochs A,et al.The reducing stent:treatment for transjugular introhepatic portosystemic shuntinduced refractory hepatic encephalopathy and liver failure [J].Radiology,1995,194:175-194.
[7]Harrod-Kim P,Saad WE,Waldman D.Predictors of early mortality aftertransjugularintrahepatic portosystemic shunt creation for the treatment of refractory ascites [J].J Vasc Interv Radiol,2006,17: 1605-1610.
[8]Angermayr B,Cejna M,Karnel F,et al.Child-Pugh versus MELD score in predictingsurvivalin patientsundergoing transjugular intrahepatic portosystemic shunt [J].Gut,2003,52:879-885.
[9]Colom BL.The role of transjugular intrahepatic portosystemic shunt(TIPS)in the management of portal hypertension[J].J Clin Gastroenterol,2007,41(suppl 3): S344-S351.
[10]原姗姗,韩国宏,樊代明.TIPS治疗门静脉高压并发症预后评价的现状[J].介入放射学杂志,2011,20: 245-248.
[11]薛 挥,焦婕英,吕良山,等.经颈静脉肝内门体分流术治疗肝硬化门脉高压症对机体液递物质的影响及疗效[J].西安交通大学学报:医学版,2008,29:62-65.
[12] Lautt WW.Mechanism and role of intrinsic reguation of hepatic arterialblood flow: hepatic arterial buffer response [J].Am J Physiol,1985,249(5 pt 1): G549-G556.
[13]邓 旦,秦建平,廖明松,等.经颈静脉肝内门体分流术前肝血流动力学状态与术后肝性脑病发生的相关性研究[J].中华超声影像学杂志,2004,13:670-673.
[14] Jabbour N,Zajko A,Orons P,et al.Does transjugular intrahepatic portosystemic shunt(TIPS) resolve thrombocytopenia associated with cirrhosis? [J].Dig Dis Sci,1998,43: 2459-2462.
[15] Pålsson B,Hallén M,Forsberg AM,et al.Partial splenic embolization: long-term outcome [J].Langenbecks Arch Surg,2003,387: 421-426.

