颈动脉支架成形术血流动力学改变的影响因素分析
彭应龙,宋 莉,佟小强,杨 敏,牛国晨,邹英华
随着神经影像学和神经介入技术的日渐成熟,颈动脉支架成形术 (carotid artery angioplasty and stenting,CAS)以其安全、有效、微创及适应证更广泛,已经成为颈动脉狭窄的主要治疗方法[1-4]。但围手术期的血流动力学紊乱问题不容忽视,主要表现为手术过程中患者心率和血压的骤然变化,如果不及时处理可能出现严重后果[5-8]。本文通过回顾性分析接受CAS患者的临床资料,探讨可能引起血流动力学紊乱的相关因素。
1 材料与方法
1.1 一般资料
1.1.1 研究对象 对2003年1月至2012年1月在我科接受CAS患者的临床资料进行回顾性分析。入组标准为:①有脑缺血症状患者颈动脉狭窄>70%;无脑缺血症状患者颈动脉狭窄 >80%。②对治疗过程知情同意,能够承担治疗费用。③能随访,依从性好。排除标准为:①严重的神经系统疾病。②颈动脉完全闭塞。③大动脉炎活动期。④病变动脉异常迂曲,无动脉入路者。⑤不配合随访、依从性差者。
1.1.2 术前检查 所有患者术前进行颈部血管彩色多普勒超声、TCD、头颈CTA或头颈MRA无创性影像学检查。所有患者均行术前主动脉弓及全脑血管造影,包括主动脉弓造影、双侧颈总动脉、颈内动脉、颈外动脉、椎动脉及基底动脉造影。
1.1.3 术前用药 所有患者于术前3 d口服阿司匹林100 mg/d及氯吡格雷75 mg/d进行抗血小板聚集治疗。对患者存在的一般内科合并症仍常规进行药物控制及治疗。对行动脉造影的患者进行对比剂肾病(CIN)风险评估,识别高危患者并进行水化,以保护肾功能。一般术前6~12 h以1~1.5 ml·kg-1·h-1进行补液,总量控制在1 000 ml左右。术前6 h禁饮食。采用局部麻醉。
1.2 方法
1.2.1 术中 全部患者的介入手术在PHLIPS/TOSHIBA/GE4100血管造影机下进行。术前造影确定狭窄部位,借助参照物测定数据并根据NASCET方法计算狭窄率及狭窄长度,根据计算结果选择相应尺度支架。选用8 F导引管或7 F长鞘置入狭窄病变血管近端的颈总动脉,路图引导下选用远端脑保护装置通过狭窄段,重度狭窄病变选用预扩张后,植入支架并造影确定植入支架成功后,小心回收远端保护装置。若放置支架后仍残留狭窄>30%,回收远端保护装置前用球囊进行支架内做后扩张。然后再次造影观察支架位置及血流状态。术中全程行心电监护,密切注意血压心率变化,阿托品备用。
1.2.2 术后 对于术中无合并症的患者,一般即刻拔除鞘管;对有术中栓子脱落需即刻溶栓或合并有并发症的患者,留置鞘管24 h后拔除。所有患者术后均行心电监护,控制术后血压在90~130/60~80 mmHg为佳,心率60~100次/min。术后患者给予低分子肝素(速碧林 0.4 ml/12 h)抗凝。术后常规口服氯吡格雷(75 mg/d)联合阿司匹林(100 mg/d),3个月后改为阿司匹林(100 mg/d)长期服用。
1.2.3 介入材料 保护伞主要选用美国Cordis公司生产的Angioguard保护伞、美国EV3公司生产的Spider保护伞、美国Embolic Protection公司生产的Fiterwire保护伞,直径为4、5和6 mm等,可根据颈内动脉狭窄远端正常段血管的直径进行选择。扩张球囊一般采用美国Cordis公司生产的Powerflex xp系列球囊,球囊直径4~8 mm,长度分别为20、30和40 mm,可根据狭窄血管的长度及颈动脉近端正常段血管的直径选择扩张球囊的直径和长度。支架主要选用美国Cordis公司生产的Precise系列支架、美国Boston Scientific公司生产的Wallstent系列支架、美国 EV3公司生产的 Protégé系列支架,直径 7~9 mm,长度30~40 mm,根据颈总动脉末端正常段直径选择支架的直径,根据颈内动脉狭窄段远端正常部位至颈总动脉远端正常部位之间的距离选择支架长度。
1.2.4 观察指标、评判标准 患者术中均行心电监护,观察记录术前和术中的心率、血压的变化及变化方向及幅度。一般认为,心率低于60次/min为窦性心动过缓,低于50次/min为明显过缓,并应给予阿托品治疗,高于100次/min为窦性心动过速;术中或术后收缩压低于100 mmHg为血压降低,或(和)血压高于或低于基础收缩压30 mmHg作为高血压和低血压的诊断标准。收缩压低于90 mmHg或高于180 mmHg,无论有无合并低灌注或高灌注症状,考虑明显低血压和高血压,需给予药物干预。
1.3 统计学分析
所有患者术前及术中血压及心率变化进行配对检验;对患者可能存在的高危因素进行统计分析,包括动脉粥样硬化家族史、高脂血症、高血压病史、糖尿病病史、冠心病病史、冠状动脉支架置入史、是否有吸烟、饮酒等嗜好,以及病变狭窄率、对侧颈动脉狭窄、球囊直径、球囊长度、支架直径、支架长度、支架类型、支架生产厂家、残余狭窄率等因素,采用Logistic回归分析方法对其变化的危险因素进行统计学分析。数据分析采用SPSS13.0软件进行分析。P<0.05为差异有统计学意义。
2 结果
患者一般情况与高危因素见表1。
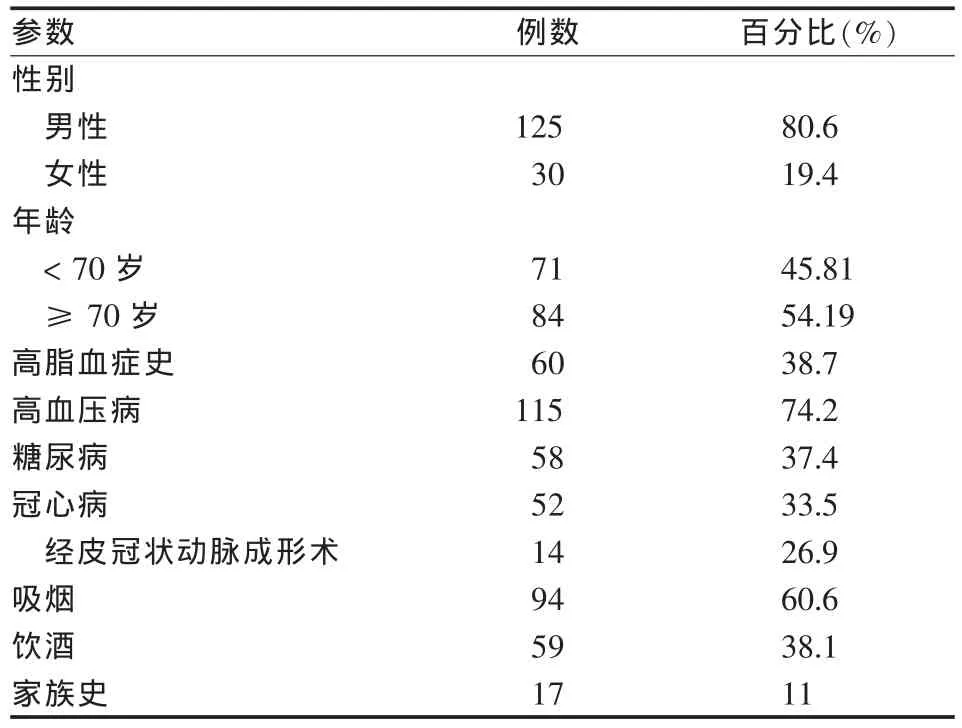
表1 患者一般情况和高危因素
2.1 术中情况
所有患者经动脉造影显示,颈动脉狭窄率均大于70%以上,其中狭窄率70%~80%者38例(24.5%),80% ~ 90%者 43例(27.7%),90% ~ 100%者74例(47.7%);对侧颈动脉狭窄患者68例,对侧颈动脉闭塞患者15例。
2.2 术中血压及心率变化
所有患者术中收缩压从术前平均 (142.62±18.51)mmHg(95.00 ~ 177.00 mmHg)下降为(132.38 ±37.31)mmHg(69.00 ~ 258.00 mmHg),差异有统计学意义 (P=0.002);术中心率从平均 (71.75±10.37)次/min(50~102次/min)下降为61.802±19.298次/min(0~150次/min),差异亦有统计学意义(P<0.000 1)。
术中患者心率下降至 <60次/min 54例(34.8%),其中50次/min以下40例,给予阿托品静脉推注后好转,阿托品的使用剂量为0.5~5.0 mg。另有3例患者心率 ≥100次,并伴有心慌、胸闷等临床症状,给予美托洛尔等对症治疗后好转;收缩压降低30 mmHg或低于100 mmHg者47例(30.3%),其中收缩压低于90 mmHg 23例,并出现低灌注症状,给予多巴胺静脉推注或静脉滴注后好转。收缩压升高30 mmHg以上或收缩压高于180 mmHg 27例 (17.4%),其中收缩压高于180 mmHg 23例,或(和)出现高灌注症状,给予尼卡地平、卡托普利等静脉推注或(和)静脉滴注后好转。
2.3 Logistic回归分析
术中心率下降与术中血压下降 (P=0.000 1,OR=6.163,95%CI=2.901 ~ 13.092)、 支架直径(P=0.015,OR=0.389,95%CI=0.182 ~ 0.830)密切相关。
术中收缩压下降与术中心率下降(P=0.000 1,OR=6.613,95%CI=2.901 ~ 13.092)、糖尿病病史(P=0.016,OR=0.384,95%CI=0.176 ~ 0.834)密切相关。
术中收缩压升高与对侧颈动脉狭窄(P=0.022,OR=1.450,95%CI=1.056 ~ 1.990)密切相关。
3 讨论
3.1 血流动力学紊乱的定义
CAS后血流动力学紊乱包括高血压、低血压、心动过缓和高灌注综合征。一般认为术中或术后任何时间出现的收缩压小于100 mmHg或心率小于60次/min,且在除外出血、低血容量和心脏衰竭因素后即可诊断为低血压或心动过缓[9]。也有将血压高于或低于基础收缩压30 mmHg作为高血压和低血压的诊断标准。高灌注综合征是在以前低灌注区由于脑血流量的突然增加超过了其代谢需要而引起的一系列症状和体征,其典型表现为严重的偏侧头痛、惊厥及颅内出血[10]。
3.2 CAS围手术期血流动力学紊乱的发生机制
CAS后血流动力学紊乱与颈动脉窦压力感受器的机械性刺激有关。球囊扩张、支架植入等机械性扩张和牵拉颈动脉窦引起内膜和动脉粥样硬化斑块表面撕裂,调整了颈动脉壁顺应性,改变了颈动脉受体的敏感性,可能导致患者心率减慢和血压下降。如果压力感受器功能暂时失调可导致术后急性高血压,另外血管紧张素和抗利尿激素等代谢因素在高血压的产生上也起了一定的作用。
高灌注综合征的机制可能是颈动脉狭窄导致脑血管长期处于低灌注状态,为了维持正常的脑血流,小动脉扩张、慢性血管扩张可导致血管自动调节功能障碍,因此无法适应颈动脉狭窄扩张后的瞬时高血流量,从而出现高灌注综合征,甚至出现脑出血、蛛网膜下腔出血等严重事件[11]。
3.3 预测CAS围手术期血流动力学紊乱的因素
在行CAS前,应对可能出现血流动力学不稳定的因素进行预测和评估。国内外学者研究认为许多临床因素可以预测CAS术后血流动力学的发生。
Qureshi等[12]使用回归分析模型发现,年龄、既往有心肌梗死病史和术中低血压是预测术后低血压的独立危险因素;预测术后高血压的因素有性别(女性大于男性)、高血压病史、术中高血压以及既往有颈动脉内膜剥脱术(CEA)手术史;术后心动过缓的重要预测因素有跛行、术中低血压和术中心动过缓;其他的危险因素尚有对侧颈动脉狭窄和颈动脉狭窄长度、使用球囊扩张、支架和球囊型号较大以及手术当天使用降压药物等。Leisch等[13]研究认为与出现颈动脉窦反应相关的危险因素是颈动脉分叉部狭窄、狭窄长度、球囊/动脉比及合并对侧颈动脉狭窄。Mlekusch等[14]认为高龄和既往有冠心病史与血流动力学紊乱相关。Nonaka等[15]建立了预测CAS后低血压的评分标准,认为狭窄病变与颈动脉分叉部位距离≤10 mm、偏心性狭窄及伴有钙化斑是术后低血压的危险因素。王利军等[16]认为,CAS术后发生血流动力学紊乱与患者高龄、狭窄位置及分叉部钙化相关。
本组患者血流动力学紊乱与患者年龄、动脉粥样硬化家族史、基础疾病如糖尿病史、颈动脉狭窄率、对侧颈动脉狭窄、术中器材的选择如球囊的直径、球囊的长度、支架的直径、支架的长度及术中的心率、血压变化等因素密切相关,与文献报道基本相符。
3.4 CAS围手术期血流动力学紊乱的预防
在CAS中,术者应对狭窄血管及邻近正常血管影像进行精确的测量,从而能够选择适合尺寸的滤过保护装置、扩张球囊及支架等介入材料,避免由于球囊及支架型号选择不当而引起的并发症[17]。
根据患者心率情况,一般心率在50次/min以下,或者有其他心脏疾患的患者,采用预先安装临时起搏器的方法将心率维持在60次/min以上的水平;对于心率60次/min左右的患者,在进行球囊预扩张前静脉注射阿托品0.5 mg,在球囊扩张或支架植入过程中,心率仍继续下降者,可再次静脉注射阿托品1~2 mg。对于血压控制不佳的患者,术前积极给予抗高血压药物,使收缩压控制在100~140 mmHg之内。
3.5 CAS围手术期血流动力学紊乱的处理
由于血流动力学紊乱可增加神经和心血管并发症发生率,故早期发现并积极干预是非常必要的。建议在CAS术中和术后持续监测心率和血压,一旦发现异常变化应积极处理。低血压患者可给予血管加压药物如多巴胺静脉滴注,维持收缩压 >100 mmHg;高血压的患者静脉给予抗高血压药物如拉贝洛尔、乌拉地尔等,使血压降至术前水平;心动过缓患者给予阿托品0.5~1.0 mg,由二度及三度房-室传导阻滞引起者可以安装临时起搏器;心动过速者可给予美托洛尔等β受体阻滞剂,使心率维持在正常范围;同时对于高危患者,术后24 h内给予TCD监测,密切观察血流动力学的变化,防止高灌注综合征发生。
综上所述,CAS血流动力学改变主要包括血压及心率的改变,又以血压及心率降低为常见,同时也可发生血压升高。上述改变与术中器材的选择如球囊的直径、球囊的长度、支架的直径、支架的长度密切相关,其次与病变合并症如对侧颈动脉狭窄、基础疾病如糖尿病史、患者年龄、动脉粥样硬化家族史、颈动脉狭窄率及术中的心率、血压变化等因素密切相关。因此,行CAS前应充分做好评估,正确选择手术器材,手术过程中密切监测患者生命体征和及时纠正血压和心率的异常变化,有利于降低血流动力学紊乱的发生率。
[1]Cilingiroglu M,Marmagkiolis K,Wholey MH.Carotid artery stenting update[J].Future Cardiol,2013,9: 193-197.
[2]Goldstein LB,Bushnell CD,Adams RJ,et al.Guidelines for the primary prevention ofstroke: a guideline forhealthcare professionals from the American Heart Association/American Stroke Association[J].Stroke,2011,42: 517-584.
[3]刘 鸣,张苏明.中国缺血性卒中脑卒中诊治指南2010[J].中华神经科杂志,2010,43:1-7.
[4]International Carotid Stenting Study investigators,Ederle J,Dobson J,etal.Carotid artery stenting compared with endarterectomy in patients with symptomatic carotid stenosis(International Carotid Stenting Study): an interim analysis of a randomised controlled trial[J].Lancet,2010,375: 985-997.
[5]Mylonas SN,Moulakakis KG,Antonopoulos CN,et al.Carotid artery stenting-induced hemodynamic instability [J].J Endovasc Ther,2013,20: 48-60.
[6]Howell M,Krajcer Z,Dougherty K,et al.Correlation of periprocedural systolic blood pressure changes with neurological events in high-risk carotid stent patients [J].J Endovasc Ther,2002,9:810-816.
[7]Park B,Shapiro D,Dahn M,et al.Carotid artery angioplasty with stenting and postprocedure hypotension [J].Am J Surg,2005,190: 691-695.
[8]Abou-Chebl A,Gupta R,Bajzer CT,et al.Consequences of hemodynamic instability after carotid artery stenting [J].J Am Coll Cardiol,2004,45: 20-21.
[9]Mendelsohn FO,Weissman NJ,Lederman RJ,et al.Acute hemodynamic changes during carotid artery stenting [J].Am J Cardiol,1998,82: 1077-1081.
[10] Penn AA,Schomer DF,Steinberg GK.Imaging studies of cerebral hyperperfusion after carotid endarterectomy.Case report[J].J Neurosurg,1995,83: 133-137.
[11]黄清海,刘建民,许 奕,等.颈动脉支架成形术围手术期并发低血压的防治[J].介入放射学杂志,2004,13:175.
[12] Qureshi AI,Luft AR,Sharma M,et al.Frequency and determinants of postprocedural hemodynamic instability after carotid angioplasty and stenting [J].Stroke,1999,30: 2086-2093.
[13] Leisch F,Kerschner K,Hofmann R,et al.Carotid sinus reactions during carotid artery stenting: predictors,incidence,and influence on clinical outcome[J].Catheter Cardiovasc Interv,2003,58:516-523.
[14] Mlekusch W,Schillinger M,Sabeti S,et al.Hypotension and bradycardia after elective carotid stenting:frequency and risk factors[J].J Endovasc Ther,2003,10: 851-859.
[15] Nonaka T,Oka S,Miyata K,et al.Prediction of prolonged post procedural hypotension after carotid artery stenting[J].Neurosurgery,2005,57:472-477.
[16]王利军,王大明,刘加春,等.老年人颈动脉狭窄支架置入术的血流动力学紊乱研究 [J].中国医学影像技术,2007,23:784-787.
[17] Gomez CR,Orr SC.Angioplasty and stenting for primary treatment of intracranial arterial stenosis[J].Arch Neurol,2001,58:1687-1690.

