氩氦刀联合动脉化疗栓塞治疗16例肾上腺恶性肿瘤
韩宗宏,史东宏,许 健,孔伟东,曹建民
已证实氩氦刀冷冻消融术及经动脉化疗栓塞术(TACE)在肝癌、肾癌、肺癌等治疗中取得了良好的效果,而其在肾上腺肿瘤的治疗中应用并不多见[1]。本研究总结2006年6月至2010年9月期间我院对16例肾上腺恶性肿瘤患者行氩氦刀冷冻消融联合TACE治疗,评价其安全性和疗效。
1 材料与方法
1.1 材料
1.1.1 一般资料 本组16例患者,男12例,女4例,年龄25~80岁,平均55岁。肾上腺原发肿瘤3例(肾上腺皮质癌2例,嗜铬细胞瘤1例,均为手术切除后局部复发),转移瘤13例(原发肿瘤为肝癌4例,肺癌3例,肾癌2例,Von Hippel-Lindau病、贲门癌、胰腺癌、结肠癌各1例);病变在右侧10例,左侧6例。肿瘤大小为19.7 mm×14.4 mm~109.5 mm×75.5 mm,平均44.1 mm×38.5 mm。术前患侧腰部酸痛不适3例,嗜铬细胞瘤1例表现为阵发性高血压(155~241/93~115 mmHg),肾上腺皮质癌1例表现为库欣综合征,1例表现为血压升高(122~164/86~98 mmHg)。所有转移瘤患者均无肾上腺功能异常。
1.1.2 仪器设备 美国Endocare公司生产的氩氦刀超导手术系统 (Endocare Cryocare Surgical Systerm 氩氦刀),配有直径2、3、5、8 mm 插入式冷冻刀;2排螺旋 CT机 (SIEMENS Spirit CT 2006 C2),扫描参数:管电压:120 kV,管电流:265 mAs,层厚:3 mm;DSA 为 SIEMENS AXIOM Artis dTA。
1.2 方法
1.2.1 治疗方法 所有患者氩氦刀术前1周内行肾上腺肿瘤TACE(方案:碘油2~15 ml+表柔比星5~30 mg),冷冻术后1个月视肿瘤残留情况对肾上腺肿瘤行TACE 1~4次或再次给予氩氦刀治疗。转移瘤患者同时对原发灶进行治疗。所有手术均在心电监护下进行,动态监测心电、血压、心率等。1.2.1.1 TACE:改良Seldinger技术穿刺右侧股动脉后行肾上腺肿瘤 TACE 治疗[2]。
1.2.1.2 氩氦刀:患者取侧卧或俯卧位,CT扫描定位后行肾上腺肿瘤冷冻治疗[3],术后常规给予止血、酌情预防感染、水化等处理,心电监护24 h。
1.2.2 疗效评价 参考mRECIST[4]标准,应用增强CT测量靶目标直径进行局部疗效评价:瘤体没有增强为完全缓解(CR);瘤体强化直径减少30%以上为部分缓解(PR);瘤体强化直径增加20%以上为进展(PD);瘤体强化直径介于PR和PD之间为稳定(SD)。
1.2.3 随访 氩氦刀冷冻联合TACE治疗术后1个月行增强CT扫描,以后每间隔1~3个月复查增强CT监测局部复发情况,随访期间发现肿瘤局部表现增大时追加TACE或冷冻治疗。术后随访8~39个月,平均随访时间19.7个月。
2 结果
2.1 TACE治疗结果
本组16例共行TACE 52次,平均每例3.25次。冷冻术前造影示肾上腺肿瘤供血动脉增粗、迂曲,实质期肿瘤明显染色13例、较淡染色3例,静脉期未见引流静脉增粗,所有肿瘤未见明显动静脉瘘形成。本组患者肾上腺肿瘤供血动脉分布:右膈下动脉6例、右肾上腺中动脉2例、右肾上腺下动脉8例、左膈下动脉2例、左肾上腺中动脉3例、左肾上腺下动脉5例,其他血管5例(如肾动脉、腰动脉、肠系膜上动脉等)。再次TACE治疗时,造影发现肿瘤供血动脉者给予栓塞治疗,未发现供血动脉者转移瘤仅行原发病灶的治疗,原发肾上腺肿瘤参考上次造影图像给予相应动脉开口处稍上方灌注化疗。
2.2 氩氦刀治疗结果
本组病例共行氩氦刀治疗21次,使用冷冻刀36把。术中CT扫描冰球完全覆盖病灶12例 (图1)。16例中,氩氦刀治疗1次13例,4次1例(肿瘤体积巨大)治疗,2次2例治疗。
2.3 临床疗效
氩氦刀联合 TACE治疗术后 1、3、6、12和 18个月临床疗效评估见表1。联合治疗术后6个月评估,直径小于50 mm且冰球可完全覆盖者其局部缓解率为90.9%,而直径大于50 mm者则效果不佳,局部缓解率仅为40.0%。采用寿命表法计算中位生存期为19.2个月(图2)。2例术前高血压患者血压明显下降(105~142/76~94 mmHg)。患者主要死因为原发肿瘤进展致全身多脏器功能衰竭。
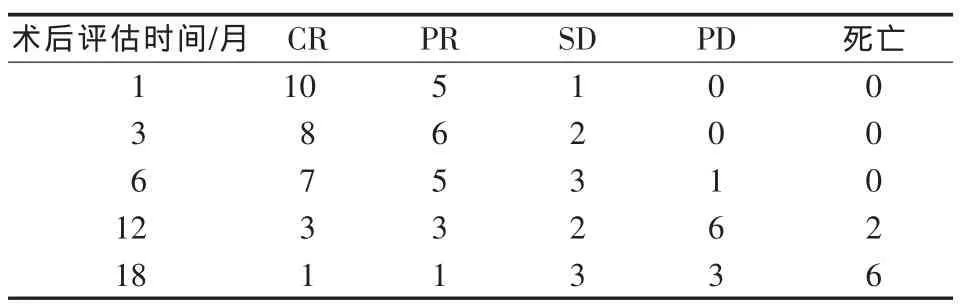
表1 16例肾上腺肿瘤患者联合治疗术后临床疗效评估(例)
2.4 并发症
所有患者冷冻术后均出现患侧腰部轻到中度酸痛感,于1~3 d内消失;术后发热6例(<38.5℃),局部瘤周少量出血3例,血尿1例,给予对症处理后好转。冷冻术中除2例术前即有血压升高的患者出现恶性高血压外 (最高分别为217/159 mmHg和233/173 mmHg,给予酚妥拉明5 mg静脉推注、硝苯地平片含服后血压维在124~136/79~92 mmHg),其余患者血压均无明显升高。未出现术后低血容量休克、胃肠道及大血管损伤等严重并发症。TACE术后患侧腰部酸痛5例,低热1例,自行好转。TACE术中、术后血压无明显改变,无其他并发症发生。
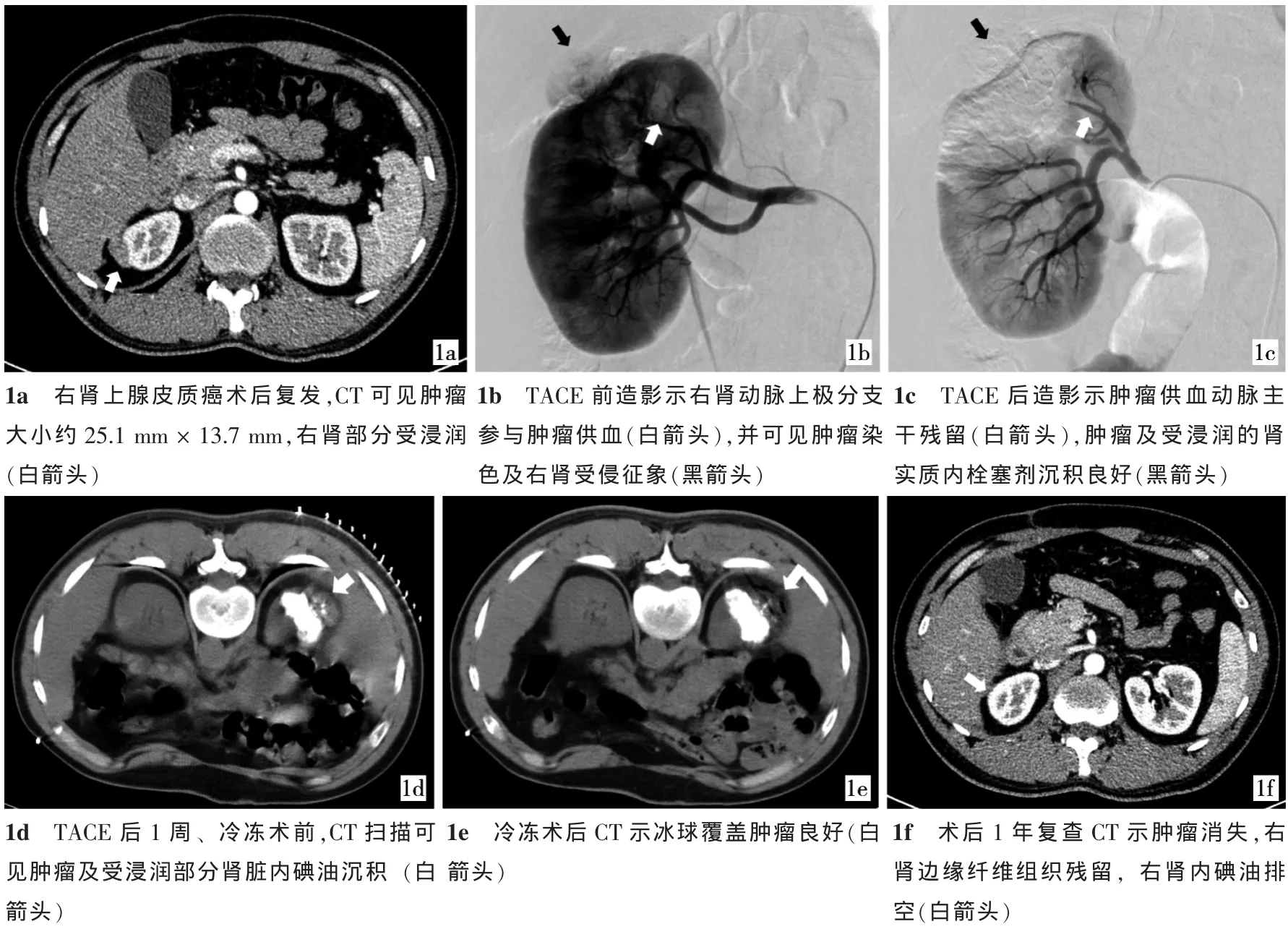
图1 右侧肾上腺皮质癌术后复发行氩氦刀联合TACE治疗前后图像
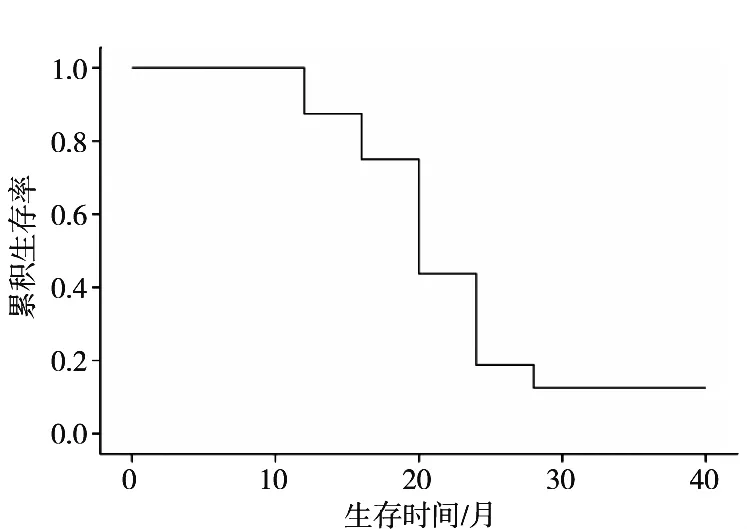
图2 累积生存曲线
3 讨论
肾上腺肿瘤的发病率约为1%,其中以转移性肿瘤较为常见[5]。目前关于肾上腺肿瘤的治疗以腹腔镜下保留肾上腺的肿瘤切除术为首选[6],然而临床上多数患者由于病变侵犯大血管、身体状况不佳、术后复发或局部组织粘连而不宜接受腹腔镜治疗。已有应用射频、冷冻、乙醇注射等局部消融及TACE 治疗肾上腺肿瘤的报道[2,5,7-12]。 TACE 治疗时常因肿瘤呈乏血供或供血动脉细小、变形和迂曲而效果不佳。物理消融治疗常由于病变靠近重要组织、脏器而使治疗不彻底,且受局部血流影响较大;化学消融常因肿瘤的成分致密度不同或其间存在纤维隔膜而致药物在肿瘤内弥散不均等。
氩氦刀通过快速的冻融导致细胞膜破裂、细胞脱水、蛋白质变性、局部组织缺血缺氧等实现对肿瘤细胞的杀伤作用[1],而TACE则可以阻塞肿瘤血管及实现局部高浓度化疗药物对肿瘤细胞的杀伤作用,并且可以减少消融术中的出血。在氩氦刀治疗前行TACE可以缩小肿瘤体积,降低局部血流量,减少冷冻消融中能量损失,增强肿瘤细胞对冷冻治疗的敏感性;冷冻后再次行TACE可以对残存的肿瘤细胞进行补充治疗,冷冻损伤的肿瘤细胞对化疗的敏感性亦增加,同时可以减少术中化疗药物的用量,降低化疗的不良反应。本组病例在首次氩氦刀联合TACE治疗后1个月其局部有效率(CR+PR+SD)为 100%,缓解率(CR+PR)为93.75%。 联合治疗后随访8~39个月,患者中位生存期为19.2个月,目前关于转移性肾上腺肿瘤的生存期因治疗方法的不同各家报道差异较大。刘娇等[7]报道可手术根治性切除的转移性肾上腺肿瘤患者的平均生存期为(34.5 ± 4.8)个月,而李红英等[8]报道的肺癌伴肾上腺转移患者行全身静脉化疗中位生存期仅为8个月。本组病例中5例患者局部效果不理想,主要原因为肿瘤较大(直径>50 mm),其冷冻术中冰球难以完全覆盖,以及TACE术后再次行TACE时肿瘤新生及侧支血管形成,其联合治疗术后6个月局部缓解率仅40%,故对于大于50 mm的肿瘤治疗时仍以减轻肿瘤负荷为主,但对于小于50 mm且冰球可完全覆盖者,术后6个月局部缓解率为90.9%,疗效确切。姚红响等[2]报道的单纯肾上腺肿瘤供血动脉栓塞术后3个月约75.4%的患者疗效较好,而我们联合治疗的病例3个月时临床缓解率为87.5%。
肾上腺肿瘤消融治疗有其特有的风险,即对分泌儿茶酚胺类物质(catecholamine,CA)细胞的刺激及破坏致其释放入血导致恶性高血压。文献中上述并发症主要发生在有分泌功能的肿瘤的治疗过程中,但亦有对无分泌功能的肾上腺肿瘤治疗时发生恶性高血压的报道[9],甚至发生Tsoumakidou综合征[10],其机制主要为含有CA的细胞(具有分泌功能的肿瘤细胞和正常的肾上腺髓质细胞)在消融治疗时受到刺激或细胞膜破裂、细胞溶解,其中的CA释放入血致血压升高。本组16例氩氦刀冷冻术中,除2例分泌CA的肿瘤患者在复温时出现血压升高外,其他均未见明显血压升高,与目前所报道的文献[5,12]中肾上腺肿瘤的冷冻消融治疗多数无明显血压升高或仅表现为一过性血压升高基本一致。Welch等[11]则报道了12例无功能性肾上腺转移瘤中5例患者在术中复温时出现了高血压危象、1例患者于冷冻结束后(复温后)随即出现高血压危象,且术中患者的血压较对照组血压有所升高。通过比较发现,本组病例肿瘤大小约为44 mm,而Welch和其他发生恶性高血压病例中肿瘤的大小约为25 mm,推测其可能原因为,我们转移瘤体积较大几乎完全破坏正常肾上腺皮髓质,冷冻时无或很少CA的细胞破坏,未发生高血压危象。尽管转移性肾上腺肿瘤局部消融治疗时恶性高血压的发生率很低,有学者认为术前应常规应用α受体阻滞剂4~5 d,对于应用α受体阻滞剂的患者出现心动过速时可以给予适量的β受体阻滞剂以降低心脏负荷[12],以保证治疗的安全性。
[1]Tatli S,Acar M,Tuncali K,et al.Percutaneous cryoablation techniques and clinical applications [J].Diagn Interv Radiol,2010,16:90-95.
[2]姚红响,陈根生,颜志平,等.肾上腺转移癌介入化疗栓塞的探讨[J].介入放射学杂志,2005,14: 139-141.
[3]许 健,曹建民,卢光明,等.CT引导下经皮穿刺氩氦刀靶向冷冻治疗肾癌[J].介入放射学杂志,2008,17:667-669.
[4]Lencioni R,Llovet JM.Modified RECIST (mRECIST) assessment for hepatocellular carcinoma[J].Semin Liver Dis,2010,30: 52-60.
[5]Beland MD,Mayo-Smith WW.Ablation of adrenal neoplasms[J].Abdom Imaging,2009,34: 588-592.
[6]Kalan MM,Tillou G,Kulick A,et al.Performing laparoscopic adrenalectomy safely[J].Arch Surg,2004,139: 1243-1247.
[7]刘 娇,孔垂泽.肾上腺转移癌66例诊治分析 [J].中国医科大学学报,2012,4:380-381.
[8]李红英,鲍云华.肺癌肾上腺转移30例分析 [J].中国肺癌杂志,2002,5:293-294.
[9]Atwell TD,Wass CT,Charboneau JW,et al.Malignant hypertension during cryoablation of an adrenal gland tumor[J].J Vasc Interv Radiol,2006,17: 573-575.
[10] Tsoumakidou G,Buy X,Zickler P,et al.Life-threatening complication during percutaneous ablation of adrenal gland metastasis: Takotsubo syndrome[J].Cardiovasc Intervent Radiol,2010,33:646-649.
[11]Welch BT,Atwell TD,Nichols DA,et al.Percutaneous imageguided adrenalcryoablation: proceduralconsiderationsand technical success[J].Radiology,2011,258: 301-307.
[12] Lauer E,Del Pizzo JJ,Raman JD.Needlescopic ablation of small adrenal masses[J].Curr Urol Rep,2009,10: 73-77.

